为什么能用碳酸氢钠溶液制碳酸锰沉淀?——由一道高考题说开
蔡文锁
(南京市第一中学 江苏 南京 210001)
2010 年江苏化学高考第15 题涉及到MnCO3的制取,有关内容如下:
高纯MnCO3是制备高性能磁性材料的主要原料。 实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:(略1)(2) 制备高纯MnCO3固体: 已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7。 请补充由(1)时制得的MnSO4制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①______;②______;③______;④______;⑤低于100℃。
答案如下:①边搅拌边加入NaHCO3(或Na2CO3),并控制溶液pH <7.7;②过滤,用少量水洗涤2~3 次;③检验SO42-是否洗涤干净;④用少量C2H5OH 洗涤。
不少教师对能用NaHCO3制MnCO3感到疑惑不解。认为:按照复分解反应的规律应该生成Mn(HCO3)2;按照溶液中CO32-和OH-离子浓度的大小关系, 应生成Mn(OH)2;根据NaHCO3溶液的pH 值以及 “开始沉淀时” 应生成Mn(OH)2。 听似有理,其实忽略了NaHCO3是一个两性物质,其溶液中存在多个平衡关系, 不少练习题中认为的c(OH-)>c(H+)>c(CO32-)并不正确。 详细分析如下:
1.c(OH-) 和c(CO32-)究竟哪个大?
计算25℃时,0.10mol/L 的NaHCO3溶液中离子的浓度。
已知[1]H2CO3的Kal=4.2×10-7,Ka2=5.6×10-11
物料守恒关系式:
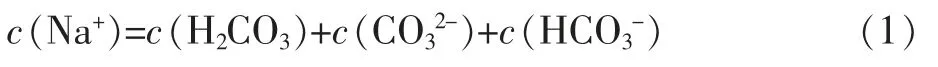
电荷守恒关系式:
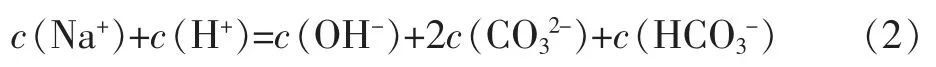
将(1)式代人(2)式得:
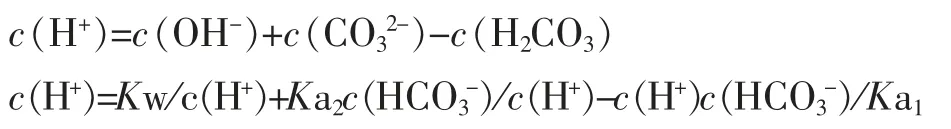
整理得到

由于HCO3-消耗甚少,所以c(HCO3-)≈0.10mol/L,
又有Ka2c(HCO3-)>>Kw,Ka1+c(HCO3-)≈c(HCO3-),且c(HCO3-)>20Ka1,故得到最简式
将Ka1Ka2数据代入计算,得c(H+)≈4.85×10-9mol/L,继而得
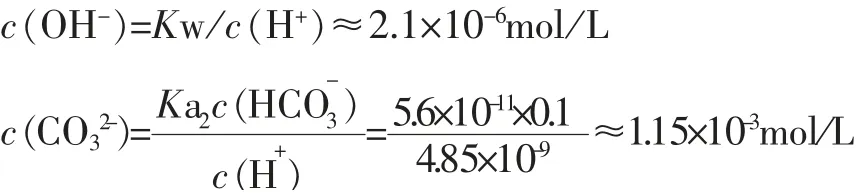
可见0.10mol/L 的NaHCO3溶液中,CO32-离子浓度远大于OH-
2.Mn(OH)2 和MnCO3 哪个溶解性大?
查 书[2]的Mn(OH)2的Ksp [Mn(OH)2]=1.9×10-13,MnCO3的Ksp[MnCO3]=1.8×10-11,设溶度积条件下两者的溶解度分别为x,y,则有:
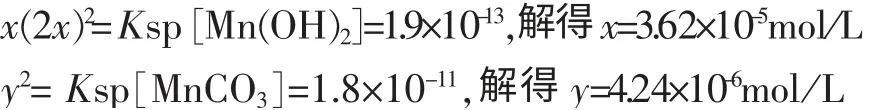
可见同条件下Mn(OH)2的溶解度大于MnCO3。
3.结论
向MnSO4溶液中加入NaHCO3溶液, 由于CO32-离子浓度大于OH-的离子浓度,且MnCO3的溶解性小于Mn(OH)2,所以肯定可得到MnCO3沉淀。 其实NaHCO3是一种碱性弱于Na2CO3的常用沉淀剂, 可用来制备某些碳酸正盐,如PbCO3[3]。 用Na2CO3做沉淀剂时,根据金属氢氧化物和碳酸盐溶解度的相对大小,可能得到正盐,可能得到氢氧化物,也可能得到碱式碳酸盐。
[1][2] 华中师范大学等.分析化学[M].北京:高等教育出版社,2001:352
[3] 黄孟健.无机化学答疑[M].北京:高等教育出版社,1989:328

