高温高湿环境对生长猪生长性能、血浆皮质醇浓度和免疫功能的影响
刘胜军 卢庆萍 张宏福 李 辉
(中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193)
现代集约化养猪生产中,环境应激对猪只生产和健康的影响不容忽视。热环境往往是影响养猪产业发展的重要因素之一,尤其在我国南方大部分地区,夏季湿热的气候对猪只的危害更为严重。受环境热应激的影响,猪只生长缓慢,出栏时间延长[1],免疫机能降低,对病原微生物的抵抗力下降[2-3]。然而,由于应激反应体系的复杂性,应激对机体的影响不局限在单一的某一系统,而已涉及到神经内分泌免疫网络[3],所以很难明确机体免疫系统对应激做出的具体应答。在热环境中,温度和湿度是最敏感的2个因素,两者对猪只免疫应答的影响是否存在交互作用,尚不得而知。因此,本试验通过人工气候舱来模拟我国南方夏季高温高湿气候,探讨环境温湿度对猪生长和免疫力的影响,为今后实施养猪环境预警控制以及建立健康养殖工艺技术标准提供理论依据。
1 材料与方法
1.1 试验设计与动物分组
试验采用2×2双因子完全随机设计,2个温度水平[23和33℃],2个湿度水平(相对湿度为55%和80%)。选取体重(30.00±1.72)kg、遗传基础接近、健康的杜×长×大三元杂交阉公猪24头,安装颈静脉血导管,手术恢复后分别饲养在4个人工环境控制舱中,为4个试验处理,每个处理设6个重复,每个重复1头猪,单笼饲养。4个舱每日光照14 h,强度50 lx,舱内持续均匀通风。自由采食、饮水,试验持续14 d结束。
1.2 试验饲粮
试验饲粮采用常规玉米-豆粕型饲粮,参照NRC(1998)20~50 kg生长猪营养需要推荐量配制,其组成及营养水平见表1。
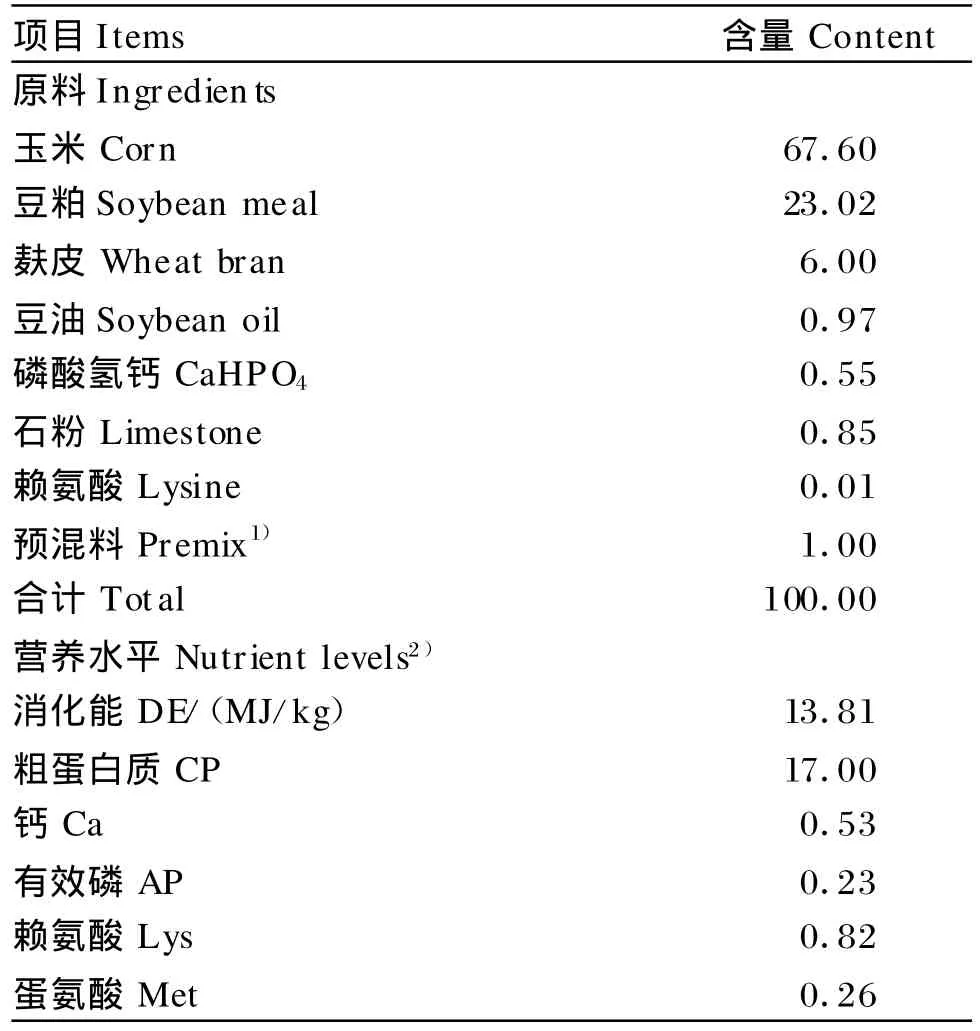
表1 试验饲粮组成和营养水平(风干基础)Tab le 1 Com position and nutrient levels of the trail diet (air-dry basis)%
1.3 样品采集
于试验的第1天、第7天、第14天08:00(空腹)从每只猪血导管抽取10 m L血液。一部分用肝素抗凝;另一部分制作血浆,4℃下3 000 r/m in离心15 m in,取上清液分装于离心管中,-20℃冷藏保存备测。
1.4 指标测定方法
每天08:00和16:00称剩料重,统计14 d每头猪的总采食量。试验开始和结束时空腹称重,称重在08:00进行。计算平均日采食量(ADFI)、平均日增重(ADG)和料重比(F/G)。
由中国中医研究院西苑医院采用细胞分离法测定白细胞、中性粒细胞及淋巴细胞数量,采用流式细胞仪法测定外周血T淋巴细胞分布情况(M ouse Anti-pig CD4a FITC,Mouse Anti-pig CD8a RPE试剂来源于Southern Biotechnology Associates, Inc.)。采用M TT法测定外周血淋巴细胞转化率。由中国农业科学院原子能研究所采用放射免疫法测定血浆皮质醇浓度,皮质醇浓度测定试剂盒来源于北京普尔伟业生物技术有限公司。
1.5 数据处理
结果以平均值±标准差表示,数据采用SPSS 16.0软件进行双因素方差分析,以P<0.05作为差异显著性判断标准。
2 结 果
2.1 高温高湿环境对生长猪生长性能的影响
由表2可见,环境温度、湿度均会影响猪的生长性能,但温湿度的互作效应不显著(P>0.05)。在不考虑湿度的情况下,暴露于33℃高温环境下的生长猪ADFI、ADG显著降低(P<0.01),F/G显著升高(P<0.01)。在不考虑温度的情况下,处于相对湿度80%的试验猪与55%相比,ADFI有下降趋势(P>0.05),但ADG显著降低(P<0.01)、F/G显著升高(P<0.01)。

表2 高温高湿环境对生长猪生长性能的影响Tab le 2 Ef fects of high ambient temperature and hum idity on grow th performance o f growing pigs
2.2 高温高湿环境对生长猪血浆皮质醇浓度、免疫功能的影响
高温高湿环境对生长猪血浆皮质醇浓度、免疫指标的影响见表3、表4、表5。在试验设定的环境温湿度条件下,环境温度对白细胞及其分类、淋巴细胞转化率、T细胞亚群、血浆皮质醇浓度有不同程度影响,而环境湿度以及温度和湿度的互作效应对其影响均不显著(P>0.05)。在不考虑湿度的情况下,环境高温显著降低第7天试验猪白细胞总数(P<0.05),显著提高第1天试验猪的中性粒细胞数量(P<0.01)和中性粒细胞/淋巴细胞(N/L)值(P<0.01)。
血浆皮质醇浓度在第1天(P<0.01)、第7天(P<0.05)受环境温度的影响显著,在不考虑湿度的情况下,随温度的升高,呈波动性变化,第1天升高,到第7天却下降,到第14天又恢复到正常温度的水平。环境温度对聚羟基脂肪酸酯(PHA)刺激的T淋巴细胞转化率无显著影响(P>0.05),而在第1天、第7天显著影响脂多糖(LPS)刺激的B淋巴细胞转化率(P<0.05),不考虑湿度的情况下,随环境温度的升高,B淋巴细胞转化率升高。
外周血T淋巴细胞亚群分布受环境温度的影响各异,温度对CD 8+细胞数量无显著影响(P>0.05),而显著影响第14天CD4+细胞数量(P<0.05)和CD 4+/CD 8+值(P<0.05),在不考虑湿度的情况下,随环境温度升高,CD4+细胞数量减少, CD4+/CD8+值降低。

表3 高温高湿环境对生长猪白细胞分类的影响Tab le 3 Effects o f high am bient temperature and hum idity on leukocy te classification in grow ing pigs

表4 高温高湿环境对生长猪血浆皮质醇浓度和淋巴细胞转化率的影响Table 4 Ef fec ts of high ambient temperature and hum idity on p lasma cortisol concentration and lymphocy te p ro liferation in growing pigs

表5 高温高湿环境对生长猪T细胞亚群的影响Tab le 5 Effects o f high ambient tem perature and hum idity on T-lymphocy te subsets in grow ing pigs
3 讨 论
3.1 高温高湿环境对生长猪生长性能的影响
现代养猪生产中,环境高温、高湿是降低猪生长性能、延长出栏周期的潜在的应激因子。众多研究表明,热应激降低猪的ADFI、ADG[4-6],增加F/G[7-8]。本试验也得出一致的结果,在不考虑湿度的情况下,暴露于33℃高温环境下的生长猪ADFI、ADG均显著降低,F/G显著升高。本试验中,不考虑温度的情况下,相对湿度从55%升高到80%,ADFI呈下降趋势,ADG显著降低,从而引起F/G显著升高,说明环境高湿同样不利于猪的生长。Huynh等[5]研究了不同相对湿度(50%、65%、80%)对60 kg的肥育猪生长性能的影响,发现处于相对湿度50%环境下的ADG最高,而80%环境下的最低,并且当温度由等热区上限临界温度逐渐升高时,处于相对湿度80%环境下的猪ADG降低最快。本试验结果虽然显示温湿度对猪生长性能的影响无显著交互作用,但高温环境下,湿度升高对生长的影响有加重的趋势。在热应激环境下,猪为维持体热平衡,会通过降低采食、提高呼吸频率等行为来减少产热,增加散热。空气湿度越高,蒸发散热受阻,无形中加剧了猪体的热负担,环境热效应就越明显,对生长的影响就会越严重。
3.2 高温高湿环境对生长猪血浆皮质醇浓度、免疫功能的影响
环境应激对动物免疫功能的影响,普遍的观点认为,强烈而持久的应激主要导致动物机体免疫功能下降,而应激激活下丘脑-垂体-肾上腺皮质轴(HPA),引起糖皮质激素水平升高,是抑制免疫细胞功能的主要因素[3,9]。从本试验结果来看,环境温度对猪的皮质醇浓度、免疫功能均有不同程度的影响,而环境湿度的影响却不明显,并且温、湿度的互作效应也不明显,可见温度是影响猪只健康的主要环境因素。
在本试验设定的条件下,无论湿度如何,受高温的猪血浆皮质醇浓度在第1天显著升高,在第7天却显著降低,到第14天又恢复到正常温度的水平。看来血浆皮质醇浓度受环境热应激的影响,具有时效性。第1天升高,说明短期急性高温引起HPA轴激活,导致糖皮质激素大量释放。随着应激时间的延长,皮质醇浓度下降,Heo等[10]、Sutherland等[11]的研究也出现了类似的结果,这有可能是由于受长期热应激的影响,皮质醇的周转速率加快。此外,持续的热应激能降低HPA轴对热环境本身的敏感性和反应性,破坏了HPA轴的负反馈调节通路[12],也会引起皮质醇浓度降低。
高温能引起第7天的白细胞总数下降,对淋巴细胞数量的影响不大,而在第1天显著升高中性粒细胞数量,从而引起N/L值升高。中性粒细胞增多是动物应激的普遍反应,可能是因高浓度的糖皮质激素改变了中性粒细胞的输送方式,使中性粒细胞从骨髓储备中释放出来[13-14],而本研究结果中第1天皮质醇浓度显著升高,正好与此推测一致。T、B淋巴细胞是获得性免疫的主要力量,分别主导细胞免疫和体液免疫。从本试验结果来看,不考虑湿度的情况下,环境高温对PHA刺激的T淋巴细胞转化率无明显影响,而在第1天、第7天显著升高LPS刺激的B淋巴细胞转化率。这与Sutherland等[11]和M orrow-Tesch等[15]的研究结果一致,说明不同的淋巴细胞,受热应激的影响不一样,而且还与应激的强度、持续时间有关。
正常的免疫应答是各种免疫细胞,特别是T细胞亚群之间的相互促进或相互制约来完成的,使之能清除抗原异物,又不损伤机体自身组织。T细胞是机体免疫应答的核心细胞,根据其表面分化的抗原的不同,分为若干亚群。各T细胞亚群的数量及其比例(CD 4+/CD 8+)的正常是机体免疫系统功能正常的主要标志。在受环境高温的第14天,CD4+T细胞数减少,而整个时期内,CD8+T细胞的数量变化不大,从而引起CD4+/CD 8+值降低,导致T细胞亚群失衡,意味着细胞免疫功能处于紊乱状态[16-17]。总体来看,湿度并非是影响猪免疫功能的主要环境因素。在适温的环境下,高湿度对猪的免疫力并没有多大影响;但在高温环境下,湿度升高,热效应增强,显然会加重对猪健康的危害。
热应激能引起HPA轴激活,糖皮质激素释放,但血浆皮质醇浓度并非总处于高位,本试验结果显示,热暴露猪血浆皮质醇浓度在第1天升高,然后降低。热应激能降低机体免疫力,但免疫系统的应答并非一味的受到抑制,本试验结果显示,热暴露猪B细胞介导的体液免疫功能在第1天、第7天反而有所增强。可见,环境热应激引起的免疫功能变化并非完全受糖皮质激素的调控,有研究表明,糖皮质激素作用于免疫细胞是需要与免疫细胞表面受体结合才能发挥作用[18],而目前热应激对糖皮质激素受体表达的影响尚不得而知,所以说热应激对免疫系统的影响具有复杂性。但随着热暴露时间延长,T细胞亚群分布发生紊乱,说明持续的高热能降低细胞免疫功能,可能引起实际生产中的猪抗病力下降。
4 结 论
①环境高温、高湿均能降低生长猪的生长性能。
②血浆皮质醇浓度受高温影响具有时效性,呈先开升高后降低的趋势。
③单纯的环境高湿对猪免疫功能的影响不大, B细胞功能受高温的影响短期内有增强的表现,持续高温能使T细胞亚群分布紊乱,进而降低猪的细胞免疫功能,从而引起抗病力下降。
[1] HYUN Y,ELLIS M,R ISKOWSK I G,et al. G row th per form ance of pigs sub jec ted to multiple concurrent environmental stressors[J].Journal of Anim al Science,1998,76:721-727.
[2] HICKS T A,MCGLONE J J,WH ISNANT C S, et al.Behavioral,endocrine,imm une,and performancemeasures for pigs exposed to acute stress [J].Journal o f Anim al Science,1998,76:474-483.
[3] MOBERG G P,MENCH JA.The biology of animal stress[M].W allingford:CAB International, 2000.
[4] X IN H,DESHAZER JA.Feeding system s of growing pigs at w arm constant and cycle temperatures [J].Transactions of the ASABE,1992,35:319-323.
[5] HUHNH T T T,AARN INK A JA,VERSTEGEN M W A,etal.Ef fects o f increasing temperatures on physiological changes in pigs atdifferent relative hum idities[J].Journal o f Anim al Science,2005,83: 1385-1396.
[6] 刘圈炜,卢庆萍,张宏福,等.持续高温对生长猪生长性能及养分消化率的影响[J].动物营养学报,2009, 21(6):982-986.
[7] RENAUDEAU D,HUC E,NOBLET J.Acclim ation to high ambient tem perature in Large W hite and Caribbean Creole growing pigs[J].Journal of Animal Science,2007,85:779-790.
[8] WH ITE H M,R ICHERT B T,SCH INCKEL A P. Effects o f temperature stress on grow th perform ance and bacon quality in grow-finish pigs at tw o densities [J].Journal o f Animal Science,2008,86:1789-1798.
[9] SALA K-JO HNSON J L,MCGLONE J J.Making sense of apparently conflicting data:stress and immunity in sw ine and cattle[J].Journal o f Animal Sc ience,2007,85:E81-E88.
[10] HEO J,KATTESH H G,ROBERTSM P,et al. Hepatic corticosteroid-binding globulin(CBG)messenger RNA exp ression and plasm a CBG concentrations in young pigs in response to heat and social stress[J].Journal o f Anim al Science,2005,83: 208-215.
[11] SUTHERLAND M A,N IEKAMP S R,RODRIGUEZ-ZAS S L,et al.Im pacts o f chronic stress and social status on various physiological and perform ance m easures in pigs of different breeds [J].Journal o f Animal Science,2006,84:588-596.
[12] JAFERI A,NOWAK N,BHATNAGAR S.Negative feedback functions in chronically stressed rats: role of the posterior paraventricular thalamus[J]. Physio logy&Behavior,2003,78:365-373.
[13] ROTH JA,KAEBERLEM L.Effect of glucocorticoids on the bovine imm une system[J].Journal of the Am erican Veterinary M edical Association, 1982,180:894-901.
[14] M URATA H,TAKAHASH I H,MATSUMOTO H. The e ffects of road transportation on peripheral b lood lym phocyte subpopulations,lymphocy te blastogenesis and neutrophil function in calves[J]. British Veterinary Journal,1987,143:166-174.
[15] M ORRO W-T ESCH J L,MCGLONE J J,Salak-Johnson J L.Heat and social stress effects on pig immune measures[J].Journal of Animal Science, 1994,72:2599-2609.
[16] 杨汉春.动物免疫学[M].2版.北京:中国农业大学出版社,2003.
[17] 胡艳欣.慢性热应激对机体免疫功能影响的研究[D].博士学位论文.北京:中国农业大学,2007.
[18] BALM PAUL H M.Stress physio logy in animals [M].Shef field:Shef field Academ ic Press,1999.
*Correspond ing au thor,p rofessor,E-m ail:zhangh f6565@vip.sina.com
(编辑 田艳明)

