炎性肌纤维母细胞瘤影像学表现与病理学分析
吕绍茂,段少银,韩 丹,王金岸,叶 锋,梁昆如
(1.厦门大学附属中山医院影像科,福建 厦门 361004;2.昆明医学院第一附属医院CT室,云南 昆明 650032)
炎性肌纤维母细胞瘤 (Inflammatory myofibroblastic tumor,IMT)是近年来逐渐认识并于2002年被WHO正式命名的一种少见而独特的间叶性肿瘤[1]。过去认识不够充分,故在命名方面较为混乱,包括炎性假瘤、浆细胞肉芽肿、纤维黄色肉芽肿、肌纤维母细胞瘤、粘液样错构瘤、假肉瘤、炎症性纤维肉瘤等,尤以炎性假瘤常见。本文探讨12例不同部位的IMT影像学表现及对其病理学特征进行分析,旨在提高对该病的认识。
1 材料与方法
1.1 临床资料
回顾性分析2006年5月~2009年4月手术病理证实的并具有完整影像学检查资料的IMT患者12例,全部病理切片均由经验丰富的病理主任医生复诊。12例中男6例,女6例,年龄16~80岁,中位年龄49岁,病变位于乳突1例,鼻咽2例,鼻窦1例,肺部2例,纵隔2例,食道1例,胃窦1例,肝脏1例,腹膜后1例,膀胱1例。3例行CT平扫,10例平扫后行多期增强扫描,2例行MR检查,1例行食道钡餐检查。
1.2 检查方法
采用64层Light Speed VCT进行扫描,扫描参数分别为:120kV,180~250mA,层厚5mm,1.25mm,间距5mm,2.5mm,螺距0.75或0.635,增强扫描以2.5~3.0ml/s的流速用高压注射器经肘静脉注入非离子造影剂(300mgI/ml),胸部增强扫描延迟时间实质期为65s,头颈部增强扫描时间为开始注射造影剂后45s,腹部病变均行双期或三期增强扫描,动脉期扫描时间为开始注射造影剂后25~30s,静脉期为65s,延迟期为180s。
采用GE signal HD1.5T MR扫描,层厚5mm,层间距1.0mm,行横断面、冠状面、矢状面扫描。对比剂为钆替喷酸葡甲胺(Gd-DTPA),剂量0.1mmol/kg。钡餐检查采用Siemens ICONOS R200数字胃肠机,吞钡后6帧/s连续点片动态观察。
1.3 病理学观察方法
病理标本均做石蜡切片及HE染色观察,免疫组化标记:VIM、SMA、MSA、CKpan、ALK、S-100蛋白、CD34、CD117和Ki267。试剂均购自北京中山生物技术有限公司,采用工作液(即用型)试剂,方法为PV9000法。
免疫组化阳性结果判断:VIM、SMA、MSA、CK、CD34、CD117均以肿瘤细胞质出现棕黄色颗粒为阳性细胞,ALK以肌纤维母细胞质有棕黄色颗粒为阳性细胞,S-100蛋白、Ki267以细胞核有棕黄色颗粒为阳性细胞。阳性病例半定量积分采用阳性细胞比例和显色强度记分法。
2 结果
2.1 影像学表现
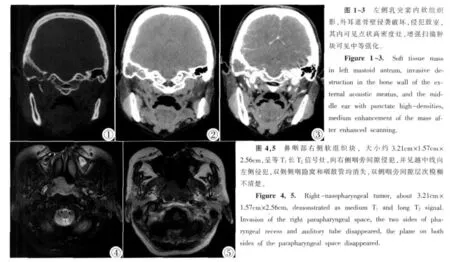
发生在头颈部4例,乳突窦1例(图1~3),鼻窦及鼻咽各1例,均见骨质破坏,肿块侵犯周围结构,平扫CT表现不规则软组织肿块,增强可见中度均匀或不均匀强化;发生在鼻腔内的肿块,T1WI呈现等信号,T2WI为高信号(图4,5)。
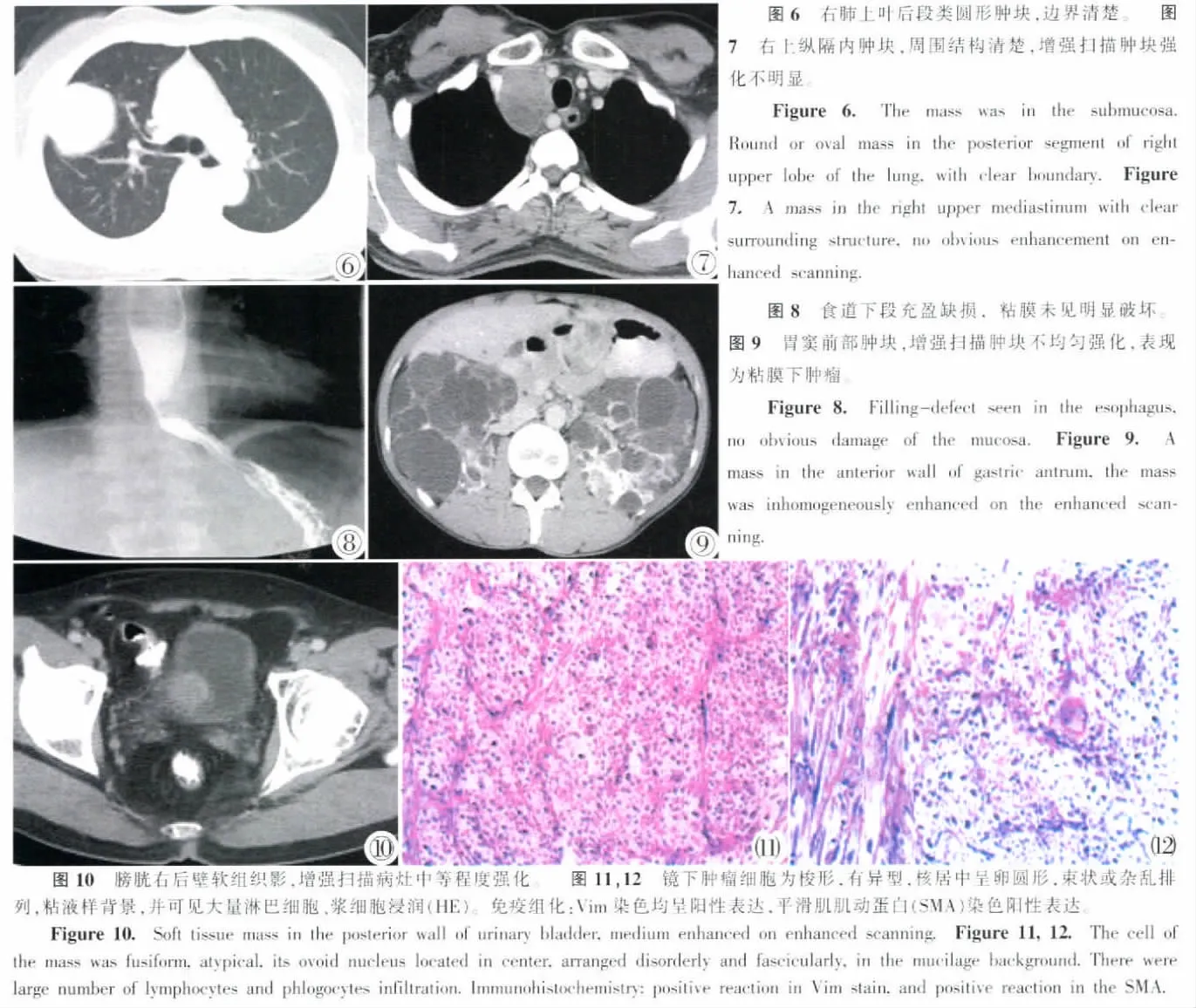
肺内病变2例,病灶直径约为1.5~3.5cm,均为外周病灶,1例边界光滑(图6),密度均匀,1例边界不清,周围可见片状渗出影,其内密度不均,定期复查病灶有缩小趋势,纵隔病变2例,1例为边界清楚肿物(图7),平扫CT值36HU,增强扫描实质期CT值约为43HU,另1例为前上纵隔内软组织肿块,边界不清,血管受压变形,增强扫描肿块中等程度强化。
胃肠道病灶3例(图8,9),食道1例,位于食道下段,钡餐显示边界清楚的充盈缺损,CT扫描为食道下段管壁环形增厚,增强扫描中等程度强化。胃窦部1例,表现为边界清楚的软组织肿块,向腔外生长,平扫CT值为25HU,增强扫描呈现渐进性强化,实质期CT值约为75HU,1例发生在十二指肠,外院胃肠道钡餐及CT检查提示十二指肠水平段占位,MR表现为肠壁环形增厚,为等长T1、等稍长T2及脂肪抑制序列(STIR序列)高信号肿块灶,增强扫描呈现中等程度不均匀强化。腹膜后1例,表现右侧腹膜后巨大软组织肿块,并伴有大量腹水,双肺可见转移灶,为恶性肿瘤表现,增强扫描肿块呈现均匀中等程度强化。肝脏1例,平扫肝左叶类圆形低密度灶,周围隐约可见包膜,CT值为44HU,动脉期肿块CT值为53HU,实质期为83HU,周围可见低密度的包膜。膀胱1例,膀胱右侧壁类圆形肿块,边界尚清,平扫CT值约35HU,增强扫描呈现渐进性强化,实质期肿块CT值约为89HU(图10)。
2.2 病理分析
光镜下观察,肿瘤细胞为梭形,有异型,核居中呈卵圆形,胞质丰富呈嗜酸性,束状或杂乱排列,粘液样背景,并可见大量淋巴细胞、浆细胞浸润。免疫组化:12例标本行免疫组化染色检查,其中9例波形蛋白(Vim)染色均呈阳性表达,9例平滑肌肌动蛋白(SMA)染色阳性表达,3例S-100蛋白染色阳性表达,5例结蛋白 (Des)染色2例阳性表达 (图11,12)。
3 讨论
IMT是一种少见独特的间叶性肿瘤,近年来己逐渐得到病理及临床的广泛认同。由于其内可有大量炎性细胞浸润,过去被误认为是一种炎症后的反应性增生,于是炎性假瘤成了最常用的代名词。随着研究的深入,人们发现病变中梭形细胞才是主要成分,而且该病有复发和转移的潜能,肿瘤细胞遗传学研究发现其有染色体的异常,支持这一病变为真性肿瘤,而并非炎性假瘤[2]。2002年WHO定义为“由分化的肌纤维母细胞性梭形细胞组成,常伴大量浆细胞和或淋巴细胞的一种间叶性肿瘤”并将其归为纤维母细胞瘤/肌纤维母细胞肿瘤、间变性、少数可转移类[1]。
3.1 病因和发病机制
IMT的发病原因与机制尚不清楚,有研究认为,可能是因为炎症或创伤后人体对炎症的一种异常或过度反应,最终激活具有增殖潜能的肌纤维母细胞显著增生或失控生长形成肿瘤学病变。已有文献报道IMT可能与感染有关,在某些组织发生的IMT中检测到了EB病毒[3]。
近年细胞遗传学及分子生物学研究证实部分IMT中显示间变性淋巴瘤激酶(ALK)的表达和基因重排,ALK基因重排位点在2p23。肿瘤还显示ALK基因和Rb-2蛋白基因融合,融合部位是原肌球蛋白的2个相关基因TPM3与TPM4,网络蛋白重链(CLTC)和半胱氨酰-tRNA合成酶(CARS)基因是融合的伙伴。这些基因异常的表现进一步证实了IMT的本质是一种克隆性、肿瘤性增生[4]。
3.2 临床特点
IMT可以发生在任何年龄的任何部位,但多位于肺部,其次是肠系膜、网膜或腹膜后。大部分患者起病隐匿,为偶然发现,或因肿瘤挤压周围脏器而出现相应的症状和体征。发生在不同部位有不同的临床表现,而且与病变的进展程度有关。本组病例年龄跨度广泛,中位年龄为49岁,发生在不同器官有不同的临床表现,且与病程长短有关,其中发生在十二指肠的IMT有胰腺炎的病史,发生在肺部的1例IMT患者临床随访,抗炎对症治疗后肿块缩小,提示病灶呈现良性。研究认为发生在鼻窦、鼻咽及腹膜后的炎性肌纤维母细胞瘤应视为恶性[5],可局部复发,本组发生在右侧腹膜后的巨大IMT伴有双肺转移灶,且患者为老年男性,与该报道相符合。
3.3 病理特征
3.3.1 大体检查
IMT为局限性或多结节的实性肿块或息肉样肿物,切面实性多结节状或分叶状,颜色灰白或黄褐,时呈黏液样外观或混杂灶性脂肪及灰白色纤维条索的编织状外观。一般无出血、坏死及囊性变。直径从<1cm到20cm以上不等。肿瘤大多数无包膜,有时有完整包膜。
3.3.2 组织病理学
肿瘤主要由增生的纤维母细胞和肌纤维母细胞组成。细胞呈梭形,胞浆淡嗜酸性,可见核仁。细胞有轻度或灶状异型性,核分裂数量不等,缺乏不典型核分裂。肿瘤中散在大量炎症细胞,多为淋巴细胞、浆细胞,也有组织细胞及嗜酸性粒细胞、嗜中性粒细胞。可分成3种组织学亚型[6]:①粘液型:间质明显水肿及粘液样变,其间穿插梭形的肿瘤细胞;②梭形细胞密集型:瘤细胞常排列成人形或旋涡状,浆细胞穿插于梭形的肿瘤细胞之间,其他炎性细胞常聚集成团;③纤维型:肿瘤细胞稀疏,在玻璃样变的胶原纤维之间有淋巴细胞和大量浆细胞浸润。本组病例光镜下观察均可见大量的浆细胞、淋巴细胞等炎性细胞浸润、包绕梭形细胞,3种组织学亚型均可见。其中3例IMT梭形细胞可见异型核分裂像,与临床及影像学表现的恶性倾向相符合。
3.3.3 免疫组织化学
肌纤维母细胞是介于平滑肌细胞和纤维母细胞之间的一种独立的细胞类型,电镜检查可证实其兼具这两型细胞的一些超微结构特点。免疫组织化学的意义在于证实肌纤维母细胞的免疫表型,排除其他诊断。梭形细胞表达间叶细胞标记Vim和肌源性标记SMA、MSA。Vim通常强阳性,胞质弥漫着色,偶尔为灶性。SMA、MSA反应为局灶性或弥漫性。此外部分阳性的有:Desmin、Actin、calponin(肌源性标记)、Cytokeratin、EMA(上皮标记)、CD68、CD30、α1-抗胰蛋白酶、α1-抗糜蛋白酶、溶菌酶(组织细胞标记)。表达阴性的有S-100、Myoglobin、CD34、CD117、CD21、CD23、h-Caldesmon。近年发现IMT中ALK-1表达率高,免疫组化阳性率可达89%,提示可作为一项诊断指标[6]。免疫组化使用抗ALK抗体有益于鉴别IMT、结节性筋膜炎、硬纤维瘤和胃肠道间质瘤。Hussong等[7]研究发现IMT病例均表达bax,但无c2myc表达,bcl22表达仅为37%。本组12例标本行免疫组化染色检查,其中9例Vim染色均呈阳性表达,9例SMA染色阳性表达,3例S-100蛋白染色阳性表达,另外CD117及CD34染色呈阴性表达,排除间质瘤和平滑肌瘤,3例患者P53及Ki67阳性表达提示恶性倾向。
3.4 IMT的影像学表现
炎性肌纤维母细胞瘤影像学表现多为病例报道,不同部位有不同的表现,缺乏特异性征象。本组病例与文献报道相符[8]。
IMT内不同程度的纤维组织增生,炎性细胞浸润、凝固性坏死已经炎性过程中的动态变化是其影像表现多样性的病理基础。发生于肺内的IMT为单发病灶,多位于肺外周胸膜下,本组发生肺部的病例位于邻近胸膜肺组织内,病变边界较清楚,可伴肺不张,密度均匀,病程较长,抗炎治疗复查CT,肿块有缩小趋势。肺外IMT多表现为单发分叶状或多结节状软组织肿物,绝大多数肿块境界清楚,增强扫描呈均匀或不均匀中度至显著强化,无明显特异性表现。少量文献论述,类似本组病例,CT扫描呈软组织密度肿块,增强扫描呈均匀或不均匀轻、中度甚至显著强化。位于消化器官的肿块(胃、肠、阑尾)常常与周围脏器或组织有粘连,这与病变伴有炎性浸润性的病理表现相一致,位于系膜和网膜的单个肿块边界清楚,本组发生在胃肠道的3组病例,食道、胃表现为境界清楚的软组织肿块,增强有中等程度强化,与发生在胃肠道的间质瘤鉴别困难。1例发生在十二指肠,MR表现为肠壁环形增厚,为等长T1、等稍长T2及脂肪抑制序列(STIR序列)高信号肿块灶,增强扫描呈现中等程度不均匀强化。
发生在鼻窦、鼻咽及腹膜后的IMT具侵袭性。发生在鼻窦的IMT呈现不规则软组织肿块,窦壁骨质破坏,表现为侵袭性,增强扫描呈现中等程度强化,与鼻窦内其他恶性肿瘤难以鉴别。发生鼻咽部的软组织肿块与鼻咽癌类似。发生在腹膜后的巨大IMT病理提示为恶性,复习CT图像可见发现该病例为范围广泛的软组织肿块,边界不清,肺部可见多发结节样转移灶,与腹膜后的其他间叶组织恶性肿瘤难以鉴别,恶性程度较高。
3.5 IMT的鉴别诊断
IMT的影像学表现无特异性,影像学鉴别比较困难。确诊主要依靠手术病理及免疫组化证实。
发生在肺部的IMT主要鉴别肺癌、错构瘤、结核灶、纤维瘤等。对于儿童及青少年单发肺内肿物而无其他病史者,应该考虑到该病的可能性;成人肺IMT多表现为不规则肿物,结合粗长毛刺、平直征、尖角样改变、强化均匀可以初步鉴别[8]。
发生在腹腔的IMT称为AIMT,具有与腹腔内其他肿瘤的影像学、临床表现甚至病理学形态相似的特征,故常常造成诊断上的困难,易误诊为腹腔脏器的癌肿、纤维瘤病、胃肠道间质肿瘤等病变。几种间叶组织来源肿瘤:间质瘤的肿瘤细胞呈梭形或上皮样或2种细胞兼有;CD117和CD34特征性地强阳性表达,其他间叶组织来源肿瘤部分虽然与IMT含有大量的分化的肌纤维母细胞性梭形细胞,但不含浆细胞等炎性细胞,可见借此区别。纤维组织肿瘤主要发生在四肢软组织内或腹膜后,影像上可见钙化灶,较具有特征性,免疫组化显示Actin、CK和ALK均为阴性,免疫标志可以鉴别两者。
3.6 IMT的治疗与预后
IMT的治疗目前存在争议。完整的外科切除是IMT的主要治疗手段,放化疗效果不明确,但对于侵袭性较强的IMT还是推荐辅助放化疗。多数IMT临床过程表现良性,病程迁延,虽然有研究证明IMT预后与病变部位、ALK蛋白表达等有一定关系,但尚不能确切预测复发和转移[9],因此所有IMT患者手术后应长期密切随访。
总之,IMT是一种临床少见肿瘤,影像学检查能为本病的诊断提供有价值的信息,诸如肿物解剖部位、累及范围、内部结构及初步判断恶性程度等。对于多数IMT影像学表现缺乏特征性,确诊仍需组织病理学及免疫组化检查。外科手术是主要的治疗方法,术后需长期随诊。
[1]Fletcher CD,Unni KK,Mertens F.World health organization classification of tumours.Pathology and genetics of tumours of soft tissue and bone[M].Lyon:IARC Press,2002:47-107.
[2]纪小龙,马亚敏.炎性假瘤的病理学进展 [J].诊断病理学杂志,2003,10(4):239-241.
[3]Gómez-Román JJ,Ocejo-Vinyals G,Sánchez-Velasco P,et al. Presence of human herpesvirus-8 DNA sequences and overexpression of human IL-6 and cyclin D1 in inflammatory myofibroblastic tumor(inflammatory pseudotumor)[J].Lab Invest,2000, 80(7):1121-1126.
[4]Freeman A,Geddes N,Munson P,et al.Anaplastic lymphoma kinase(ALK 1)staining and molecular analysis in Inflammatory myofibroblastic tumours of the bladder:apreliminaryclinicopathological study of nine cases and review of the literature[J]. Mod Pathol,2004,17(7):765-771.
[5]范淼,李子平,冯仕庭,等.炎症性肌纤维母细胞瘤的CT表现与病理对照[J].中华放射学杂志,2004,38(5):509-513.
[6]Cook JR,Dehner LP,Collins MH,et al.Anaplastic lymphomakinase(ALK)expression in the inflammatory myofibroblastic tumor:a comparative immunohistochemical study[J].Am J Surg Pathol, 2001,25(11):1364-1371.
[7]Hussong JW,Brown M,Perkins SL,et al.Comparison of DNA ploidy,histologic,and immunohistochemical findings with clinical outcome in inflammatory myofibroblastic tumors[J].Mod Pathol, 1999,12(3):279-286.
[8]李蒙,吴宁,林冬梅,等.炎性肌纤维母细胞瘤的多层螺旋CT表现[J].中国医学影像技术,2008,24(12):1995-1998.
[9]Park SH,Kim JH,Min BW,et al.Exophytic inflammatory myofibroblastic tumor of the stomach in an adult woman:a rare cause of hemoperitoneum[J].World J Gastroenterol.2008,14(1):136-139.

