鸭肠炎病毒感染鸭外周血淋巴细胞变化研究
马 波,李洪涛,刘峰源,张 扬,刘晓玫,乌伊罕,王君伟*
(1.东北农业大学动物医学学院,哈尔滨 150030;2.东北农业大学资源与环境学院,哈尔滨 150030)
养鸭业已成为我国仅次于家鸡驯养的第二大群体[1],有效防治各种疫病[2],对于我国养鸭业的健康发展尤为重要。鸭病毒肠炎(Duck viral enteritis,DVE)又名鸭瘟(Duck plague,DP),是由鸭肠炎病毒(Duck enteritis virus,DEV)引起的鸭、鹅及多种雁形目禽类的一种急性、热性、败血性传染病。该病在全世界范围内流行,1923年在荷兰首次报道,我国于1957年首次爆发,全国多省份均有流行,给养鸭业造成巨大经济损失[3]。
由于水禽免疫系统与较为低等的爬行类动物更为接近,不同于哺乳动物及鸡的免疫系统,导致目前尚未阐明DEV的感染机制及免疫机理。近年来国内学者对DEV病原及体液免疫方面的研究逐渐增多[4-6],但关于外周血淋巴细胞在DEV感染中作用的研究相对较少。
本研究通过建立的MTS法检测DEV对鸭外周血淋巴细胞转化功能的影响,初步揭示了鸭外周血淋巴细胞在DEV感染期间的一个动态变化过程,对于进一步认识细胞免疫在抗DEV感染过程中的作用提供了一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 疫苗
鸭肠炎病毒弱毒疫苗(购自哈药集团黑龙江省生物制品一厂,批号为200703);鸭肠炎病毒AV1221标准强毒株和C-KCE疫苗毒株(均购自中国兽医药品监察所,由东北农业大学预防兽医系保存)。
1.1.2 试验动物分组及免疫
4周龄雄性非免疫金定鸭(购自哈尔滨市某养殖场),饲养至12周龄随机分成两组,一组3只为非免疫组(NI组),另一组6只为免疫组(IM组),两组隔离饲养。免疫程序如下:DEV弱毒疫苗胸肌免疫,1.5个月后用 2×105TCID50DEV AV1221标准强毒株鸭胚尿囊液攻毒,于正式试验前7 d进行弱毒疫苗加强免疫。
1.1.3 主要试剂
胰蛋白酶(购自Difco公司);RPMI 1640(购自Gibco公司);新生小牛血清(购自上海伟群生物技术有限公司);PHA、CellTiter 96@AQueousNon-Radioactive Cell Proliferation Assay(G5421)(购自 Promega公司);淋巴细胞分层液(购自中国科学院血液研究所)。
1.1.4 主要仪器
水平离心机(LD5-2A,北京医用离心机厂);超纯水系统(Milli-Q Academic,密理博);倒置生物显微镜(OLYMPUS TOKYO 210942,奥林帕斯);自动酶标检测仪(Model680,伯乐);超净工作台(DL-CJ-2N,哈市东联电子有限公司);CO2恒温细胞培养箱(REVCO RCO 3000.TVBB)。
1.2 方法
1.2.1 鸭外周血淋巴细胞转化条件的确定
用40 g·L-1的柠檬酸钠作为抗凝剂,足静脉采集非免疫鸭外周血5 mL,将抗凝血轻轻叠加在盛有等体积的淋巴细胞分离液(密度1.077±0.002 g·mL-1)的试管中,1 000 r·min-1室温水平离心 11 min,小心吸取界面细胞,用适量预热的含100 mL·L-1FBS的RPMI 1640培养液洗细胞2次,每次1 000 r·min-1室温下离心 11 min。细胞沉淀重悬于2 mL 1640完全营养液培养液,6 g·L-1台盼蓝拒染,活淋巴细胞计数,调整细胞浓度为1×106和2×106个·mL-1两个浓度。将细胞加于 96 孔培养板中,每孔加200 μL细胞悬液,同时加入200 μg·mL-1的 PHA 5、10、20 μL,PHA 终浓度分别为5、10、20 μg·mL-1,每个浓度做 2 个重复,同时设置阴性对照和空白对照,37℃ 50 mL·L-1CO2分别培养48、72、96 h。培养结束后每孔吸弃100 μL培养液,不要干扰细胞,加入10 g·L-1MTS/PWS 20 μL 至终浓度为 333 μg·mL-1MTS、25 mmol·L-1PWSL,37 ℃ 50 mL·L-1CO2继续培养 4 h,取出培养板后立即在OD490nm处利用酶标仪读取各孔吸光值,计算刺激指数(Stimulation index,SI),确定最佳反应时间、细胞浓度和刺激物浓度。刺激指数(SI)=(试验孔平均Dλ-空白孔平均Dλ)/(对照孔平均Dλ-空白孔平均Dλ)。
1.2.2 DEV感染鸭外周血淋巴细胞转化条件的确定
根据上面试验确定的细胞浓度摸索抗原特异性T淋巴细胞增殖试验的条件。取3只免疫鸭,淋巴细胞分离及其他试验方法同前。特异性刺激原 DEV 分别进行 10-1~10-4稀释,每孔加2 μL,最终稀释度为 10-3~10-6,培养 48、72、96 h后处理方法同前,确定最佳反应时间和DEV刺激浓度。
1.2.3 DEV感染鸭外周血淋巴细胞的变化
根据上面确定的最佳反应条件,对免疫组和非免疫组鸭外周血淋巴细胞进行抗原特异性T淋巴细胞增殖试验,分别在末次免疫后第1、2、4和6周进行检测。具体操作方法同前,设置PHA、阴性及空白对照,每个样品做3个重复。利用SPSS 12.0分析软件进行统计学分析。
2 结果与分析
2.1 鸭外周血淋巴细胞转化条件的确定
以PHA为刺激物,细胞浓度为2×106和1×106个·mL-1,刺激时间为24、48和72 h,计算相应刺激指数(SI),结果见表1。从表1可以看出SI最高为2.3269,此时的条件为:细胞浓度1×106个·mL-1,PHA 终浓度 5 μg·mL-1、刺激时间 72 h,因此将上述条件作为鸭外周血淋巴细胞转化的最佳反应条件。
2.2 DEV感染鸭外周血淋巴细胞转化条件的确定
按照已确定的细胞浓度摸索DEV最佳反应浓度和反应时间,结果见表2。
从表2可以看出,DEV在终稀释度为10-3,培养72 h时达到最高SI,因此确定上述试验条件为DEV最佳反应浓度和反应时间。
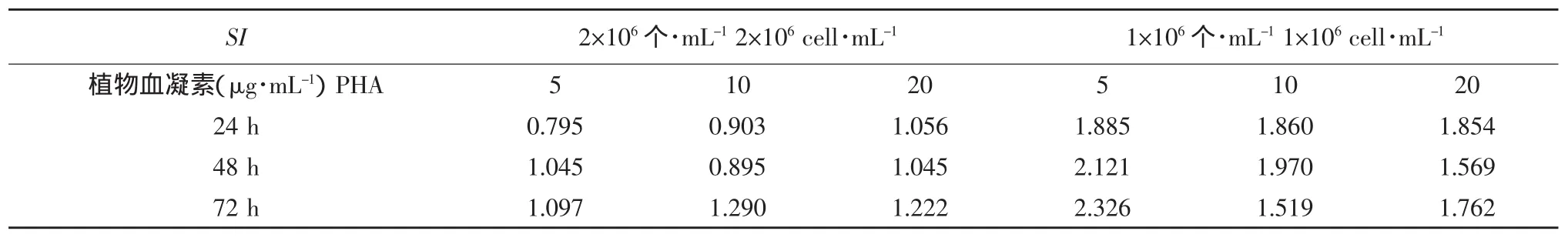
表1 以PHA为刺激物不同反应条件的SI值Table 1 SI in different reaction condition stimulated with PHA

表2 特异性抗原不同反应条件的SI值Table 2 SI in different reaction condition stimulated with DEV
2.3 DEV感染鸭外周血淋巴细胞的变化
DEV和PHA刺激IM组不同个体SI随时间变化结果见表3,从表3可以看出不同个体SI随时间变化的总体趋势是从第1周开始逐渐升高,第4周后达到高峰,第6周回落至接近第2周的水平。其中8039、8048和8049较为典型,但总体看由于个体之间存在差异,导致SI开始上升的起点和达到高峰的时间不完全相同,如8038和8050对DEV的转化分别是从第2周和第4周开始升高的,在第4周和第6周达到高峰。同时发现初始值较高的个体所达到的最高值较低,如8038初始值为1.225最高值为1.282,而初始值较低的个体所达到的最高值反而较高,如8039初始值为0.834,最高值为1.967。同一个体对DEV和PHA的反应表现出一致的趋势。
DEV和PHA刺激NI组不同个体SI随时间变化的结果见表4,从表4可以看出NI组不同个体SI随时间并未出现较大幅度的变化,且不同个体间差异较小。除第2周SI均略高于其他3周外,第1、4和6周差异较小。第2周SI普遍较高可能是由于试验误差造成。同一个体对DEV和PHA的反应表现出一致的趋势。

表3DEV、PHA刺激IM组不同个体SI随时间变化结果Table 3 Variation of SI in IM group stimulated with DEV and PHA
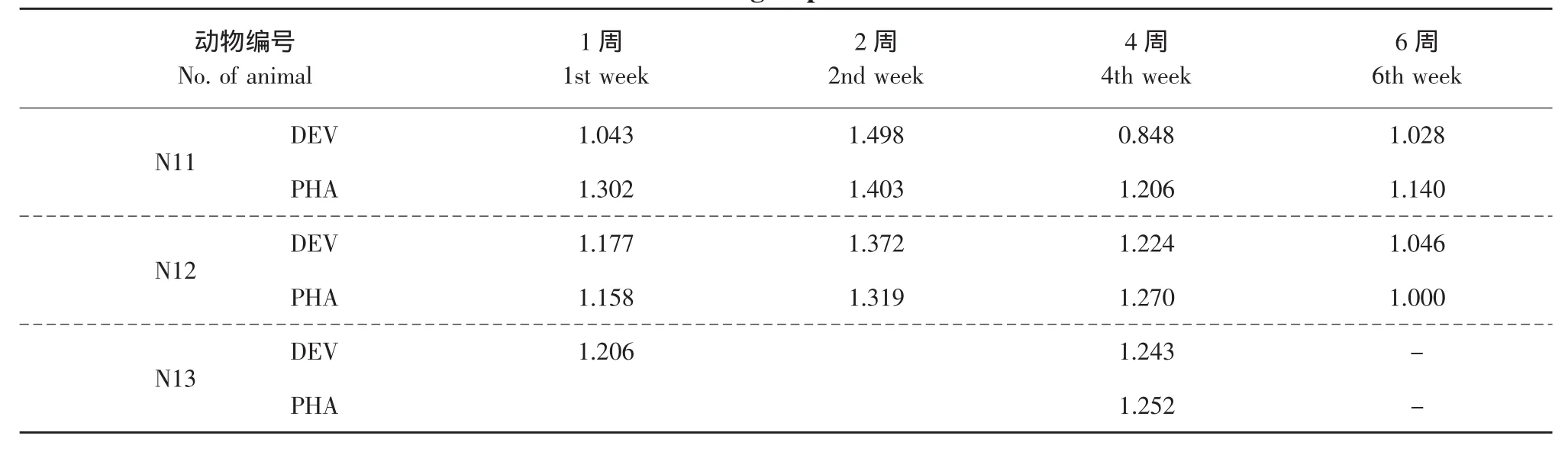
表4 DEV、PHA刺激NI组不同个体SI随时间变化结果Table 4 Variation of SI in NI group stimulated with DEV and PHA
分别将DEV和PHA刺激IM组和NI组的SI平均值进行比较,结果见表5,图1、2。
由表5,图1、2结果可知,IM组和NI组对DEV和PHA的刺激均表现为第1、2周IM低于NI组,第4、6周IM高于NI组,且IM组PHA变化幅度最大,由此同样揭示出IM组不同时间SI变化明显,出现逐渐升高而后降低的趋势,而NI组不同时间SI基本持平。

表5DEV、PHA刺激IM组和NI组SI平均值随时间变化结果Table 5 Comparison of SI means between immune group and non immune group stimulated with DEV and PHA

图1 DEV刺激免疫组和非免疫组的SI平均值比较Fig.1 Comparison of SI means between IM group and NI group stimulated with DEV
3 讨论与结论

图2 PHA刺激免疫组和非免疫组的SI平均值比较Fig.2 Comparison of SI means between IM group and NI group stimulated with PHA
淋巴细胞转化试验是检测抗原特异性T淋巴细胞数量的常用方法,检测DEV抗原特异性外周血淋巴细胞转化的MTS法尚未见报道,本研究建立了该方法并用于检测DEV免疫鸭外周血淋巴细胞变化趋势。
淋巴细胞转化试验中免疫组总体呈现的变化趋势为逐渐升高,达到顶峰而后回落,即第1周与第2周相比略高、持平或略低,但差距不大,第4周均有不同程度的升高,第6周回落至初始水平或比初始水平略高。由此,推断该体外变化规律也体现了整个机体对DEV进行细胞免疫应答时回忆应答的规律,表现为细胞免疫水平从末次免疫后可持续上升近4周达到高峰,4~6周开始逐渐回落。细胞免疫水平上升较为缓慢而下降却相对较快,这可能与鸭免疫系统本身的特点有关,在鸭肝炎病毒(DHBV)表面抗原和核心抗原引起鸭细胞免疫应答动力学的研究中存在一致现象[7]。
从本试验中还可以看出,不同试验鸭对DEV反应的能力表现不一致,表现为反应强的个体达到高峰的时间早且强度高,而反应弱的个体达到高峰的时间晚且强度小,前者如8039、8048、8049,后者如8038和8050。分析引起上述现象的原因主要有:①不同试验鸭个体间的确存在差异,这与鸭肝炎病毒免疫相关研究的报道一致[7-8];② DEV可感染外周血淋巴细胞(PBL),并在此繁殖或潜伏,从而引起外周血淋巴细胞损伤,造成不同个体针对DEV的细胞免疫应答水平的起始点不同,这与其他学者研究结果一致。
岳华等先后利用不同检测方法证明DEV无论强毒株还是弱毒株均可感染胸腺、法氏囊、脾脏、外周血等中枢或外周免疫器官,且病毒在三叉神经节及外周血淋巴细胞中可稳定存在并形成潜伏感染[4,9-11]。同时阳性对照PHA的淋巴细胞转化结果也证明了该点,即IM组的PHA反应能力在前两周明显低于NI组,到第4周才高于NI组,这与李玲的研究结果一致[12]。
本研究证实MTS法可有效检测鸭抗原特异性外周血淋巴细胞增殖情况,且鸭外周血淋巴细胞可潜伏感染DEV。
[1] 葛庆联,章双杰,吴华俊,等.中国地方蛋鸭品种动态保种状态的研究[J].东北农业大学学报,2008,39(1):79-83.
[2] 肖妙,于志丹,马波,等.减蛋综合征病毒五邻体重组蛋白的原核表达及抗原性鉴定[J].东北农业大学学报,2009,40(2):83-87.
[3] 黄引贤,欧守杼,邝荣禄,等.鸭瘟病毒的研究[J].华南农学院学报,1980,1(1):21-36.
[4] 岳华,杨发龙,景波,等.鸭瘟病毒在雏鸭体内的动态定量分布及其潜伏部位研究[J].中国预防兽医学报,2007,29(9):671-675.
[5] 齐雪峰,程安春,汪铭书,等.鸭瘟病毒抗体间接ELISA检测试剂盒的研制[J].中国兽医科学,2007,37(08):690-694.
[6] 袁明龙,杨永纪,诸奎龙,等.鸭瘟抗体检测方法研究[J].中国预防兽医学报,2001,23(2):140-143.
[7] Vickery K,Cossart Y,Gu X,et al.Antigen-specific blastogenesis assays for duck hepatitis B virus using duck peripheral blood and splenic mononuclear cells[J].Veterinary Immunology and Immunopathology,1997,59:349-358.
[8] Vickery K,Cossart Y,Dixon R.Comparison of the kinetics of the specific cellular immune response to duck hepatitis B virus in infected and immune ducks[J].Veterinary Microbiology,1999,68:157-169.
[9] Proctor S J.Pathogenesis of duck plague in the bursa of fabricius,thymus and spleen[J].American Journal of Veterinary Research,1976,37:427-431.
[10]Shawky S.Target cells for duck enteritis virus in lymphoid organs[J].Avian Pathology,2000,29(6):609-616.
[11]程安春,汪铭书,刘菲,等.PCR在鸭瘟临床诊断和免疫及致病机理研究中的初步应用[J].病毒学报,2004,20(4):364-369.
[12]李玲,朱堃 熹,林在尧.淋巴细胞转化试验在鸭体上的应用II鸭瘟病毒对鸭外周血淋巴细胞转化能力的影响[J].江苏农学院学报,1988,9(2):5-8.

