共表达鸡IBDV VP2和IL-2基因的重组毕赤酵母的构建及免疫原性
丁 轲,余祖华,张春杰,程相朝,刘一尘,王 臣
(河南科技大学动物科技学院,河南洛阳 471003)
0 前言
鸡传染性法氏囊病(IBD)是由传染性法氏囊病毒(IBDV)引起的急性、高度接触性传染病,不仅可致青、幼年鸡较高的死亡率,而且导致严重的免疫抑制和免疫接种失败,给养禽业造成巨大的经济损失[1-2]。IBDV属于双RNA病毒科的禽双RNA病毒属,基因组中VP2和VP3是病毒的主要结构蛋白,共同构成病毒衣壳,是主要的宿主保护性抗原,而 VP2基因较为保守,且其蛋白具有血清型特异性位点,并能诱导产生抗病毒的血清中和抗体[3-4],是重要的免疫原基因。白细胞介素2(IL-2)是T淋巴细胞分泌的一种淋巴因子,可促进T细胞、B细胞的增殖和分化并可增强单核细胞以及NK细胞的杀伤活性,在免疫反应过程中起着重要的调节作用[5-6]。IBD VP2基因不含信号肽序列,因而不能从转染细胞中自主分泌,故不能有效活化B细胞和Th细胞。白细胞介素-2(lL-2)信号肽是有20多个氨基酸组成的高度疏水性序列,基于信号肽可介导蛋白质分泌及可在不同蛋白质互通使用的特点[7],本文用重叠延伸PCR技术(SOE-PCR)将lL-2基因与具有地方特色的IBDV野毒株的VP2基因进行融合拼接,并将所获得的融合基因克隆至真核表达载体pc ICZαA中,并转化入巴斯德毕赤酵母(Pichia Pastoris X-33),以期利用真核表达具有天然活性的IL-2蛋白来辅助增强IBDV VP2蛋白的免疫原性。为进一步提高IBDV基因疫苗的免疫效果,开发新型IBDV疫苗奠定基础。
1 材料与方法
1.1 材料
(1)载体及菌株。pMD18-T-VP2、pMD18-T-IL2、pBluescprit SK+(pBSSK+)、大肠杆菌宿主菌JM109由河南科技大学动物科技学院禽病研究中心构建及保存;Pichia Pastoris X-33及其表达载体pPICZαA由南京农业大学陈傅言教授惠赠。
(2)主要试剂。限制性内切酶、T4DNA连接酶购自宝生物工程(大连)有限公司;dNTP、Taq Plus DNA聚合酶、DNA纯化试剂盒购自上海生物工程有限公司;Zeocin抗生素购自Invitrogen公司;葡萄糖、山梨醇、生物素、YNB等购自OXOID公司;四甲基乙烯二胺(TMED)购自Promega公司;辣根过氧化物酶标记羊抗兔 IgG购自北京博奥森生物技术有限公司。引物合成和测序由大连宝生物有限公司完成。
1.2 方法
(1)融合基因PCR引物设计。为了扩增IL2-VP2融合基因,共设计了2对引物:引物P1含有IL-2信号肽起始密码子ATG,优化序列上游引入了KpnI酶切位点;引物P2去除了IL-2的终止密码子TAA,加上了中间接头(Linker)。中间接头(Linker)为高亲水性氨基酸(Gly-Gly-Gly-Ser)编码基因GGC GGA GGG TCT;引物P3去除了VP2基因的ATG起始密码子,由中间接头和一段VP2基因序列所构成;引物P4为扩增VP2全基因的下游引物,5,端加入了NotI酶切位点(见表1)。

表1 PCR引物序列
(2)重组表达质粒pPICZαAIL2-VP2的构建。分别以pMD18-T-IL2、pMD18-T-VP2为模板扩增得到IL2-Linker片段和Linker-VP2片段,再以lL2-Linker和Linker-VP2两个PCR纯化产物的混合物为二次 PCR扩增模板, P1、P4分别为上、下游引物,PCR扩增获得 lL2-VP2融合基因片段,将lL2-VP2融合基因片段回收纯化后再与pMD18-T载体进行连接,获得阳性克隆质粒pMD18T-lL2-VP2,序列测定后将pMD18T-lL2-VP2和pPICZαA分别用KpnI和NotI双酶切,电泳后回收、连接、转化,获得阳性重组表达质粒pPICZαA-IL2-VP2。
(3)重组表达载体的线性化处理、电击转化及筛选。将构建的重组表达pPICZαA-IL2-VP2质粒用Sac I酶切线性化(同时做空质粒对照)后用Bio-rad电击仪进行电击转化,参数为电压1 500 V,电容25 μF,电阻200Ω,电击时间为5 ms,电击完毕后,立即加入 1 mL冰预冷的山梨醇溶液将菌体混匀,转至1.5m L的EP管中,将菌体悬液涂布于YPDZ平板上后置于30℃培养34 d,将获得的转化子进行PCR鉴定后进行高抗性阳性转化子的筛选,获得阳性单克隆X-33/pPICZαA-IL2-VP2。
(4)重组毕赤酵母的诱导表达检测和Western blot分析。挑取阳性单克隆X-33/pPICZαA-IL2-VP2,接种至BMGY中,30℃摇至对数期,收集菌体,用等体积BMMY重悬细胞,进行诱导表达,每24 h加甲醇至终浓度为1%继续诱导。分别在0 h(0 d)、24 h(1 d)、48 h(2 d)、72 h(3 d)、96 h(4 d)的各个时间点收集上清进行SDS-PAGE分析表达水平及确定诱导最佳时间。表达上清液用硫酸铵沉淀浓缩,以PBS透析24 h,然后进行Western blot分析,用IBDV阳性血清作为一抗,辣根过氧化物酶标记羊抗鸡IgG为二抗,DAB显色,至目的条带清晰时终止反应。
2 结果与分析
2.1 lL2-Linker的初次PCR结果
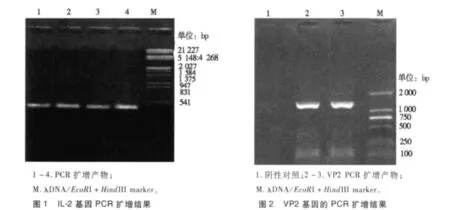
以含有IL-2 cDNA的pMD18T-lL2质粒为模板,利用引物P1和P2进行PCR扩增出缺失了终止密码子和在3,端引入了重叠引物的lL-2基因片段,1.0%琼脂糖凝胶电泳显示在大小约450 bp位置处可见清晰的特异性扩增条带,与预期大小相符(见图1)。
2.2 IBDV的Linker-VP2初次PCR结果
以pMD18T-VP2质粒为模板,用重叠引物P3和P4进行PCR扩增后,在VP2的5,端引入了重叠延伸引物全序列。扩增出获得了缺失VP2基因起始密码子的1 400 bp左右的片段,与预期大小相符(如图2所示)。
2.3 IL2-VP2融合基因的PCR结果
以两个初次PCR产物的混合物为模板,通过重叠延伸PCR将IL-2基因和VP2基因进行前后拼接,扩增后获得大小约为1.85 kb的片段,与预期大小一致,初步确定为IL2-VP2融合基因片段(如图3所示)。
2.4 融合基因的T载体克隆和鉴定
将经过初步鉴定为阳性的重组质粒pMD-lL2-VP2进行序列测定,结果显示pMD-lL2-VP2的插入片段无移码突变和碱基错配,pMD-IL2-VP2中包含了lL-2 cDNA的起始密码子ATG、VP2基因的终止密码子TAA和人工接头Linker在内的插入片段完全正确。
2.5 pPICZαA-IL2-VP2真核表达载体的构建结果
将构建成的pPICZαA-IL2-VP2进一步用KpnI、NotI双酶切pPICZαA-IL2-VP2重组质粒,可以获得3.6 kb和1.2 Kb左右 2个片段(如图4所示),与预期大小相符;以pPICZαA-IL2-VP2为模板,P1和P4分别为上、下游引物,经PCR扩增可以得到1.2 kb左右的特异性条带,表明lL2-VP2基因已经成功地连接到pPICZαA真核表达载体中。
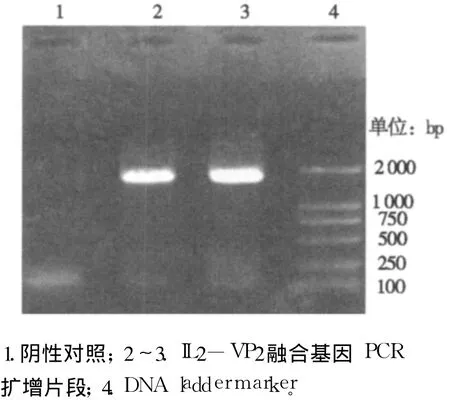
图3 IL2-VP 2融合基因PCR扩增结果
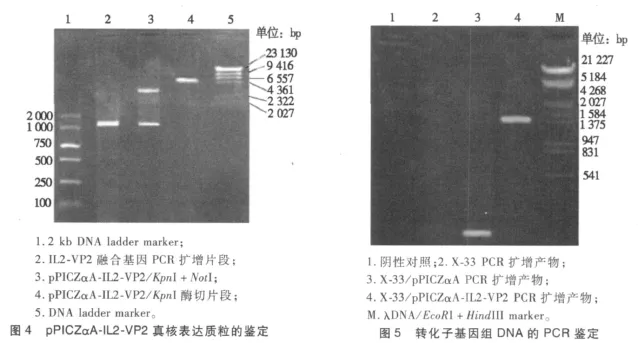
2.6 重组质粒pPICZαA-IL2-VP2酵母菌X-33的转化及阳性转化子的筛选
重组质粒pPICZαA-IL2-VP2及pPICZαA空载体的线性化产物转至毕赤酵母X-33中,挑取在高抗性YPDZ(Zeocin 2 000μg/m L)的单个菌落抽提DNA基因组,以α-factor primer和3′-AOX1 primer为引物进行PCR检测,筛选到含有目的基因片段的重组子(见图5)。若IL2-VP2与酵母成功重组则应扩增出约1.41 kb(1.206 kb+195 bp)的片段,若未重组则只能扩增出195 bp的小片段,从图5可见重组成功。
2.7 重组X-33/pPICZαA-IL2-VP2的诱导表达、SDS-PAGE及Western blot分析
X-33/pPICZαA-IL2-VP2阳性克隆及X-33/pPICZαA对照菌,用1%甲醇诱导 4 d后,取上清进行SDS-PAGE及考马斯亮蓝染色,结果如图6a所示,可见与空载体对照菌比较,重组菌诱导表达上清液在分子量约为50 kD处有明显的条带出现。表达的上清用硫酸铵沉淀,PBS透析后,进行Western blot分析。确证X-33/pPICZαA-IL2-VP2分泌表达了具有良好免疫原性的IL2-VP2蛋白,如图6b所示。

图6 重组酵母发酵液上清中表达产物SDS-PAGE和Western b lot分析
3 讨论
在特异性抗原产生免疫反应过程中,应用细胞因子作为免疫佐剂能提高各种免疫反应的强度和速度[8]。IL-2是目前研究最多的细胞因子佐剂之一,随抗原一起或先后给予注射,可以发挥其增强抗感染免疫或保护性免疫的作用[9]。为了增强IBDV VP2的免疫原性,发挥IL-2的佐剂效应,将IL-2和VP2抗原连接起来,采用酶切、PCR法和测序法证实了插入片段无移码突变和碱基错配,成功地构建了所设计的基因工程疫苗质粒pPICZαA-IL2-VP2,检测证实了目的基因能表达有生物活性的蛋白,为今后探索基因疫苗的设计以及IBD基因疫苗的研究奠定了基础。IL2-VP2是一种融合蛋白,兼有IL-2的功能活性和二价亲和的作用,同时可以延长 IL-2的半衰期。这种融合蛋白注射到机体后随体液循环进入其亲嗜部位,当融合蛋白中的 VP2蛋白到达机体的免疫组织或器官时,将会刺激产生相应的抗体,这种抗体再随体液循环分布到机体的各个部位,从而阻止IBDV的侵入或与已侵入的病毒发生特异性结合。而IL-2蛋白可促进B细胞表达IL-2R,促使 B细胞增殖和产生免疫球蛋白,并刺激巨噬细胞,提高其吞噬能力,同时也能增强T细胞的杀伤活性,所以IL-2基因和VP2基因融合表达可以保证其直接作用于抗原呈递部位,从而获得免疫协同作用。许多研究报道包含 IL-2和病原基因的融合蛋白,能够增强连接抗原的免疫原性,并对随后的攻击提供保护[10-12]。
本研究构建的IL2-VP2融合蛋白基因包含了去除IL-2终止密码子TAA和VP2起始密码子ATG的1 206个核苷酸,编码融合蛋白的402个氨基酸残基。DNA测序结果显示,ORF读码框架完全正确,中间的亲水性氨基酸编码序列正确无误,从而可以保证表达产物的转录和翻译。编码的融合蛋白是以 IL-2的前导序列为分泌信号肽和转录起始位点,在lL-2的C-末端与 VP2的 N-末端之间以高亲水性氨基酸相连接。免疫印迹结果表明,VP2得到很好的表达。因 VP2基因位于lL-2基因的下游,VP2基因相当于报告基因,它的表达说明IL-2蛋白也得到了成功表达。
[1] Karel A,Schat,Michael A,et al.Avian Immunosuppressive Diseases and Immune Evasion[J].Avian Immunology,2008,23 (5):299-322.
[2]Maller H,Islam M R,Raue R.Research Oninfectious Bursal Disease-the Past,the Present and the Future[J].Vet Microbiol,2003,97(1-2):153-165.
[4] Hu H L,Wang M Y,Chung C H,et al.Purification of VP3 Protein of In fectious Bursal Disease Virus Using Nickel Ionimmobilized Regenerated Cellulose-based Membranes[J].JChromatography B,2006,840(2):76-84.
[5] Ruchi P,Ramesh C,Krishna B S.Role of Interleukin-2 Regulated Proteins in Immunosupp ression by the N-alkylated Prodigiosin Analogue[J].International Immunopharmacology,2007,7(13):1695-1703.
[6] Tang M J,Wang H N,Zhou S,etal.Enhancement of the Immunogenicity of an In fectious Bronchitis Virus DNA Vaccineby a Bicistronic Plasmid Encoding Nucleocapsid Protein and Interleukin-2[J].JVirological Methods,2008,149(1):42-48.
[7] Zhou JY,Chen JG,Wang JY,et al.cDNA Cloning and Functional Analysis ofGoose Interleukin-2[J].Cytokine,2005,30 (6):328-338.
[8] Matthias K,Konstantinos S,Michael S,et al.Immunosuppression with an Interleukin-2 Fusion Protein Leads to Improved LV Function in Experimental is Chemic Cardiomyopathy[J].International Immunopharmacology,2010,10(2):207-212.
[9] Chow Y H,Huange W L,CliW K,el a1.Improvement of Hepatitis B Virus DNA Vaccines by Plasmids Coexpressing Hepatitis Surface Antigen and Interleukin-2[J].JVirol,1997,71(1):169-174.
[10] Yang Y,Chen J L,Li H,et al.Porcine Interleukin-2 Gene Encapsu lated in Chitosan Nanoparticles Enhances Immune Response of Mice to Piglet Paratyphoid Vaccine[J].Comparative Immunology,Microbiology and In fectious Diseases, 2007,30(1):19-32.
[11] Xie Z,Li H,Chen J L,et al.Shuffling of Pig Interleukin-2 Gene and Its Enhancing of Immunity in Mice to Pasteurella Ultocida Vaccine[J].Vaccine,2007,25(48):8163-8171.
[12] John H,Wyckoff III,Jeri L Howland,etal.Recombinant Bovine Interleukin 2 Enhances Immunity and Protection Induced by Brucella Abortus Vaccines in Cattle[J].Veterinary Microbiology,2005,111(1/2):77-87.

