耐碱性短小芽孢杆菌木聚糖酶在枯草杆菌中的表达及发酵条件优化
周煌凯 龚月生 杨明明 张云雁 宋秀平
耐碱性短小芽孢杆菌木聚糖酶在枯草杆菌中的表达及发酵条件优化
周煌凯 龚月生 杨明明 张云雁 宋秀平
研究耐碱性短小芽孢杆菌木聚糖酶在枯草芽孢杆菌中异源表达。从耐碱性木聚糖酶高产短小芽孢杆菌BYG5-20中克隆得到带有自身启动子的木聚糖酶基因xynA,将其构建在大肠杆菌-枯草芽孢杆菌穿梭载体pGJ148中得到重组质粒pGJ148-xynA。采用电转化法将重组质粒pGJ148-xynA转入枯草芽孢杆菌1A747中,得到重组菌B.GJ148-xynA,然后进行诱导表达以及培养基的优化。重组菌GJ148-xynA发酵上清液中木聚糖酶酶活可达93.32 IU/ml。耐碱性短小芽孢杆菌木聚糖酶基因xynA可以在枯草芽孢杆菌中实现异源表达,为枯草芽孢杆菌木聚糖酶分泌表达系统的进一步优化奠定了基础。
木聚糖酶;枯草芽孢杆菌;分泌表达系统;发酵条件
植物中含有20%~30%的半纤维素,木聚糖作为主要的半纤维素,是自然界中仅次于纤维素的含量极其丰富的多糖资源。木聚糖由呋喃木聚糖残基通过β-1,4糖苷键聚合成线性的多骨架。木聚糖在自然条件下很难被降解利用,尽管一些化学方法可以提高木聚糖的降解,但同时给其他的操作造成很大的不便。微生物产生的木聚糖酶能将木聚糖水解成寡聚木糖和木糖。木聚糖酶在工业应用方面具有巨大的潜力,可以广泛应用在饲料工业、能源工业、造纸业、食品业和印染业等中。因此,木糖糖酶的研究和应用已经成为国内外研究的热点。
自20世纪80年代初开展木聚糖酶基因的研究以来,已经有上百种来自细菌和真菌的木聚糖酶基因被克隆和表达。木聚糖酶生产所用的菌株主要包括细菌、真菌、黑曲霉、木酶等。枯草芽孢杆菌是一种传统的酶制剂工业生产菌株,是分泌表达外源基因的良好受体菌。但枯草芽孢杆菌只能表达具有芽孢杆菌属信号肽的同源蛋白,异源蛋白的表达量往往很低或不表达,若要用于生产,蛋白的表达量必须达到1~15mg/l。本文从耐碱性木聚糖酶高产菌株中克隆得到带自身信号肽的木聚糖酶基因,利用大肠杆菌-枯草芽孢杆菌穿梭载体在枯草芽孢杆菌1A747成功实现了异源分泌表达,为下一步构建一个高效的枯草芽孢杆菌分泌表达以及信号肽筛选系统奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
短小芽孢杆菌B.pumilus BYG5-20、大肠杆菌E.coli DH5α、枯草芽孢杆菌B.subtilis 1A747由本实验室前期保存。大肠杆菌-枯草芽孢杆菌穿梭载体pGJ148为本实验室前期构建,pMD19-T Simple Vector购自大连宝生物公司。
1.1.2 主要试剂
各种限制性内切酶、T4 DNALigase购自Promega公司;LA TaqDNA聚合酶、dNTP购自大连宝生物公司。溶菌酶、RNaseA、DNA琼脂糖凝胶回收试剂盒、DNAMarkerⅢ 、1 kb ladderDNAMarker、EDTA 购 自Tiangen公司;琼脂糖、酵母提取物、胰蛋白胨购自宝泰克公司;桦木木聚糖、刚果红、NaCl为Amresco公司产品;Tris(pH值8.0)、饱和的苯酚、氯仿等试剂均为国产分析纯。
1.1.3 培养基
生孢子培养基、发酵LB培养基按文献配制。根据需要添加氯霉素,终浓度为5mg/l。
1.2 大肠杆菌、枯草芽孢杆菌的DNA操作
质粒提取、DNA的酶切、电泳、DNA片断连接、转化均参照萨姆布鲁克(2002)进行。
1.3 耐碱性木聚糖酶基因的克隆
结构基因的克隆:根据实验室前期研究已知的结构基因序列,设计并合成PCR引物,克隆基因带有自身信号肽编码序列。上下游引物的5′端分别设计了EcoRI、SacI酶切位点。
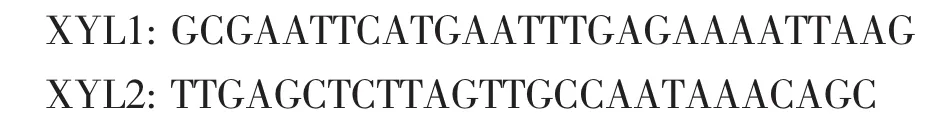
以短小芽孢杆菌B.pumilusBYG5-20总DNA为模板,进行PCR扩增。PCR反应体系为50μl,含有短小芽孢杆菌DNA 50 ng,dNTP 0.3 mmol/l,每种引物100 ng,1×PCR反应缓冲液,2.5 U LA TaqDNA聚合酶。反应条件为:94℃预变性8min后,94℃变性40 s,57℃退火40 s,72℃延伸45 s,进行34个循环;然后在72℃延伸10min。将PCR扩增产物经DNA快速回收试剂盒回收,连接到pMD19-T Simple Vector上,转化E.coli DH5α,蓝白斑筛选获得阳性克隆,提取质粒得到中间载体pMD-xynA,用EcoRI、BamHI进行酶切鉴定和测序鉴定。
1.4 表达载体的构建
将pMD19-xynA用EcoRI、BamHI双酶切得到带有自身启动子序列的木聚糖酶基因片段,连接到芽孢杆菌表达载体pGJ148,得到重组质粒pGJ148-xynA(见图1),电转化E.coli DH5a,提取质粒。酶切、PCR鉴定表达载体,得到阳性克隆株。
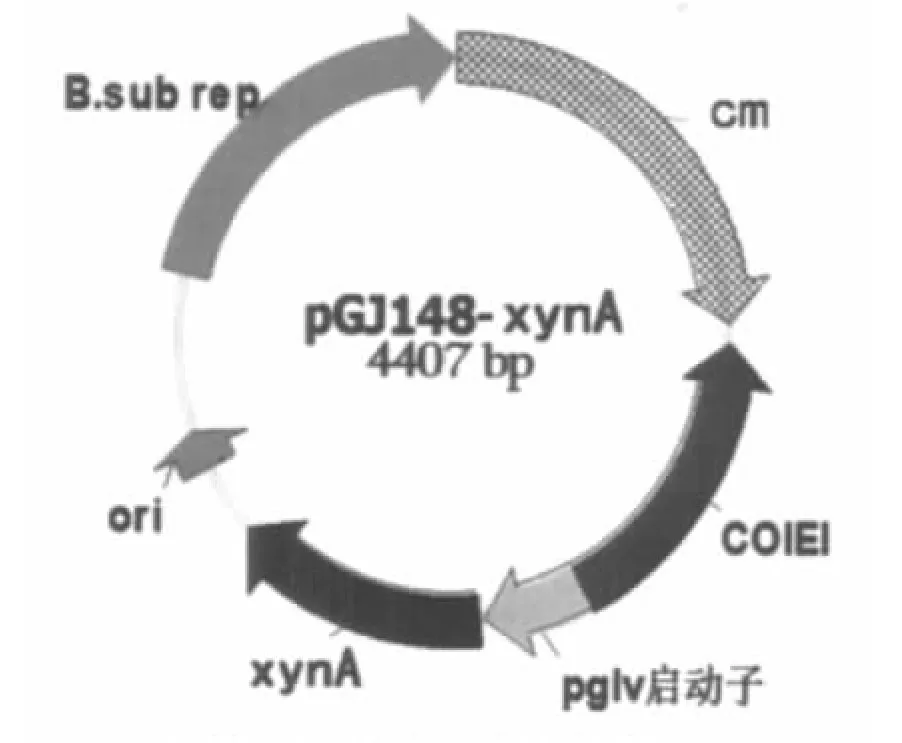
图1 pGJ148-xynA质粒图谱
1.5 木聚糖酶基因的发酵培养及诱导表达
将质粒pGJ148-xynA电转化枯草芽孢杆菌1A747,得到重组菌B.GJ148-xynA,再接入含氯霉素(5μg/ml)的生孢子培养基中37℃培养10 h。以2%的接种量转接到对应的发酵LB培养基中,37℃、220 r/min摇床培养,培养4 h后添加终浓度5%的麦芽糖溶液诱导表达,继续诱导培养一定时间,室温下 8000×g,10min离心收集上清,为胞外上清。
1.6 表达产物的分析和鉴定
参照 Laemm li(1970)方法利用 SDS-PAGE对收集的胞外上清进行表达产物分析;木聚糖酶活力测定采用DNS酶活测定法进行:取1.8 ml的0.5%木聚糖酶溶液于10ml加塞玻璃管中,加入稀释酶液0.2ml,50℃水浴10min,取出后立即加入DNS试剂2ml。沸水浴5min,流水冷却后,用蒸馏水定容至10ml,反转混匀后,在波长540 nm分光光度计上测光吸收。木聚糖酶活性定义:以每分钟生成1μmol木聚糖所需酶量定义为1个酶活力单位(IU)。
2 结果和分析
2.1 带有信号肽的木聚糖序列的克隆
从短小芽孢杆菌B.pumilus BYG5-20中提取基因组DNA。以BYG5-20的总DNA为模板,PCR扩增获得带有木聚糖酶基因编码的序列,其大小约为700bp(见图 2)。连接到 pMD19-TSimpleVector上,转化DH5α,筛选获得阳性克隆,得到pMD-xynA。测续结果正确。
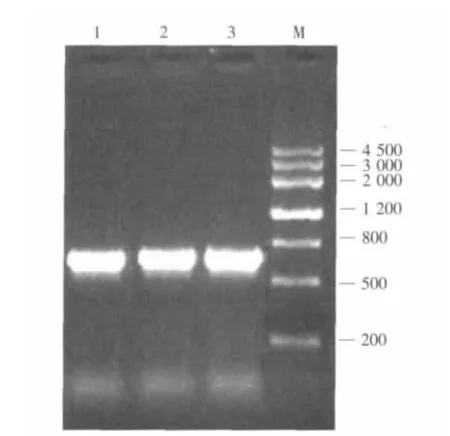
图2 xynA基因的PCR扩增结果
2.2 重组工程菌B.GJ148-xynA的构建
2.2.1 质粒pGJ148-xynA的构建
双酶切pMD19-xynA得到带有自身启动子序列的木聚糖酶基因片段,连接到芽孢杆菌表达载体pGJ148,得到重组质粒pGJ148-xynA。经酶切检验有特异条带(见图3),因此证明重组质粒pGJ148-xynA中已插入大小约为700bp的带信号肽的木聚糖酶基因片段。
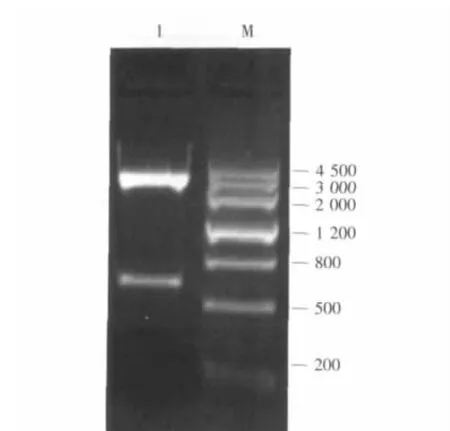
图3 pGJ148-xynA酶切鉴定结果
2.2.2 带有信号肽编码序列xylanase基因在枯草芽孢杆菌中的表达
将质粒pGJ148电转化入枯草芽孢杆菌1A747得到重组菌B.GJ148-xynA,37℃诱导表达24h后取胞外上清,然后进行酶活力测定以及SDS-PAGE分析(见图4)。结果显示,木聚糖自身信号肽在枯草芽孢杆菌中可以正常发挥作用,表达产物可以分泌到胞外,属于分泌型表达;胞外上清木聚糖酶的酶活力可达54.13IU/ml;表达产物分子量为25kDa。

图4 B.GJ148-xynA表达产物SDS-PAGE电泳图
2.3 发酵条件的优化
2.3.1 培养时间对产酶的影响(见图5)
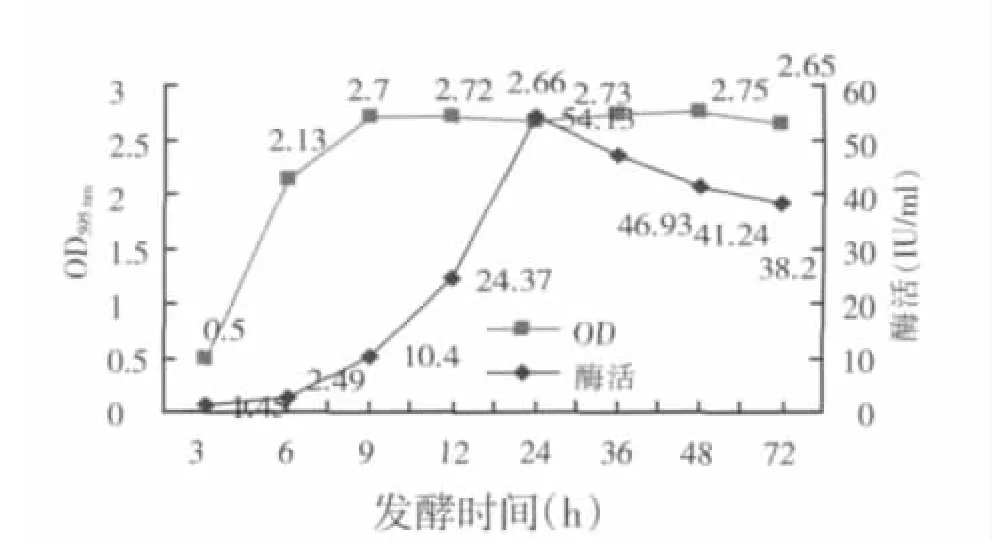
图5 培养时间对B.GJ148-xynA生长和产酶的影响
挑取B.GJ148-xynA单菌落,接入10ml含氯霉素的LB培养基中37℃培养过夜,次日以2%的接种量转接到30ml对应的LB培养基中,37℃、225r/min摇床培养。培养4h后添加5%的麦芽糖溶液诱导表达,继续培养,分别在 3、6、9、12、24、36、48 和 72h 取样,测定菌液OD595nm值,以及发酵液上清中木聚糖酶活性。
从图5可以看出,在接种3 h时细菌生长缓慢,6 h后因细菌生长的环境优越,营养和温度都适宜,所以细菌分裂比较快,迅速进入对数期生长期;24 h开始进入稳定期,并在36 h达到生长最高峰,随后发酵液中的营养物质缺乏,有些细菌生长受到抑制,甚至死亡,造成总的物质量大幅度下降。
但在木聚糖酶的表达上,在对数期前期表达量的增长比较迟缓。到了对数期后期,反而表达量迅速上升。在稳定期的前期,木聚糖酶表达量依然在迅速提高,直到24 h前后达到最高点后才缓慢下降。这是因为,在稳定期前期细菌的分裂生长速度虽然下降,但pGJ148作为松弛型质粒,在细菌内部的拷贝数依然在迅速增长。在24 h菌液酶活达到最大值54.13 IU,然后细菌生长进入衰亡期,酶活逐渐下降,与生长曲线基本一致。
2.3.2 培养温度对产酶的影响
将重组菌B.GJ148-xynA接种入对应的培养基后,在不同温度(20、25、28、30、33、37、40、45 ℃)下进行摇瓶诱导表达木聚糖酶,培养24 h后取样测定菌液OD595nm值以及木聚糖酶酶活。结果显示(见图6),在33~40℃重组菌都能很好的生长,最佳生长在37℃,在33℃表达的木聚糖酶具有最高酶活59.55 IU/ml。
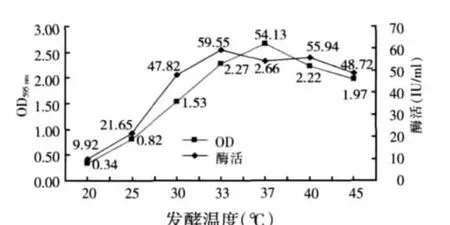
图6 培养时间对B.GJ148-xynA生长和产酶的影响
由图6可以看出,温度对细菌的生长和酶的表达有很大影响。质粒pGJ148属于松弛型质粒,当宿主菌染色体停止复制后,质粒仍能继续复制。因此,在培养基中加入抗生素后会抑制菌体蛋白的生长,但不抑制质粒拷贝数的增加。所以,适当控制细菌的生长速度可以增加质粒的拷贝数,从而增加木聚糖酶的表达量。因此,33℃的条件下木聚糖酶的表达量高于37℃条件。
2.3.3 培养基起始pH值对产酶的影响
将培养基分别调整到不同的pH值(6.0、6.5、7.0、7.5、8.0、8.5),将重组菌 B.GJ148-xynA 接入调整好的不同培养基中让其在33℃发酵,测定24 h的菌液OD595nm值,以及发酵液澄清液中木聚糖酶酶活,结果显示(见图7),在选定的pH值范围内B.GJ148-xynA都能生长,pH值7.5的生长状态最好,而在pH值8.0时具有最高酶活62.33 IU/ml。但总体来看,在培养基起始pH值6.0~8.0范围内,对木聚糖酶的表达影响较小,而且酶活变化趋势和菌体生长趋势基本一致,说明了培养基起始pH值影响菌体的生长状态,以致木聚糖酶的表达量随菌体细胞数量而变化。
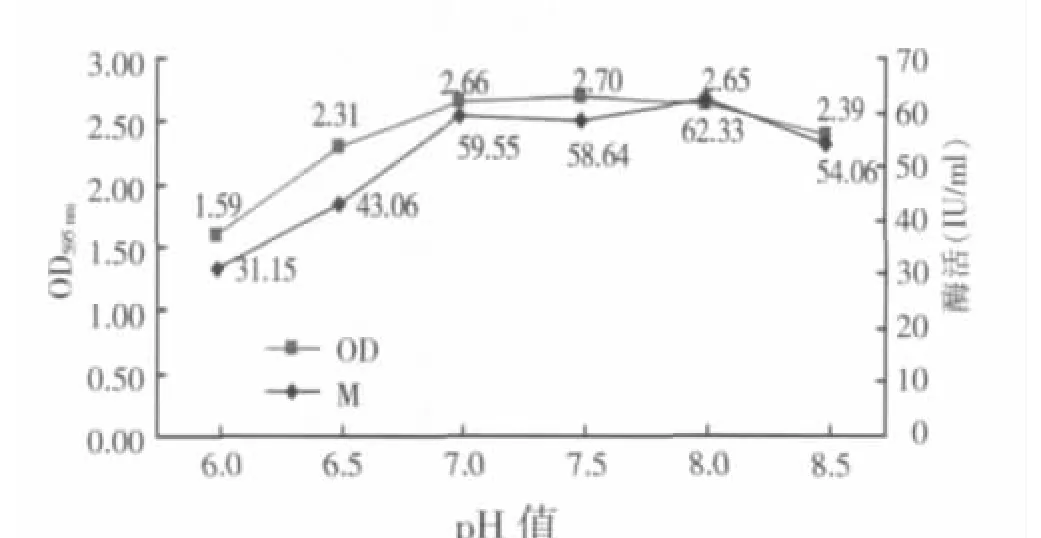
图7 培养基起始pH值对B.GJ148-xynA生长和产酶的影响
2.4 培养基碳源和氮源的优化
2.4.1 碳源的筛选
以LB为基础培养基分别加果糖、蔗糖、甘露醇、山梨醇、葡萄糖1%,以5%麦芽糖为诱导物,33℃培养,24 h取样测pH值、OD595nm值、木聚糖酶酶活值。B.GJ148-xynA对不同碳源的利用情况OD595nm值及酶的表达量见表1。
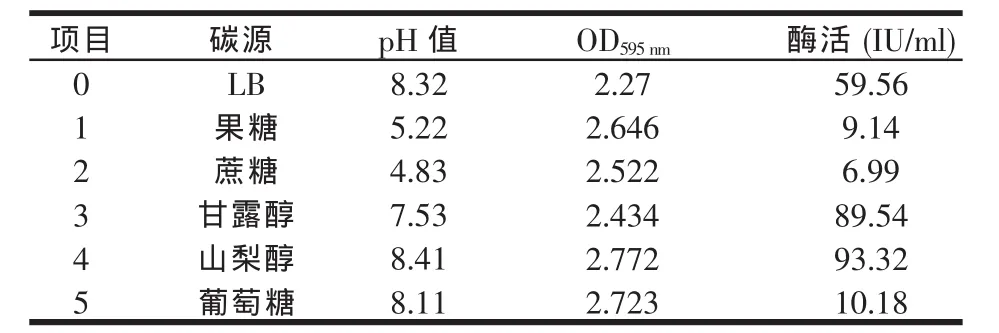
表1 不同碳源对B.GJ148-xynA生长和木聚糖酶产量的影响
由表1可知,碳源种类对B.GJ148-xynA的生长和产酶有重要影响,山梨醇作为碳源可以被B.GJ148-xynA很好利用,酶活值和菌量(OD值)都达到最大值。果糖和蔗糖虽然可以被良好地利用,但酶表达量很低,这可能与它们的次级代谢物导致培养基的pH值过低有关。葡萄糖作为碳源可以被很好的利用,但酶表达量却很低,只有10.18 IU/m l。这是因为葡萄糖的分解代谢物阻遏效应(又称葡萄糖效应)对营养型启动子(这里是麦芽糖启动子)转录具有抑制作用。
因此,本实验所用的碳源主要是山梨醇,麦芽糖作为诱导剂。
2.4.2 氮源的筛选
氮源是微生物生长所必需的营养物质之一,好的氮源不仅能为微生物提供分裂繁殖所需的养分,还能促进菌样产酶。实验以LB为基础培养基,选取了硝酸铵、硫酸铵,分别按0.5%添加量进行优化组合,培养24 h取样测pH值、OD值。由表2可知,与对照组相比,硝酸铵、硫酸铵的加入对B.GJ148-xynA的生长没有明显提高,但酶活几乎没有变化,甚至有所下降。可能是由于无机氮中不含有或者缺乏维生素、有机酸、矿物质等促进B.GJ148-xynA表达和产木聚糖酶所需的生长因子。因此,本实验不选用无机氮作为氮源。

表2 无机氮源对B.GJ148-xynA生长和木聚糖酶产量的影响
3 讨论
木聚糖酶在多种行业中广泛应用,并且已经显现出巨大的潜力,它为解决人类发展中可能遇到的能源、粮食、环境等诸多问题做出巨大的贡献,但是现阶段对木聚糖酶的遗传改造处于起步阶段,并且现有的木聚糖酶菌株普遍活力低,限制工业化生产,所以更进一步的研究高效木聚糖酶也是必要的。短小芽孢杆菌来源的木聚糖酶具有优良的酶活力和耐碱性,因此,人们尝试用各种手段提高菌株的产酶活力,以期获得大量廉价的耐碱性木聚糖酶以应用于工业化生产。除在自然界中筛选高产菌株外,人们还通过各种分子生物技术实现木聚糖酶的异源表达,但异源表达系统对短小芽孢杆菌木聚糖酶基因的表达能力极低。如在大肠杆菌表达系统中,短小芽孢杆菌的木聚糖酶表达活力不足1 IU/ml。
本研究采用的pGJ148大肠杆菌-枯草芽孢杆菌穿梭载体带有的Pglv启动子属于诱导型启动子,在含有麦芽糖的培养基中,启动子被有效诱导。麦芽糖的低成本大大提高了Pglv在工业中应用的可能性,并且Pglv启动子的强度远远大于P43和温度诱导启动子(P2和P7),是一种在枯草芽孢杆菌中广泛应用的成熟稳定的高强度启动子。
本实验采用pcr的方法从短小芽孢杆菌BYG5-20基因组DNA中获得耐碱性木聚糖酶基因xynA,利用实验室前期构建的大肠杆菌-枯草芽孢杆菌穿梭载体实现了在枯草芽孢杆菌中的异源表达。进行的发酵条件优化后,胞外上清液酶活达到93.32 IU/ml,与BYG5-20的分泌表达能力基本持平,带自身信号肽的短小芽孢杆菌木聚糖酶基因在枯草芽孢杆菌中成功实现异源表达。在下一步的工作中,我们将利用枯草芽孢杆菌内源性信号肽对该木聚糖酶分泌表达系统进行进一步的优化,为工业化生产木聚糖酶奠定基础。
[1]Kulkarni N,A Shendye,M Rao.Molecular and biotechnological aspects of xylanases[J].FEMSMicrobiology Reviews,1999,23(4):411-456.
[2]Decelle B,A Tsang,R K Storms.Cloning functional expression and characterization of three Phanerochaete chrysosporium endo-1,4-β-xylanases[J].Current Genetics,2004,46(3):166-175.
[3]吴香波,谢益民.木聚糖酶在制浆造纸工业中的应用和研究进展[J].上海造纸,2008(06):25-28.
[4]Doi R H,SWong,F Kawamura.Potential use of bacillus subtilis for secretion and production of foreign proteins [J].Trends in Biotechnology,1986,4(9):232-235.
[5]Chang S,et al.Engineering for protein secretion in gram-positive bacteria[J].Methods in Enzymology,1987,153(3):507-516.
[6]刘辉.1株产碱性木聚糖酶菌株的筛选、产酶条件与酶学性质研究及其木聚糖酶基因的克隆表达[D].杨凌:西北农林科技大学,2007:18-19.
[7]萨姆布鲁克J,DW拉塞尔著,黄培堂等译,《分子克隆实验指南(第三版)》[M].北京:科学出版社,2002:27-30.
[8]曹要玲.耐碱性木聚糖酶高产菌株的筛选、产酶条件优化及其木聚糖酶基因的克隆[D].杨凌:西北农林科技大学,2006:40-42.
[9]Laemmli U K.Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4[J].Nature,1970:227.
[10]Sunna A,P L Bergquist.A gene encoding a novel extremely thermostable 1,4-beta-xylanase isolated directly from an environmental DNA sample[J].Extremophiles,2003.7(1):63-70.
[11]李建国,班睿,司马迎青,等.氮源对重组枯草芽孢杆菌24/pMX45核黄素发酵的影响 [J].河北大学学报:自然科学版,2003,23(2):180-183.
[12]刘相梅,祁蒙,吴志红.短小芽孢杆菌A-30耐碱性木聚糖酶基因的分子生物学研究[J].应用与环境生物学报,2001(01):12-14.
[13]Ming-Ming Y,et al.Construction and characterization of a novel maltose inducible expression vector in Bacillus subtilis[J].Biotechnol Lett,2006,28(21):1713-1718.
(编辑:高 雁,snow yan78@tom.com)
Expression of bacillus pum ilus alkali resistance xylanase gene in bacillus subtilis and optim ization of fermentation conditions
Zhou Huangkai,Gong Yuesheng,Yang Mingming,Zhang Yunyan,Song Xiuping
This research aimed to study the heterologous expression of alkali resistance xylanase gene xynA in bacillus subtilis.alkali resistance xylanase gene xynA with original signal peptide was separated from bacillus pumilus BYG5-20,then was cloned into the secreted expression vector pGJ148 to construct a recombinant plasmid pGJ148-xynA.The plasmid was transformed into bacillus subtilis 1A747 and recombinant strain B.GJ148-xynA was obtained。The inducible expression of xynA was assayed and the fermentation conditions was optimized.The xylanase activity of the culture supernatant of recombinant strain was up to 93.32 IU/ml after induction expression andmedium optimization.Heterologous expression of xynA gene in bacillus subtiliswas succeed and the bacillus subtilis xylanase secretion expression system was expected to be further optimized.
xylanase;bacillus subtilis;secretion expression system;fermentation conditions
S816.7
A
1001-991X(2010)14-0025-05
周煌凯,西北农林科技大学动物科技学院,712100,陕西杨凌。
龚月生(通迅作者)、杨明明、张云雁、宋秀平,单位及通迅地址同第一作者。
2010-04-26
★ 国家自然科学基金(30871813)
