超声辅助提取花生粕中植酸工艺优化
余 安,王承明*
(华中农业大学食品科学技术学院,湖北 武汉 430070)
超声辅助提取花生粕中植酸工艺优化
余 安,王承明*
(华中农业大学食品科学技术学院,湖北 武汉 430070)
用响应面法研究超声波辅助提取花生粕中植酸的最佳工艺,考察超声温度、超声时间、超声功率、液料比和盐酸浓度5个因素对植酸提取率的影响。经响应面优化的超声波辅助提取植酸的优化工艺条件:超声温度40℃、超声时间24min、超声功率72W、液料比11:1(mL/g)、盐酸浓度0.01mol/L,此时提取率为1.48%,与模型预测值1.44%相差不到3%。实验结果说明超声波方法可较好地应用于花生粕中植酸的提取,同时得到一个能较好预测实验结果的提取模型方程。
花生粕;植酸;超声波法;响应面分析
花生是豆科植物落花生的成熟种子,具有补虚、益寿、抗衰老、美容之功效,因而被誉为“长生果”。它是全世界公认的健康食品,在我国被认为是“十大长寿食品”之一[1]。作为花生生产大国,近年来,我国的花生种植面积逐年递增,产量已达1500万t,位居世界第一位[2]。
花生粕是以脱壳花生果为原料,经提取油脂后的副产品,目前主要用于饲料[3]。经本人初步研究证实,花生粕中含有一定量的植酸。植酸以其独特的结构、化学性质、生理和药理功能,广泛地应用于冶金、化工、医药、日化、食品等行业中[4]。特别是在食品和日化工业上,利用植酸的强鳌合性,使其与辅酶中的金属离子鳌合,抑制或减缓酶促反应的发生和进行,从而在果蔬、鱼、肉等的贮藏保鲜中起到防褐保鲜的效果[4-7]。我国已将植酸作为抗氧化剂列入食品添加剂行列[4]。因此,提取花生粕中的植酸可以为花生粕的综合利用开发另一条新的途径。超声波辅助提取作为一种有效提取方法,因其简单、方便、快速和安全等优点得到了广泛应用[8]。超声作用可产生各种效应,如空化效应、湍动效应、微扰效应、界面效应和聚能效应等,其中湍动效应使边界层变薄,增大传质速率;微扰效应强化了微孔扩散;界面效应增大了传质表面积;聚能效应活化了分离物质分子。所有这些效应会引起传播媒质特有的变化,因而可从整体上促进分离过程[9]。本实验拟采用超声波辅助提取的方法从花生粕中提取植酸,以加快提取速率。
1 材料与方法
1.1 材料与试剂
花生粕 山东龙大集团公司。
盐酸 信阳市化学试剂厂;三氯化铁 天津市化学试剂三厂;磺基水杨酸 上海灵锦精细化工有限公司;植酸钠标准品 美国Sigma公司。所用试剂均为分析纯。
1.2 仪器与设备
KQ2200DB型数控超声波清洗器 昆山市超声仪器有限公司;AL204电子天平 梅特勒-托利多仪器(上海)有限公司;722型分光光度计 天津市普瑞斯仪器有限公司;TDL-5A菲恰尔离心机 上海菲恰尔分析仪器有限公司。
1.3 方法
1.3.1 原料处理
购买的花生粕粉碎,过2 0目筛,晾干备用。
1.3.2 植酸工艺流程与提取方法
提取工艺流程:花生粕→加盐酸→超声辅助提取→离心→取上清液定容→加入反应溶液→放置10~20min→离心10min→取上清液→测吸光度
提取方法:精确称取粉碎过筛的花生粕1g,置于50mL锥形瓶中。加入不同浓度的盐酸,于超声波清洗器中提取。提取结束后,将锥形瓶中全部液料倒入25mL离心管中,3000r/min离心5min,然后取上清液定容至一定体积。
1.3.3 标准曲线的绘制[10]
三氯化铁-磺基水杨酸反应溶液:称取1.5g三氯化铁和15g磺基水杨酸,加水溶解并定容至500mL。使用前以水稀释10倍。
植酸钠标准溶液:称取1.8889g植酸钠标准样品,精确至0.0001g,加水溶解并定容至100mL。使用前,吸取5mL,用水定容至500mL,其质量浓度为0.01mg/mL。
工作曲线的绘制:精确吸取植酸溶液0、1.0、2.0、3.0、4.0、5.0mL于6只10mL比色管中,用水补足至5mL,加入反应溶液4mL,摇匀,以3000r/min离心10min,放置10~20min后,将上层液倒入1cm比色皿中,于500nm波长处测定吸光度。以吸光度A为纵坐标,植酸含量Y(mg)为横坐标得回归方程:
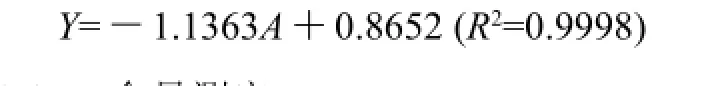
1.3.4 含量测定
取提取液5mL,于10mL比色管中,加入反应溶液4mL,其余步骤同1.3.3节方法,测定吸光度,并在工作曲线上查得或者由回归方程计算得到花生粕提取液中植酸的含量。
1.3.5 植酸提取率的计算

2 结果与分析
2.1 单因素试验
2.1.1 超声温度对植酸提取率的影响
将1g粉碎过筛的花生粕按液料比10:1加入浓度为0.01mol/L的盐酸,设定超声功率50W,分别于30、40、50、60、70、79℃(仪器最高允许工作温度)超声辅助提取5min。按植酸标准曲线法测定花生粕中植酸含量,并计算提取率。结果见图1。
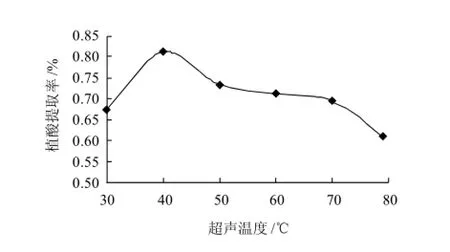
图1 超声温度对植酸提取率的影响Fig.1 Effect of extraction temperature on phytic acid yield
由图1可知,在30~79℃的温度范围内,植酸的提取率随着超声温度的升高先上升后下降,其中,在超声温度为40℃时达到最大值。温度升高,分子动能增大,有利于植酸的提取;随着温度的升高,花生粕中含量丰富的蛋白质等物质也变得易溶出,从而可能与具有6个磷酸根独特结构[11]的植酸结合而沉淀,使得植酸提取率随之下降。故选择40℃为最佳提取温度。
2.1.2 超声时间对植酸提取率的影响
将1g粉碎过筛的花生粕按10:1的液料比加入0.01mol/L的盐酸,设定功率50W,于40℃恒温中分别超声辅助提取5、10、15、20、25、30、40、50min。结果如图2所示。
应建立健全各项青年人才管理制度,把制度建设作为青年人才管理的重要手段。既要加强制度的宣传教育,又要加强制度执行、监督,最大限度地扩大制度的透明度和影响力,努力营造青年人才干事创业的良好氛围。青年人才管理制度建设要从有利于青年人才健康成长、成才出发,从客观公正选拔、日常培训教育、合理安排使用和绩效考核等方面入手,建立完善青年人才管理制度,真正实现以制度选人、凭制度用人、靠制度树人。同时,督促青年人才自觉养成带头学习制度、严格执行制度、自觉维护制度的习惯。
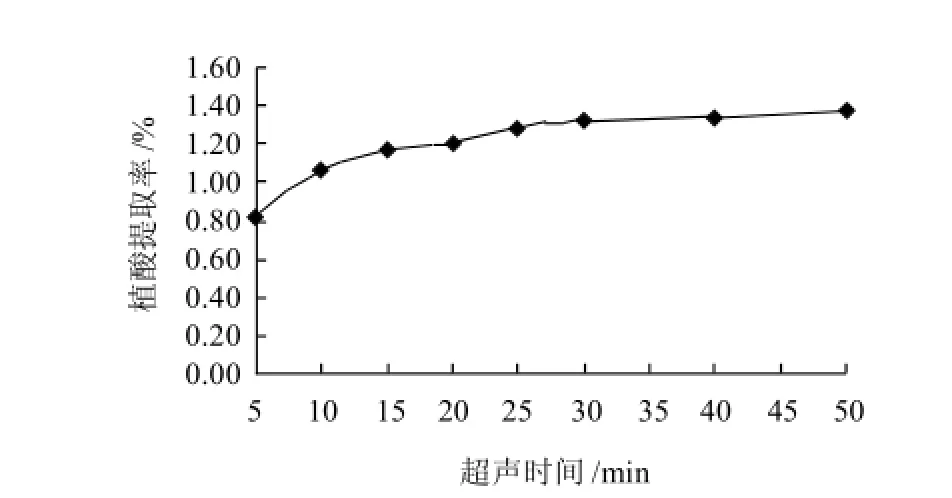
图2 超声时间对植酸提取率的影响Fig.2 Effect of extraction time on phytic acid yield
从图2可以看出,植酸的提取率随超声时间的增加有上升的趋势。其中,在5~30min的时间段里上升较
明显,在30~50min时上升比较缓慢。时间的延长,有助于植酸的溶出;但是植酸的溶出是一个动态过程,当它达到一定时间后,基本呈动态平衡状态,为减小能量消耗,因此选择30min为最佳超声时间。
2.1.3 超声功率对植酸提取率的影响
将1g粉碎过筛的花生粕按10:1的液料比加入0.01mol/L的盐酸,于40℃恒温超声辅助提取30min,设定超声功率分别为40、50、60、70、80、90、99W (仪器所允许的最高功率)。结果如图3所示。
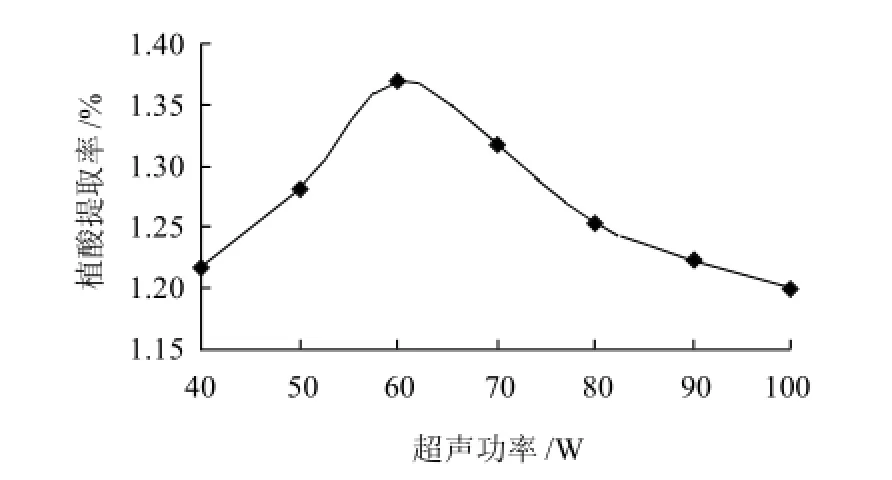
图3 超声功率对植酸提取率的影响Fig.3 Effect of ultrasound power on phytic acid yield
从图3可以看出,植酸的提取率随超声功率的增加先上升后下降。超声波功率达到60W之前,植酸的提取率随超声波功率增大而升高,当超声波功率大于60W后,植酸的提取率下降,分析其原因可能是由于超声波功率过大对植酸分子的破坏增加,再加上与溶出的蛋白质形成复合物以致植酸的提取率有所下降,所以最适合的超声波功率为60W。
2.1.4 液料比对植酸提取率的影响
将1g粉碎过筛的花生粕分别按6:1、8:1、10:1、12:1、14:1、16:1的液料比加入浓度为0.01mol/L的盐酸,于恒温40℃、功率60W条件下超声辅助提取30min。结果见图4。
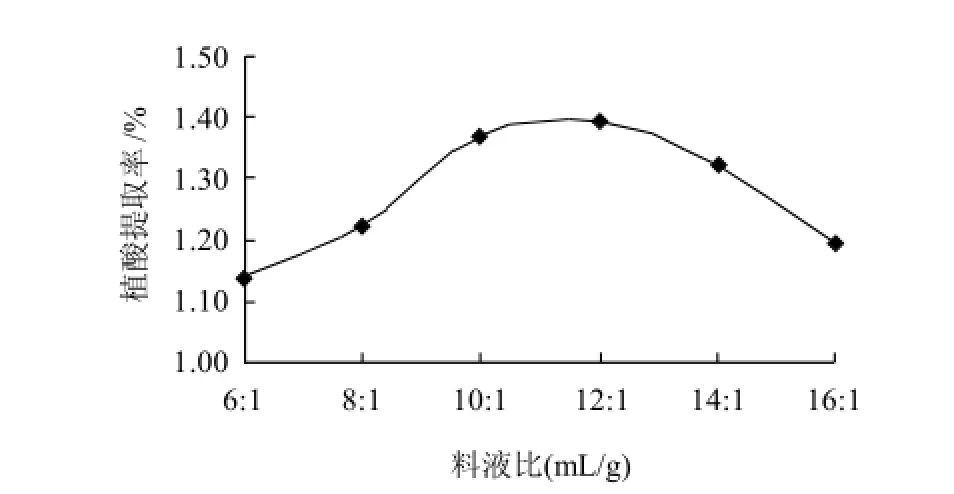
图4 液料比对植酸提取率的影响Fig.4 Effect of ratio of liquid to material on phytic acid yield
从图4可以看出,植酸提取率随液料比的增加先增加后下降。液料比过小,则花生粕不能被完全浸透,不能完全破坏植酸与其他物质的结合而使提取率低;液料比过高,植酸与蛋白质可能都溶出较多,使得两者重新螯合而使提取率又下降。当液料比为12:1时植酸提取率最高,故选择12:1的液料比为最佳液料比。
2.1.5 盐酸浓度对植酸提取率的影响
将1g粉碎过筛的花生粕按12:1的液料比加入浓度分别为0、0.0055、0.01、0.02、0.03、0.04、0.05mol/L的盐酸,于恒温40℃、功率60W条件下超声辅助提取30min。结果见图5。
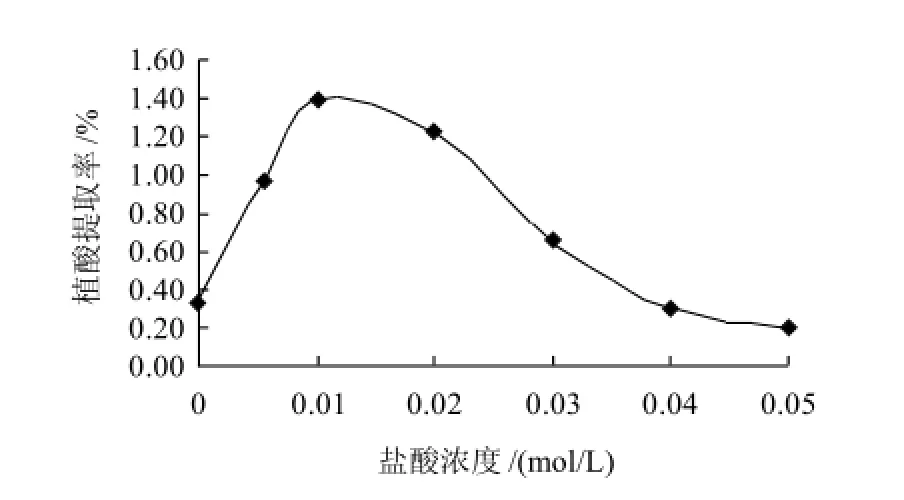
图5 盐酸浓度对植酸提取率的影响Fig.5 Effect of concentration of hydrochloric acid on phytic acid yield
由图5可以看出,盐酸浓度对植酸提取率有很大影响。随着盐酸浓度的升高,植酸的提取率先升高后下降,在盐酸浓度为0.01mol/L时达到最大值。酸浓度升高,植酸的络合能力降低,故溶出较多;酸浓度升高时,其他酸溶性的成分如酸性多糖、蛋白质等可能也随之游离出,又重新与植酸结合成螯合态,所以酸浓度过高反而使得提取率降低。故选择0.01mol/L的盐酸浓度为最佳提取浓度。
2.2 响应面试验设计
根据Box-Behnken的中心组合试验设计原理,综合单因素试验影响结果,选取超声温度、超声时间、超声功率、液料比和盐酸浓度5个因素,在单因素试验的基础上采用五因素三水平响应面分析方法。本试验以上述参数为主要考察因素(自变量),分别以A、B、C、D和E表示,自变量的高、低水平分别为+1、0、-1表示。分析因素与水平设计见表1,响应面分析方案及试验结果见表 2。
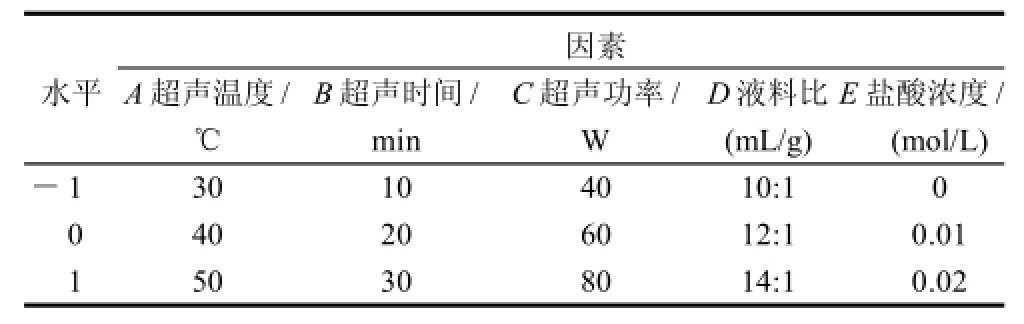
表1 响应面分析因素与水平Table 1 Factors and levels in the Box-Behnken design
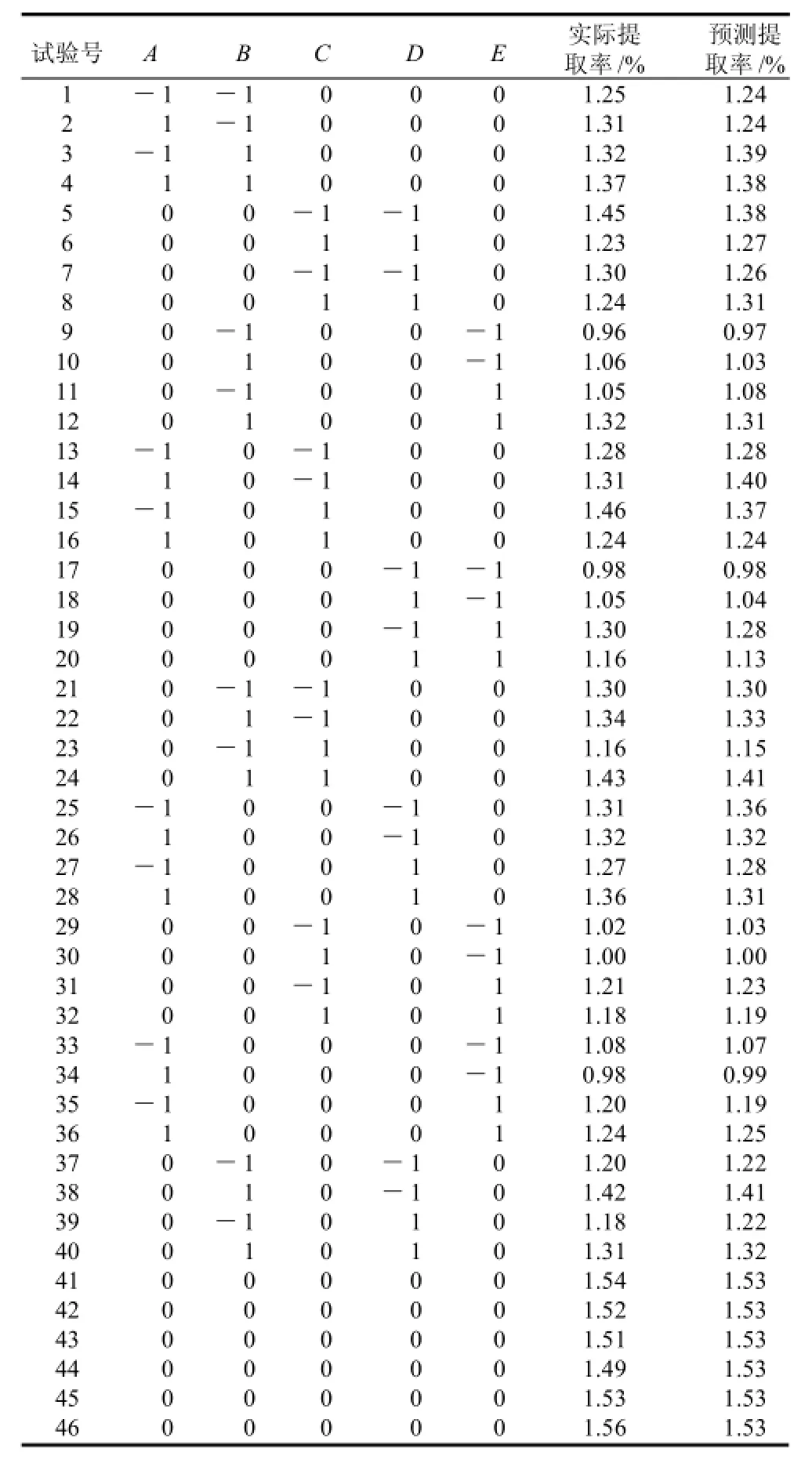
表2 响应面分析试验方案及结果Table 2 Box-Behnken design matrix and experimental results of phytic acid yield
46个实验点分为析因点和零点,实验号1~40是析因实验,实验号41~46是中心实验。其中析因点为自变量取值在A、B、C、D、E所构成的三维顶点,零点为区域的中心点,零点实验重复6次,用以估计实验误差。
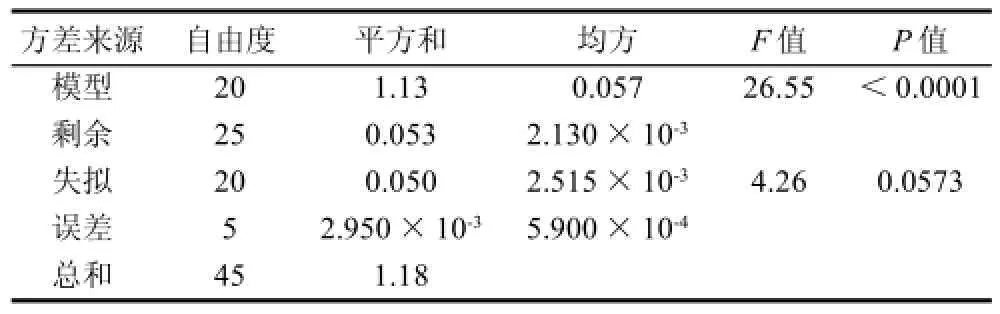
表3 回归分析结果Table3 Variance analysis for the fitted regression model
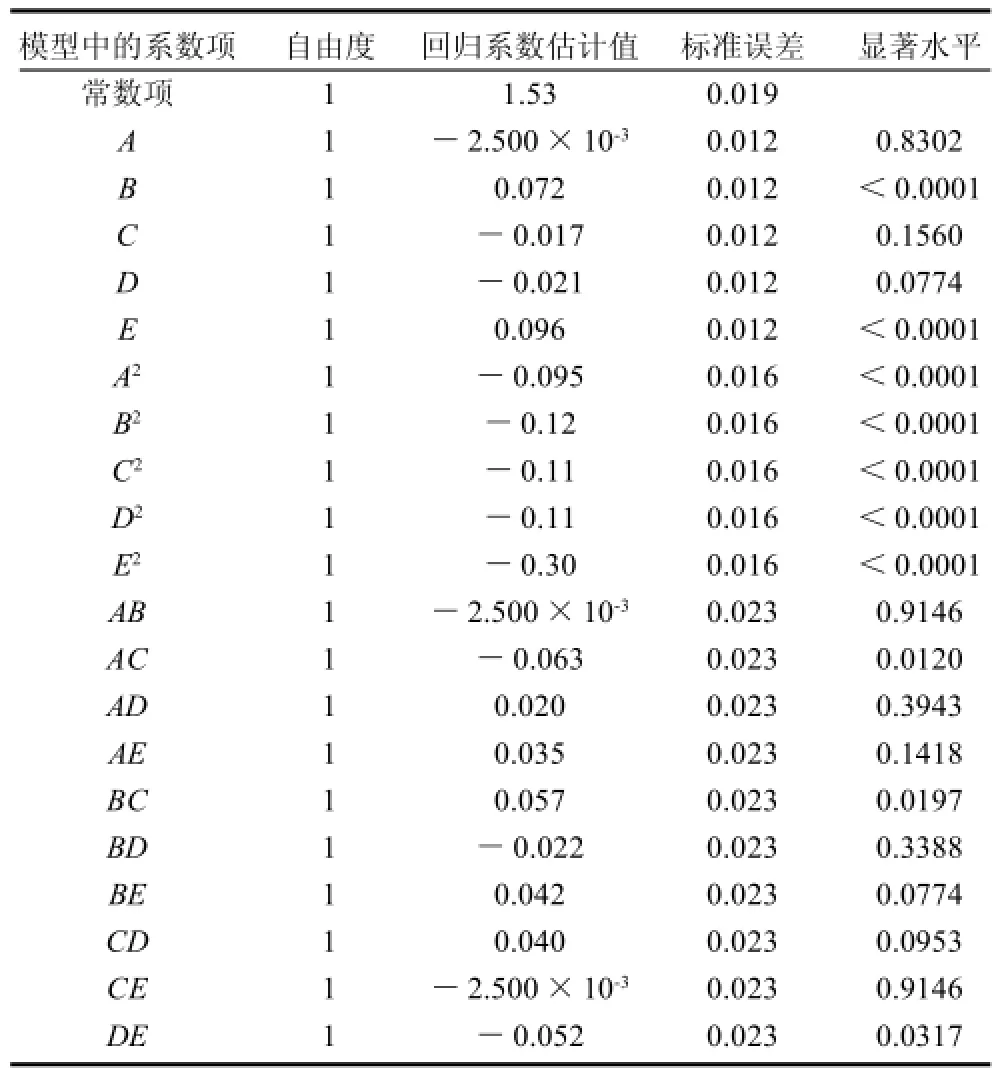
表4 回归方程系数显著性检验Table 4 Significance test for each term of the fitted regression model
模型的可靠性可从方差分析及相关系数来分析。由方差分析(表3)可知,模型在P≤0.01时水平显著,表明实验设计可靠。相关系数(R)越接近1,说明模型的预测值与实验值的相关性越好。本研究的R2=0.9550,说明模型能够很好地描述实验结果。
表4的回归系数显著性检验表明:一次项中B、E;平方项中A2、B2、C2、D2、E2;交互项中AC、BC、DE为显著性影响因素。在各影响因素中,超声时间和盐酸浓度的影响因素最大,其次是液料比和超声功率。在总的作用因素中,一次项和平方项的影响较大,而交互项影响相对较小。其中,超声温度和超声功率、超声时间和液料比、液料比和盐酸浓度有交互作用。
2.3 植酸提取率响应面优化
由于各因素对植酸提取率的影响不是简单的线性关系,为了更明确各因素对响应值Y的影响,采用本实验中的分析软件对表2数据进行回归分析,得到如下回归方程:
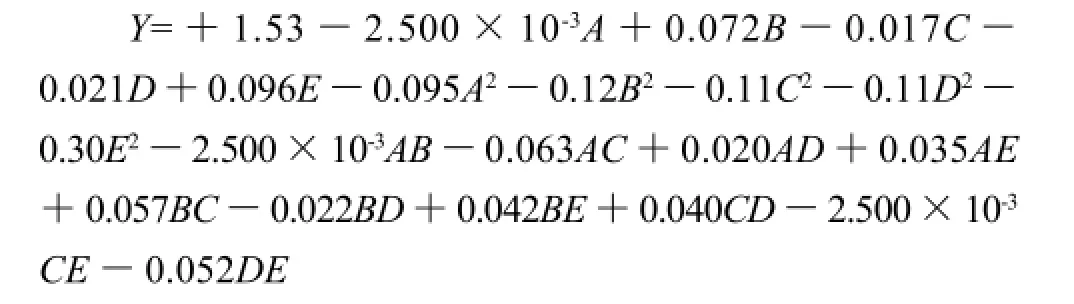
上式中,A超声温度、B超声时间、C超声功率、D液料比、E盐酸浓度在设计中均经量纲线性编码处理,因此,方程中各项系数绝对值的大小直接反映了
各因素对指标值的影响程度,系数的正负反映了影响的方向。
根据回归分析结果,作出相应曲面图,见图6~8所示。从响应面分析图上可以找出最佳参数以及各参数之间的相互作用。

图6 超声温度和超声功率的对植酸提取率的交互作用Fig.6 Response surface plot for phytic acid yield as a function of extraction temperature and concentration of hydrochloric acid
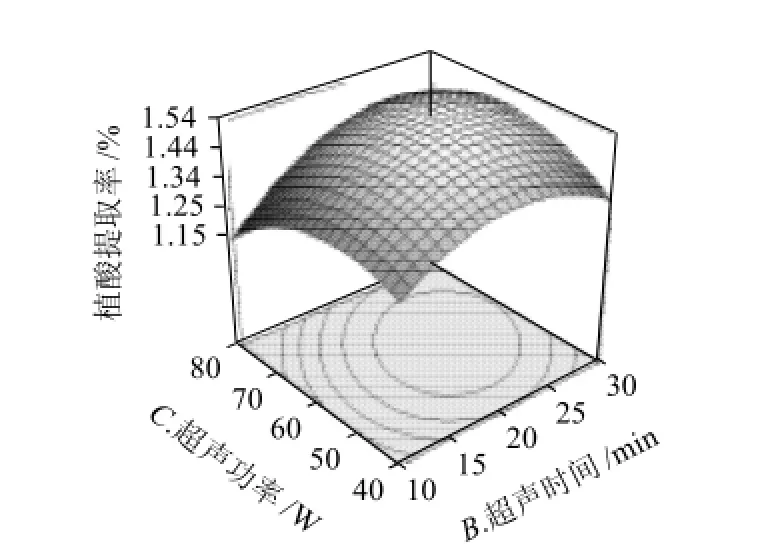
图7 超声时间和超声功率对植酸提取率的的交互作用Fig.7 Response surface plot for phytic acid yield as a function of extraction temperature and length of ultrasonic treatment
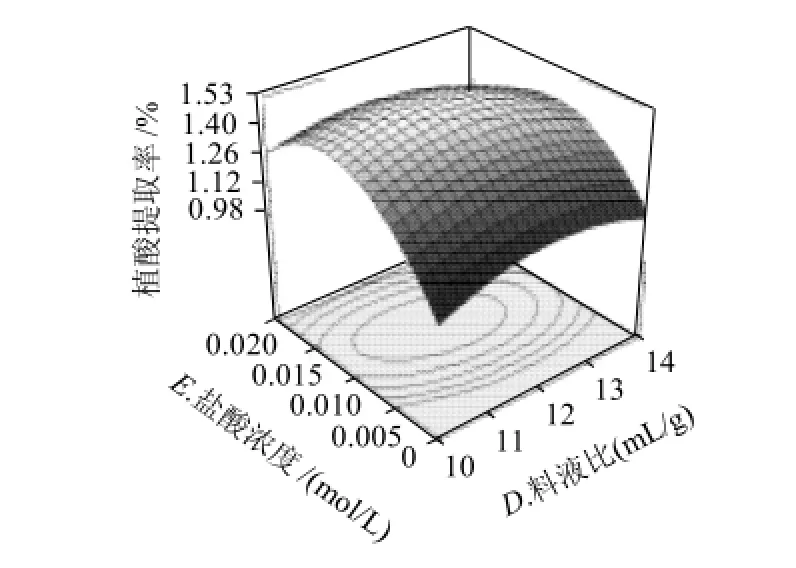
图8 液料比和盐酸浓度对植酸提取率的的交互作用Fig.8 Response surface plot for phytic acid yield as a function of material/liquid ratio and length of ultrasonic treatment
图6 ~8直观地反映了具有交互作用的两因素对响应值的影响。比较 3组图可知,超声时间和盐酸浓度对提取率的影响最为显著,表现为曲线较陡;液料比次之,而超声温度和超声功率表现为曲线较为平滑,且随其数值的增加或减少,响应值变化较小。
2.4 响应面方程的验证
在选取的各因素范围内,根据回归模型,通过响应面软件分析得出,花生粕中植酸的最佳超声提取条件为:超声温度40.37℃、超声时间23.58min、超声功率71.54W、液料比11.47:1,盐酸浓度0.007mol/L,植酸得率的预测值为1.44%。
考虑到实际操作的便利,将超声辅助提取花生粕中植酸的最佳条件修正为超声温度40℃、超声时间24min、超声功率72W、液料比11:1、盐酸浓度0.01mol/L时,实际测得的植酸提取率为1.48% ,与理论预测值相比相对误差在3%以内。因此,采用 响应面分析法优化得到的提取条件参数准确可靠,具有实用价值。
3 结 论
3.1 采用响应面分析方法,研究了提取条件对花生粕中植酸的提取率的影响,得出了预测植酸提取率的回归方程为:
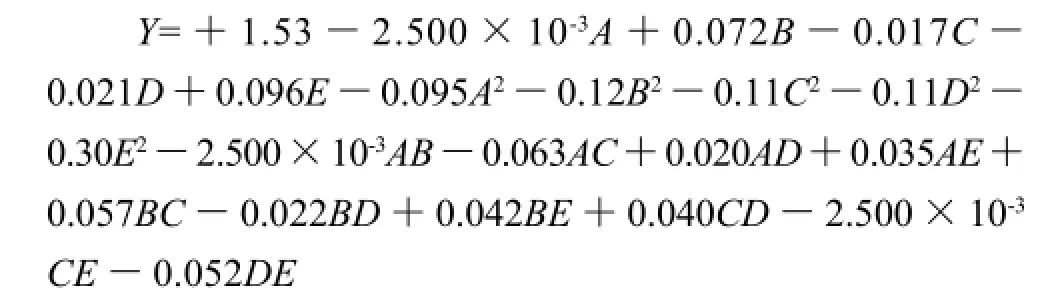
3.2 对回归方程进行分析,并根据试验的实际情况,确定植酸提取最适工艺条件:超声温度40℃、超声时间24min、超声功率72W、液料比11:1,盐酸浓度0.01mol/L。在此条件下,植酸提取率的预测值为1.44%。验证实验的植酸提取率为1.48%,与理论预测值相差不到3%,说明方程与实际情况吻合。
[1]薛芳, 颜瑞, 王承明. 超声辅助碱提取花生多糖的研究[J]. 食品科学, 2008, 29(8): 158-163.
[2]张吉民. 我国花生产业现状与入世后发展对策[J]. 山东农业科学, 2002(5): 53-54.
[3]刘祥, 马艳伟. 花生粕的品质鉴定与掺假识别[J]. 河南畜牧兽医, 2005 (6): 35.
[4]吴谋成, 袁俊华. 植酸的毒理学特性和食用安全性[J]. 食品科学, 1997, 18(2): 46-49.
[5]陈文麟. 植酸的结构、资源和应用[J]. 粮食与饲料工业, 1994(7): 41-43.
[6]XU Yong, LIU Xiaohui, PRESTWICH G D. Synthesis of phosphataseresistant analogues of phytic acid (InsP6) [J]. Tetrahedron Letters, 2005, 46 (48): 8311-8314.
[7]GRAF E, EMPSON K L, EATON J W. Phytic acid: a natural antioxidant [J]. The Journal of Biological Chemistry, 1987, 262(24): 11647-11650.
[8]严伟, 李淑芬, 田松江. 超声波协助提取技术[J]. 化工进展, 2002, 21 (9): 649-651.
[9]胡松青, 丘泰球, 张喜梅. 功率超声在分离纯化中的应用[J]. 声学技术, 1999, 18(4): 180-184.
[10]GB/T 5009.153—2003植物性食品中植酸的测定[S].
[11]王九思. 从麸皮中提取植酸及其成分的分析[J]. 化学世界, 1992(6): 269-271.
Ultrasonic-assisted Extraction of Phytic Acid from Peanut Meal
YU An,WANG Cheng-ming*
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
To optimize the ultrasonic-assisted extraction of phytic acid from peanut meal, response surface method (RSM) was used to investigate the interactive effects of length of ultrasonic treatment, ultrasonic powder, temperature, material/liquid ratio and concentration of hydrochloric acid on phytic acid yield. The optimum conditions for the ultrasonic-assisted extraction of phytic acid were determined as follows: using 11-fold volume (mL/g) of 0.01mol/L hydrochloric acid to extract the material with the assistance of the ultrasonic treatment for 24 min at 72 W. Under such conditions, the observed value of phytic acid yield was 1.48%, in basic agreement with the predicted value, 1.44%.
peanut residue;phytic acid;ultrasonic-assisted extraction;response surface methodology
TS229
A
1002-6631(2010)10-0179-05
2009-07-31
余安(1984—),女,硕士研究生,研究方向为农产品加工与贮藏。E-mail:yuan918@yahoo.com.cn
*通信作者:王承明(1964—),男,教授,博士,研究方向为农产品贮藏与加工、食品安全、食品化学。E-mail:cmwang@mail.hzau.edu.cn

