耐高温β-半乳糖苷酶的分离纯化与酶学性质分析
高兆建,侯进慧,孙会刚,刁进进
(徐州工程学院食品(生物)工程学院,江苏 徐州 221008)
耐高温β-半乳糖苷酶的分离纯化与酶学性质分析
高兆建,侯进慧,孙会刚,刁进进
(徐州工程学院食品(生物)工程学院,江苏 徐州 221008)
为从嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)XG24发酵液中纯化到β-半乳糖苷酶,并对酶学性质进行研究,利用硫酸铵分级盐析、DEAE-Sepharose Fast Flow阴离子交换层析和Sephadex G-75分子筛凝胶过滤层析等方法进行分离纯化。结果表明:经过系列步骤纯化后,酶纯度提高了54.5倍,回收率20.4%,酶比活力达32.7U/mg。以邻-硝基酚-D-半乳糖吡喃糖苷(ONPG)为底物,研究β-半乳糖苷酶的酶学性质。最适pH6.5,最适作用温度65℃。此菌株产β-半乳糖苷酶在70℃以下和pH4.0~8.0范围内具有较好的稳定性;Mg2+、Mn2+、Fe2+和Co2+对此酶有明显激活作用,而Cu2+、Ag+、Hg2+几乎完全抑制酶活性。以ONPG为底物酶的Km值为4.32mmol/L。SDS-PAGE和凝胶过滤层析测得酶蛋白为单肽链蛋白,表观分子质量64kD。因此,嗜热脂肪芽孢杆菌XG24 β-半乳糖苷酶在乳制品工业中具有潜在的应用价值。
嗜热脂肪芽孢杆菌;β-半乳糖苷酶;分离纯化;性质
β-半乳糖苷酶(β-galactosidase,EC 3.2.1.23),又称乳糖酶,能够催化β-D-半乳吡喃糖苷水解或者转糖基化。该酶广泛存在于各种动物、植物、细菌、酵母、真菌或霉菌中[1-3]。β-半乳糖苷酶将牛乳或其他乳制品中的乳糖水解为葡萄糖和半乳糖,降低乳制品中乳糖含量,提高乳制品的可消化性[4-5],广泛用于低乳糖牛奶和非结晶型浓缩牛奶的生产,解决世界一半以上人口存在的乳糖不耐症问题[6],β-半乳糖苷酶还具有半乳
糖苷转移作用,用于生产双歧因子-低聚半乳糖[7-8],从而在益生菌食品生产中被广泛应用。β-半乳糖苷酶在食品中的重要应用价值引起人们对它的广泛关注。由于微生物的快速生长、高效代谢以及分离纯化相对简单等优势,使微生物β-半乳糖苷酶成为工业化酶制剂的主要来源。目前乳品工业用于分解乳糖的β-半乳糖苷酶多从经诱导的酵母、米曲霉、黑曲霉或乳酸菌产酶后提取获得,但是均存在热稳定性差的缺点,严重限制了它在乳制品中的应用。采用高温型β-半乳糖苷酶能够克服这缺陷。酶在60℃以上温度水解乳糖,可以有助于抑制杂菌微生物的生长,而且酶反应速度快,酶用量低,反应时间短,生产中可与巴氏杀菌同时进行或冷却阶段保温水解。因此,乳糖酶的研究日益引起人们的重视[9]。
目前,已经筛选分离了多种β-半乳糖苷酶菌株,如酵母菌[10]、乳酸菌属[11]、芽孢杆菌属[12]、曲霉菌属[13]等系列菌株。但是,大部分β-半乳糖苷酶的pH值稳定范围较窄,稳定性较差。故研究热稳定性β-半乳糖苷酶成为研究的热点,如海栖热袍菌(Thermotoga maritime)[14],嗜热古细菌(Pyrococcus woesei)[15],嗜热棉毛菌(Thermomyces lanuginosus)[16]。但对于嗜热脂肪芽孢杆菌β-半乳糖苷酶国内尚未见相关报道。本实验室从温泉附近土壤中筛选到一株极高耐热性的嗜热脂肪芽孢杆菌,初步研究发现该菌株所产β-半乳糖苷酶耐热性强、酶活性高。对酶的纯化和酶学性质研究为今后从分子与结构水平研究β-半乳糖苷酶的耐热机制提供参考。
1 材料与方法
1.1 试剂与仪器
DEAE-Sephrose Fast Flow、Sephadex G-75 瑞典Amersham Pharmacia公司;考马斯亮蓝、TEMED、聚丙烯酰铵 美国Amresco公司;分子质量标准蛋白 上海生物工程公司;其他试剂均为国产或进口分析纯。
AKTA FPLC蛋白纯化系统 瑞典Aamersham Pharmacia Biotech公司;蛋白电泳仪 美国Bio-Rad公司;CR21G II立式冷冻离心机 日本日立公司。
1.2 菌种
β-半乳糖苷酶高产菌株由本实验室从温泉附近土壤中分离筛选得到。经鉴定并命名为B a c i l l u s stearothermophilus XG24。
1.3 培养基及其培养条件
接种适量的嗜热脂肪芽孢杆菌XG24菌悬液于产酶培养基中(乳糖2g、蛋白胨2g、CaCl20.01g、MgSO4·7H2O 0.001g、KH2PO40.1g、酵母浸膏0.2g、NaCl 0.015g、FeSO4·7H2O 0.001g、MnSO4·4H2O 0.001g、蒸馏水100mL),pH6.8,45℃,150r/min培养42h。发酵培养物在4℃条件下8000r/min离心15min,去除细胞,上清液作为粗酶液进行下面的分离纯化操作。
1.4 酶的分离纯化
将500mL粗酶液在冰浴中边搅拌边缓慢加入硫酸铵粉末至40%饱和度,4℃静置盐析4h后8000r/min离心30min,取上清液继续加入硫酸铵至70%的饱和度,再次离心后收集沉淀,重新溶于30mL 20mmol/L的磷酸缓冲液(pH6.5)中,并用相同的缓冲溶液彻底透析脱盐。将上述经透析脱盐后的酶液,12000r/min离心30min后,上清液加到已用缓冲液A平衡的DEAE-Sepharose Fast Flow (2.5cm×30cm)阴离子交换柱上,先用不含NaCl的缓冲溶液A洗脱,直到洗至A280nm在0.02以下时,再用0~1.0mol/L的NaCl进行线性梯度洗脱。含酶组分合并后用聚乙二醇20000包埋法浓缩至2mL,再上Sephadex G-75(1.6cm×90cm)分子筛凝胶柱,用含0.02mol/L NaCl的20mmol/L磷酸缓冲溶液(pH6.5)进行洗脱,收集有酶活性部分检测酶纯度及用于酶学性质的研究。
1.5 酶活性测定
参考Gul-Guven等[11]的方法,并略有改动。取500μL待测酶液加入到已经预热到65℃的1.5mL含有2mmol/L ONPG的0.1mol/L磷酸缓冲液(pH6.5)中,65℃水浴保温10min后,加入1mL 1mol/L的碳酸钠溶液终止反应,于405nm波长处测定吸光度,计算水解产物邻硝基酚的含量和酶的活性,同时以0.1mol/L pH6.5磷酸缓冲液代替酶液作为对照。乳糖酶活性的定义:1个单位的乳糖酶的活性为在pH6.5,65℃条件下每分钟分解ONPG生成lμmol邻硝基酚(ONP)所需的酶量。
1.6 蛋白质浓度测定
蛋白质浓度测定采用Lowry法[17],以牛血清白蛋白质制作标准曲线对蛋白质浓度进行定量。
1.7 分子质量的测定
1.7.1 凝胶过滤法
蓝色葡聚糖上样Sephadex G-75凝胶色谱柱,测定柱空隙体积(V0),然后上样标准蛋白及样品蛋白,测定各蛋白的洗脱体积(Ve),以各标准蛋白的洗脱体积同柱空隙体积的比率(Ve/V0)同标准蛋白的分子质量对数(lgMW)制作标准曲线。然后从标准曲线中求出该β-半乳糖苷酶的表观分子质量。标准蛋白为兔磷酸化酶B、牛血清白蛋白、兔肌动蛋白、胰蛋白酶抑制剂、鸡蛋清溶菌酶作标准蛋白。
1.7.2 SDS-PAGE电泳
按Laemmli等[18]的方法进行SDS-PAGE电泳,分离胶10%,浓缩胶5%。将样品及标准蛋白(兔磷酸化酶B (97400D)、牛血清白蛋白(66200D)、兔肌动蛋白
(43000D)、牛碳酸酐酶(31000D)、胰蛋白酶抑制剂(20100D)、鸡蛋清溶菌酶(14400D))进行SDS-PAGE,然后以相对迁移率对分子质量作图,从图中求出该β-半乳糖苷酶的分子质量。
1.8 β-半乳糖苷酶性质研究
1.8.1 温度和pH值的影响
将反应体系分别置于30~85℃的水浴中进行反应,测定β-半乳糖苷酶活力,确定最适反应温度。酶热稳定性的测定是取同样浓度的β-半乳糖苷酶分别置于40、50、60、70、80℃的水浴中,每隔1h取样测定残余酶活力,用保存在4℃冰箱的相同酶液所测得的酶活性作为空白,设为100%,共测定4h。
纯化后的β-半乳糖苷酶在不同pH4.0~10.0条件下进行酶促反应以测定其最适pH值。测定pH值稳定性是将酶液加入到100mmol/L的不同pH值缓冲液中,再于40℃保温1h,然后按照标准方法测定剩余β-半乳糖苷酶的活性。所用缓冲液为:pH4.0~5.5的醋酸钠缓冲液、pH6.0~7.5的磷酸钠缓冲液、pH8.0~9.0的Tris-HCl缓冲液、pH9.0~10.5的甘氨酸-氢氧化钠缓冲液。以β-半乳糖苷酶在pH6.5时所测的酶活力为100%,其他pH值条件下所测为相对酶活力。
1.8.2 金属离子的影响
取适当稀释的酶液,向其中分别加入用蒸馏水配制的金属盐溶液,40℃保温1h后,标准方法测定残余酶活力。金属盐分别为:NaCl、KCl、MgCl2、CaCl2、MnSO4、FeCl2、CoCl2、CuSO4、ZnSO4、AgNO3、HgCl2。
1.8.3 酶Km值的测定
在pH6.5、温度65℃的条件下,分别将ONPG稀释到终含量0~1%,测定β-半乳糖苷酶在不同底物浓度下的酶活力。根据Lineweaver-Burk方程,求此条件下的Km值。
2 结果与分析
2.1 β-半乳糖苷酶分离与纯化

图1 DEAE-Sepharose FF离子交换层析Fig.1 DEAE-Sepharose fast flow ion exchange chromatographic separation of thermostableβ-galactosidase
采用了硫酸铵分段盐析、透析、DEAE-Sepharose fast flow离子交换层析、分子筛凝胶过滤层析等纯化手段从嗜热脂肪芽孢杆菌XG24发酵液中分离纯化β-半乳糖苷酶。柱层析纯化结果分别见图1、2,纯化的检测结果见图3。
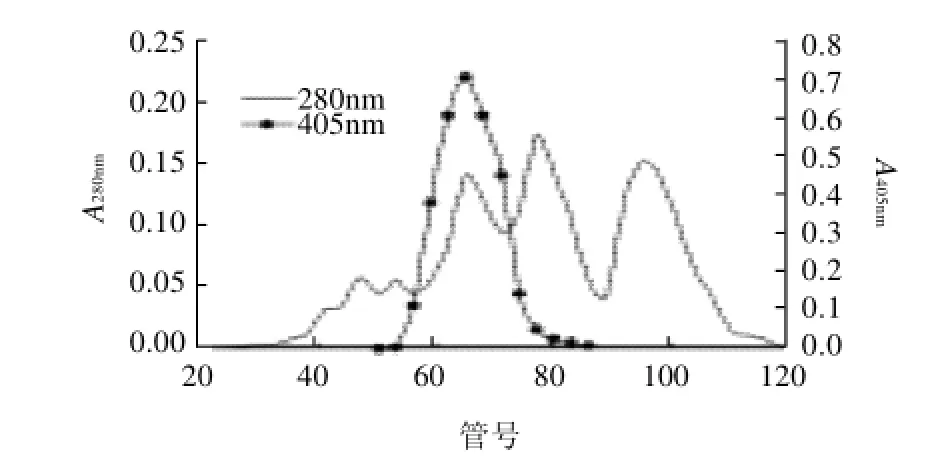
图2 Sephadex G-75分子筛凝胶过滤层析Fig.2 Sephadex G-75 gel filtration chromatographic purification of thermostableβ-galactosidase

图3 β-半乳糖苷酶SDS-PAGE图谱Fig.3 SDS-PAGE of thermostableβ-galactosidase at different separation and purification steps
硫酸铵分段盐析显示,在40%饱和度以下,沉淀蛋白中酶活性较弱,而上清液中检测到较高的酶活性,在硫酸铵饱和度70%以上时,沉淀β-半乳糖苷酶活性较低。综合考虑到酶的纯化效率和回收率,选择40%~70%饱和度的硫酸铵盐析。沉淀后的粗酶蛋白溶解在磷酸缓冲液中,充分透析脱盐及小分子的杂蛋白和色素。
彻底脱盐后的粗酶液上样经过充分平衡的离子交换柱,NaCl线性梯度洗脱显示,分离得到3个较大的蛋白主峰,收集管酶活性检测到一个酶活性峰,主要在第二个蛋白峰的左侧,所对应的NaCl洗脱浓度为0.5mol/L。从洗脱曲线看出,离子交换层析效率较高,能够去除大部分的杂蛋白,但酶活性峰的对应位置没有明显清晰的蛋白峰,说明酶液中含有杂蛋白。合并有酶活性的收集管,采用聚乙二醇2 0 0 0 0包埋法浓缩后,上样Sephadex G-75凝胶柱,进一步纯化。凝胶柱层析洗脱曲线显示3个清晰的蛋白峰,酶活性检测到第一个蛋白
峰有极强的酶活性,而第二和第三个蛋白峰均没有酶活性。合并有活性的收集管酶液,进一步电泳检测以及用于酶的性质研究。SDS-PAGE检测结果表明发酵液中的粗酶液经以上纯化步骤后,酶纯度达到电泳均一,纯化各步骤相应的酶活性、蛋白浓度、产率和纯化倍数见表1。

表1 β-半乳糖苷酶的分离纯化Table 1 A summary of purification steps of thermostableβ-galactosidase fromB. stearothermophilusXG 24
由表1可知,酶纯化了5 4.5倍,比活力达到32.7U/mg,产率为20.4%。采用一系列层析技术从不同的微生物发酵液中分离纯化到β-半乳糖苷酶[11,19-20],而本研究从嗜热脂肪芽孢杆菌XG24发酵液中发现β-半乳糖苷酶并分离纯化到电泳纯的酶蛋白。
经各步骤纯化后的酶液SDS-PAGE电泳后硝酸银染色结果如图3所示。硫酸铵盐析后的酶液电泳后有较多的杂蛋白存在,经过离子交换层析后,杂蛋白明显减少,最后分子筛凝胶过滤层析后,显示单一的一条蛋白带,表明纯化后的酶蛋白达到电泳纯,同标准分子质量蛋白对照显示纯化到的β-半乳糖苷酶分子质量约为64kD。通过Sephadex G-75色谱柱测定酶蛋白分子质量为63.5kD。由此推断,纯化到的β-半乳糖苷酶含有一个蛋白亚基,表观分子质量为64kD。与所报道的嗜热踝节菌(Talaromyces thermophilus)(50kD)[19]相似,但比来源于棘孢曲霉(Aspergillus aculeatus)(120kD)[13]、嗜热链球菌(Streptococcus thermophilus)(530kD)[21]、嗜热硫矿硫化叶菌(Sulfolobus solfataricus)(240kD)[22]要小许多。故推测从嗜热脂肪芽孢杆菌XG24中所纯化到的β-半乳糖苷酶可能为一种新的β-半乳糖苷酶的同工酶。
2.2 β-半乳糖苷酶的酶学性质
2.2.1 β-半乳糖苷酶最适作用温度和热稳定性
如图4所示,在温度50~75℃的范围内所测β-半乳糖苷酶活力都在60%以上,最适反应温度为65℃。酶的热稳定性实验结果如图5所示,酶在50℃保温2h酶活力残留92%,60℃保温2h残留在85%,70℃保温2h残留65%活力,80℃保温2h残留24%活力。热稳定性实验表明嗜热脂肪芽孢杆菌XG24 β-半乳糖苷酶具有强的热稳定性,比来源于嗜酸乳杆菌(Alicyclobacillus acidocaldarius)[11]、产黄青霉(Penicillium chrysogenum)[23]等菌株的β-半乳糖苷酶稳定性要高。同目前的研究报道相比较,从嗜热脂肪芽孢杆菌XG24纯化到的β-半乳糖苷酶是国内外所报道的β-半乳糖苷酶中耐热性最强的酶之一。酶的耐热性强在酶工业化应用中具有很多优势,酶在高温下处理样品,可以抑制微生物的生长[24],防止乳制品杂菌污染。而且高温下水解反应速度快,时间短,可以大量地节约成本,提高生产效率。目前,耐高温β-半乳糖苷酶在乳制品加工业中备受关注,具有广阔的应用前景。
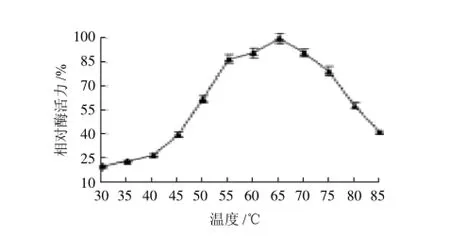
图4 温度对β-半乳糖苷酶活性的影响Fig.4 Effect of temperature on thermostableβ-galactosidase activity

图5 温度对β-半乳糖苷酶稳定性的影响Fig.5 Effect of temperature on thermostableβ-galactosidase stability
2.2.2 β-半乳糖苷酶最适作用pH值及pH值稳定性

图6 pH值对β-半乳糖苷酶活性及稳定性的影响Fig.6 Effect of pH on thermostableβ-galactosidase activity and stability

表2 金属离子对β-半乳糖苷酶活性的影响Table 2 Effect of metal ions on thermostableβ-galactosidase activity
纯化后的β-半乳糖苷酶在不同pH值的缓冲体系、65℃条件下测定的酶活性,结果如图6所示,β-半乳糖苷酶在pH5.5~7.0之间酶活力在85%以上,最适作用pH值为6.5,同所报道的嗜热球菌β-半乳糖苷酶最适pH值(pH6.0)[11]接近,但比源于棘孢曲霉的β-半乳糖苷酶最适pH值(pH5.4)[13]稍高。β-半乳糖苷酶在一系列不同pH值的缓冲液中40℃条件下处理1h后,再在最适pH值下测定酶活性,结果表明,在pH4.0~7.5之间保持90%以上的酶活性,而在pH7.5以上,酶活性则急速下降,表明β-半乳糖苷酶在弱酸性环境下非常稳定。鉴于多数乳制品饮料的pH值也在这一范围内,故该酶的这些生化特性赋予了嗜热脂肪芽孢杆菌XG24 β-半乳糖苷酶乳制品加工中有极大的应用优势,因此该酶有着潜在的市场应用价值。
2.2.3 β-半乳糖苷酶的反应动力学
固定β-半乳糖苷酶的量,以不同浓度ONPG溶液为底物,测定酶反应速度。采用Lineweaver-Burk作图法,求得嗜热脂肪芽孢杆菌XG24 β-半乳糖苷酶对ONPG的Km为4.32mmol/L。同所报道的β-半乳糖苷酶相比较,如嗜热球菌的Km为8.9mmol/L[11]、栖热菌属细菌(Thermus)的Km为5.9mmol/L[9]、嗜冷动性球菌(Planococcus)的Km为9mmol/L[25],嗜热脂肪芽孢杆菌XG24 β-半乳糖苷酶同底物ONPG的亲和力较强。
2.2.4 金属离子对β-半乳糖苷酶的影响
在酶反应液中分别加入不同的金属离子使其终浓度为1mmol/L和10mmol/L。表2显示:Cu2+、Ag+、Hg2+在所检测范围内几乎完全抑制酶的活性,Ca2+、Zn2+具有较弱的抑制活性。Na+、K+对酶活性的作用不明显;Mg2+、Mn2+、Fe2+和Co2+对酶活性均有促进作用,Fe2+、Mn2+在低浓度时激活作用更强,而Mg2+、Mn2+在高浓度时激活作用较强。
3 讨 论
分离筛选极端环境下的一些产生极端生化特性酶的微生物菌株一直是研究的热点。本实验室从温泉附近土壤中分离筛选到一株产生β-半乳糖苷酶的极端耐热菌株。从菌株发酵液中分离纯化到了电泳均一的β-半乳糖苷酶。纯化步骤简单、操作简便,大大减少酶的损失,回收率高。
酶学性质研究表明,β-半乳糖苷酶最适作用pH值为6.5,温度为65℃。同时具有强的热稳定性,是典型的耐热型β-半乳糖苷酶。这些生化特性赋予了该酶在乳制品加工中有极大的应用优势。酶活性长时间保持稳定,并具有较好的酶活力,保存相对比较容易,可以应用于一般条件下的工业生产。也可以在温度较高的环境下使用,因此,该极耐热性β-半乳糖苷酶具有很好的工业应用前景。
本研究着重对酶的分离纯化和酶学性质进行了研究,并对其工业应用前景进行了探讨和展望。但对该酶耐热的分子机制研究还处于探索阶段。对该酶的分子机制的更进一步研究将有利于后续更多微生物极端酶的开发和利用。
[1]HIDAKA M, FUSHINOBU S, OHTSU N, et al. Trimeric crystal structure of the glycoside hydrolase family 42 β-galactosidase from Thermus termophilus A4 and the structure of its complex with galactose[J]. Journal of Molecular Biology, 2002, 322: 79-91.
[2]MORACCI M, NUCCI R, FEBBRAIO F, et al. Expression and extensive characterizarion of aβ-glycosidase from the extreme thermoacidophilic archaeon Sulfolobus solfataricus in Escherichia coli: authenticity of the recombinant enzyme[J]. Enzyme and Microbial Technology, 1995, 17: 992-997.
[3]LADERO M, SANTOS A, GARCIA J L, et al. Studies on activity and the stability of β-galactosidases from Thermus sp. strain T2 and from Kluyveromyces fragilis[J]. Enzyme and Microbial Technology, 2002, 30: 392-405.
[4]GREENBERG N A, MAHONEY R R. Immobilization of lactase (βgalactosidase) for use in dairy processing: a review[J]. Process Biochemistry, 1981, 16: 2-8.
[5]GEKAS V, LOPEZ-LEIVA M. Hydrolysis of lactose: a literature review [J]. Process Biochemistry, 1985, 20: 2-12.
[6]RINGS E H, van BEERS E H, KRASINSKI S D, et al. Lactase: origin, gene expression, localization and function[J]. Nutrition Resource, 1994, 14: 775-797.
[7]KARASOVA-LIPOVOVA P, STRNAD H, SPIWOK V, et al. The cloning, purification and characterisation of a cold-activeβ-galactosidase from the psychrotolerant Antarctic bacterium Arthrobacter sp. C2-2 [J]. Enzyme and Microbial Technology, 2003, 33: 836-844.
[8]HUNG M N, LEE B H. Puri?cation and characterisation of a recombinantβ-galactosidase with transgalactosylation activity from Bifidobacterium infantis HL96[J]. Applied Microbiology and Biotechnology, 2002, 58: 439-445.
[9]OHTSU N, MOTOSHIMA H, GOTO K, et al. Thermostable betagalactosidase from an extreme thermophile Thermus sp. A4: enzyme purification and characterisation, gene cloning and sequencing[J]. Bioscience Biotechnology and Biochemistry, 1998, 62: 1539-1545.
[10]DOMINGUES L, LIMA N, TEIXEIRA J A. Aspergillus nigerβ-galac-
tosidase production by yeast in a continuous high cell density reactor[J]. Process Biochemistry, 2005, 40: 1151-1154.
[11]GUL-GUVEN R, GUVEN K, POLI A, et al. Purification and some properties ofβ-galactosidase from the thermoacidophilic Alicyclobacillus acidocaldarius subsp. rittmannii isolated from Antarctica[J]. Enzyme and Microbial Technology, 2007, 40: 1570-1577.
[12]SCHALLMEY M, SINGH A, WARD O P. Developments in the use of Bacillus species for industrial production[J]. Canadian Journal of Microbiology, 2004, 50(1): 1-17.
[13]van CASTEREN W H M, EIMERMANN M, van den BROEK L A M, et al. Purification and characterisation of aβ-galactosidase from Aspergillus aculeatus with activity towards (modified) exopolysaccharides from Lactococcus lactis subsp. cremoris B39 and B891[J]. Carbohydrate Research, 2000, 329: 75-85.
[14]LI Lite, ZHANG Min, JIANG Zhengqiang, et al. Characterisation of a thermostable family 42β-galactosidase from Thermotoga maritime[J]. Food Chemistry, 2009, 112: 844-8502.
[15]DABROWSKI S, MACIUN SKA J, SYNOWIECKI J. Cloning and nucleotide sequence of the thermostableβ-galactosidase gene from Pyrococcus woesei in Escherichia coli and some properties of the isolated enzyme[J]. Molecular Biotechnology, 1998, 10(3): 217-222.
[16]FISCHER L, SCHECKERMANN C, WAGNER F. Purification and characterization of a thermotolerantβ-galactosidase from Thermomyces lanuginosus[J]. Applied and Environmental Microbiology, 1995, 61 (4): 1497-1501.
[17]PETERSON G L. Determination of total protein[J]. Methods in Enzymology, 1983, 91: 86-105.
[18]LAEMMLI U K. Cleavage of structural proteins during the assembly of bacteriphoge T4[J]. Nature, 1970, 227: 680-685.
[19]NAKKHARAT P, HALTRICH D. Purification and characterisation of an intracellular enzyme withβ-glucosidase andβ-galactosidase activity from the thermophilic fungus Talaromyces thermophilus CBS 236. 58[J]. Journal of Biotechnology, 2006, 123: 304-313.
[20]BIAKOWSKA A M, CIESLINSKI H, NOWAKOWSKA K M, et al. A new β-galactosidase with a low temperature optimum isolated from the Antarctic Arthrobacter sp. 20B: gene cloning, purification and characterization[J]. Archives of Microbiology, 2009, 191: 825-835.
[21]GREENBERG N A, MAHONEY R R. Production and characterization of β-galactosidase from Streptococcus thermophilus[J]. Journal of Food Science, 1982, 47: 1824-1835.
[22]PISANI F M, RELIA R, RAIA C A, et al. Thermostableβ-galactosidase from the archaebacterium Sulfolobus solfataricus purification and properties[J]. European Journal of Biochemistry, 1990, 187: 321-328.
[23]NAGY Z, KISS T, SZENTIRMAI A, et al.β-Galactosidase of Penicillium chrysogenum: production, purification, and characterization of the enzyme[J]. Protein Expression and Purification, 2001, 21: 24-29.
[24]HAKI G D, RAKSHIT S K. Developments in industrially important thermostable enzymes: a review[J]. Bioresource Technology, 2003, 89: 17-34.
[25]SHERIDAN P P, BRENCHLEY J E. Characterization of a salt-tolerant family 42β-galactosidase from a psychrophilic Antarctic Planococcus isolate[J]. Applied and Environment Microbiolog, 2000, 66: 2438-2444.
Purification and Enzymatic Characterization of Thermostableβ-Galactosidase from Bacillus stearothermophilus XG24
GAO Zhao-jian,HOU Jin-hui,SUN Hui-gang,DIAO Jin-jin
(College of Food (Biological) Engineering, Xuzhou Institute of Technology, Xuzhou 221008, China)
The fermentation supernatant of Bacillus stearothermophilus XG24 received salting out with ammonium sulfate, separation on DEAE-Sepharose Fast Flow anion exchange column and purification on Sephadex G-75 gel filtration column to obtain high-purity thermostable β-galactosidase, which was subsequently subjected to enzymatic characterization with o-nitrophenylβ-D-galactopyranoside (ONPG) as a substrate. After the above separation and purification procedures, the purity of this enzyme showed a 54.5-fold increase, with an activity recovery of 20.4%, and the specific activity of the purified enzyme was 32.7 U/mg protein. The optimal pH and temperature for the reaction of this enzyme were 6.5 and 65 ℃, respectively. It was stable at temperatures below 70 ℃ or in a pH range between 4.0 and 8.0. Its activity was notably promoted by Mg2+, Mn2+, Fe2+and Co2+, whereas Cu2+, Ag+and Hg2+were almost able to entirely inhibit its activity. The Kmtowards ONPG was determined to be 4.32 mmol/L. The SDS-PAGE analysis revealed that this enzyme was a single-chain protein. Based on the results of Sephadex G-75 gel filtration chromatographic measurement, it was deduced that the apparent molecular weight of this enzyme was 64 kD. Therefore, Bacillus stearothermophilus XG24-derived thermostable β-galactosidase has high application potential in the dairy industry.
Bacillus stearothermophilus;β-galactosidase;purification;characterization
Q939.97
A
1002-6630(2010)23-0151-06
2010-03-21
徐州市博士科研启动基金资助项目
高兆建(1976—),男,讲师,博士,主要从事微生物次生代谢产物与基因工程。E-mail:gaozhaojian@126.com

