冷藏牙鲆中主要腐败菌卵黄抗体的抑菌性能
胥亚夫,林 洪,张 茜,田良良,赵 硕,隋建新,曹立民*
(中国海洋大学水产品安全实验室,山东 青岛 266003)
冷藏牙鲆中主要腐败菌卵黄抗体的抑菌性能
胥亚夫,林 洪,张 茜,田良良,赵 硕,隋建新,曹立民*
(中国海洋大学水产品安全实验室,山东 青岛 266003)
根据菌落形态、生理生化特征,利用细菌鉴定系统,对4℃冷藏养殖牙鲆货架期终点时的主要腐败菌进行定性和定量研究。最终确定4℃冷藏货架期终点时养殖牙鲆的优势腐败菌为腐败希瓦氏菌,占细菌总数的比例约为58.4%。水产品中常见的腐败菌假单胞菌属细菌主要包括荧光假单胞菌、腐臭假单胞菌和边缘假单胞菌,它们在假单胞菌属中所占的比列依次是63.2%、29.2%、7.6%。以3种主要的腐败菌腐败希瓦氏菌、荧光假单胞菌和腐臭假单胞菌作为混合抗原,以两种不同方式免疫产蛋母鸡,制备两种卵黄抗体,并对其液体和固体培养条件下的抑菌效果进行研究。结果表明:液体培养8h,质量浓度为100mg/mL的两种混合抗体对抗原菌的抑制率能达到61%~78%; 固体培养24h后, 同样质量浓度的两种混合抗体对抗原菌的抑制率能达到27%~40%。这表明卵黄抗体有望作为一种新型的天然抑菌剂应用于水产食品的抑菌防腐。
牙鲆;优势腐败菌;腐败希瓦氏菌;假单胞菌属;卵黄免疫球蛋白;抑菌活性
引起水产品腐败变质的主要原因是细菌的生长代谢,且大多数情况下只有部分菌种参与了腐败过程。在特定的原料、加工、流通、贮藏等因素条件下,能够较好地适应并繁殖的个别微生物逐渐占据优势地位,并产生腐败臭味和异味的代谢产物,这种微生物即被称为该产品的特定腐败菌(SSO)[1]。在冻结温度以上,鱼类的特定腐败菌主要是一些嗜冷性细菌[2],而且同类型产品中往往只有一种或几种微生物总是作为腐败菌出现,已有对于沙丁鱼、大黄鱼、罗非鱼等品种的研究证实,这些鱼类在有氧冷藏或者冰藏条件下的SSO一般
以假单胞菌属的细菌以及腐败希瓦氏菌为主[3-6]。
开发安全的天然生物保鲜剂代替传统的化学合成防腐剂是食品防腐剂发展的方向,如壳聚糖、茶多酚等天然保鲜剂已经被广泛地用于降低鱼肉的腐败程度[7]。卵黄免疫球蛋白(IgY)简称卵黄抗体,由于制备简单,具有较好的热稳定性和耐酸碱性已经得到越来越多的关注[8]。而且卵黄抗体还具有一个非常重要的性质就是它对其抗原菌的生长具有显著地抑制作用,大量的研究已经证实卵黄抗体的体内和体外抑菌特性[9-11]。
牙鲆目前是我国重要的海水增养殖鱼类之一,肉嫩味美,营养丰富,具有较高的经济价值和发展前景[12]。随着近年来养殖产量的持续增加,对其加工及保鲜技术的研究就显得愈加重要。目前对于冷藏养殖牙鲆货架期终点时的优势腐败菌的分析,以及应用卵黄抗体抑制水产品中腐败菌的相关研究至今未见相关报道。本研究主要对4℃冷藏养殖牙鲆货架期终点时的主要腐败菌进行分离鉴定,并筛选出3种主要的腐败菌作为混合抗原菌制备卵黄抗体,然后通过液体和固体培养实验初步验证卵黄抗体对主要腐败菌的生长抑制效应。从而为进一步将其应用于实际水产样品,开发一种新型的生物保鲜产品提供实验参考。
1 材料与方法
1.1 材料与试剂
养殖牙鲆于2009年5月购买于青岛市南山水产市场,产地为山东省威海市,活体运输到实验室。敲头致死,无菌生理盐水清洗,然后无菌操作条件下,去头、去内脏、去鳞和鳃,切片,每片大约5 0 g,然后每片鱼肉分别用无菌样品袋包装后,4℃冷藏条件下贮藏。
假单胞菌C F C选择性培养基;营养琼脂培养基(NA);福氏完全佐剂、福氏不完全佐剂、辣根酶标记兔抗鸡IgG Sigma公司;牛血清白蛋白(BSA) 北京索莱宝公司;硫酸铵(优级纯) 天津科密欧化学试剂开发中心;莱亨蛋鸡 青岛森淼公司下属养殖场。
1.2 仪器与设备
SW-CJ-2FD洁净工作台 苏州安泰空气技术有限公司;WGP-350隔水式电热恒温培养箱 上海精宏实验设备有限公司;VITEK 2 COMPACT 全自动微生物鉴定仪法国生物梅里埃股份有限公司;BIOLOG自动微生物鉴定仪 美国Biolog公司。
1.3 货架期终点判定
1.3.1 感官和化学指标
由6名经过训练的评价员组成感官评定小组,对牙鲆样品的气味、色泽、质地等进行综合评定打分。分为0~5分,5分为好,4分为较好,3分为一般,2分为较差,1分为很差。对6人所打分数取平均值,当平均值低于2.5时即判定为货架期终点;按照GB/T5009. 44—1996测定挥发性盐基氮(TVBN)。
1.3.2 细菌总数的测定
取出鱼肉,在无菌条件下匀浆,称取鱼肉匀浆3g,加入27mL无菌生理盐水制成10-1稀释液,振荡后,以10倍递增稀释法进一步制成10-2、10-3和10-4等稀释度的稀释液,取100μL各稀释度的稀释液分别涂布于营养琼脂培养基平板表面,25℃培养24h后计数,每个稀释度作3个平行实验。
1.4 货架期终点时主要腐败菌株分离及鉴定
优势腐败菌的分离:在货架期终点时细菌总数测定的培养基平板上,经肉眼观察菌落形态进行简单分类,选取其中数量优势较为明显的菌种进行平板计数,并从中挑选出合适大小的单菌落,平板划线法分离纯化,25℃培养24h。
假单胞菌的分离:同样取100μL各稀释度的稀释菌液,分别涂布于假单胞菌CFC选择性培养基平板表面,25℃培养24h。选取菌数合适(通常20~200个菌落)的平板进行计数,同时依据菌落形态、革兰氏染色、运动性等特征进行细菌分组,每组挑选所有菌落或若干菌落(至少2~3个菌落),分离纯化,25℃培养24h。
菌种鉴定:参照《常见细菌系统鉴定手册》[13],综合菌落形态、细胞形态学、生理生化等特征,利用Vitek和Biolog微生物鉴定系统对分离纯化的菌株进行鉴定。
1.5 动物免疫
货架期终点时从牙鲆中分离的3种主要腐败菌分别接种于营养肉汤培养基中,于25℃培养24h,4000r/min离心30min收集菌体,然后于1%甲醛溶液中灭活48h,营养琼脂平板检测没有活菌后备用。然后用生理盐水将灭活的菌体细胞调节至一定浓度,采用两种不同的免疫方式:1)按照一定比例制成混合抗原(2:1:1),使最终3种菌体细胞浓度分别为2×109、1×109CFU/mL和1× 109CFU/mL。取菌悬液与福氏完全佐剂按1:1混合后充分乳化,于鸡的双翅及胸肌处皮下散点注射(1mL/只),2、6、10周后换为福氏不完全佐剂加强免疫注射。2)先注射一种菌体(浓度为2×109CFU/mL),2、4d后分别注射另外两种菌体(浓度均为1×109CFU/mL),然后于2、6、10周后换为福氏不完全佐剂加强免疫,每次免疫3种菌体的注射时间均相隔2d。每周收集免疫后的鸡蛋,4℃储存备用。同时以不注射免疫的鸡蛋制备非特异性抗体作为阴性对照。
1.6 特异性IgY的提取和效价测定
特异性IgY的提取是采用硫酸铵盐析的方法[14],取免疫后蛋黄20g,按1:10(m/V)用双蒸水稀释,混合均匀后用0.1mol/L的HCl调节pH至5.1±0.1,4℃静置过夜。4℃、4000r/min离心20min,取上清液过滤。然后向滤液中分别加入50%和33%饱和度的硫酸铵进行二次盐析,离心后收集沉淀并溶解于适量的磷酸盐缓冲液(PBS)中,透析后即为IgY溶液。两种免疫方式和没有免疫的鸡蛋中提取的IgY分别称为M1-IgY、M2-IgY和N-IgY。
间接酶联免疫吸附法测定IgY效价采用传统操作步骤[15]:以109CFU/mL的两种主要的腐败菌菌体抗原分别包被96孔板,以PBS和阴性IgY提取液作为空白和阴性对照,浓度与阳性抗体的稀释梯度一致。抗体的效价定义为:样品OD450nm值(P)与阴性对照OD450nm值(N)的比值P/N≥2.1时所需要的样品最大稀释倍数。
1.7 IgY抑菌效果实验[9,11]
液体抑菌:将达到一定效价的M1-IgY和M2-IgY抗体分别用营养肉汤(NB)稀释至100mg/mL(以抗体冻干粉计),0.22μm 微孔滤膜除菌后取6mL放入血清瓶中,然后每个血清瓶加入100mL的菌体溶液,使最终菌体细胞浓度为108CFU/mL,空白对照则加入6mL NB培养基。阴性对照是将没有免疫的鸡蛋中提取的N-IgY用营养肉汤(NB)稀释至100mg/mL,取6mL于血清瓶中,然后加入菌体溶液,使最终菌体细胞浓度为108CFU/mL。于25℃振摇培养,每隔2h于600nm波长处测定吸光度。同时,制作两种主要的腐败菌菌体细胞浓度和OD600nm之间的对应关系标准曲线。
固体抑菌:待平板中的N A培养基凝固后,用100mg/mL的特异性IgY溶液6mL表面浸泡处理30min,取出IgY抗体30min后取20μL约104CFU/mL的菌液重新涂布平板,25℃培养箱中培养24h,计算菌落总数。同时用未经IgY处理的平板以相同浓度和体积的菌液进行空白对照实验,以相同浓度的N-IgY处理的平板进行阴性对照实验。
2 结果与分析
2.1 货架期终点判定
通过感官评定、TVBN和细菌总数的测定,判断4℃冷藏条件下,养殖牙鲆在第9天时达到货架期终点。对应的感官评分为(2.23±0.26)<2.5分,TVB-N值为(30.73±0.70)mg/100g,细菌总数值为(7.25± 0.09)lg (CFU/g)。TVBN值被广泛的用作肉类腐败的指标,根据GB 2733—1994,TVB-N30mg/100g是鱼肉腐败的最高可接受水平。在第9天, 牙鲆腐败初期TVB-N大约为30.73mg/100g,同时,细菌总数达到了7.25lg(CFU/g),高于原料鱼肉腐败的最大推荐值7.0lg(CFU/g)[16],这从化学和微生物指标表明养殖牙鲆在第9天时达到货架期终点。
2.2 腐败菌的分类及鉴定
货架期终点时,在稀释度为4的营养琼脂平板上,共分离出195株细菌,根据肉眼观察菌落形态和形态学特征分类发现,只有一种细菌占有明显的数量优势,其数量为114株,其余种类细菌的数量都相对非常有限,而且分布较为分散,因此初步判断其中数量最多的一类细菌为优势腐败菌,菌落形态特征见表1(第1组),分离纯化后通过Vitek和Biolog微生物鉴定系统对其生理生化特征,碳源利用代谢特征进行鉴定,确定其为腐败希瓦氏菌(Shewanella putrefaciens),该菌在货架期终点时占细菌总数的58.4%,因此判定牙鲆在冷藏过程中货架期终点时的优势腐败菌为腐败希瓦氏菌。
采用传统表现型实验对在稀释度为3的假单胞菌CFC选择性培养基平板上获得的138株细菌进行初步鉴定,均呈现革兰氏阴性,具有运动性,符合假单胞菌属的一般特征,但菌落形态存在一定差异,可进一步分为3类,菌落特征见表1(第2~4组)。假单胞菌属细菌在货架期终点时占细菌总数的7.1%,通过Vitek和Biolog微生物鉴定系统对其鉴定分别为荧光假单胞菌(Pseudomonas fluorescens)、腐臭假单胞菌(Pseudomonas taetrolens)和边缘假单胞菌(Pseudomonas marginalis),它们在假单胞菌属中的比例依次为63.2%、29.2%、7.6%。

表1 所分离纯化的4组微生物的菌落形态特征Table 1 Colony morphological characteristics of four strains isolated
海产鱼初始细菌菌相与鱼类生存及捕获环境、季节、捕获方法相关,在流通、加工、贮藏过程中的菌相变化则受多种因子制约,其中温度是主要影响因子之一[17]。在低温冷藏过程中,部分嗜冷微生物生长增殖速度比其他种类的细菌快,逐渐占据优势地位并产生感官不能接受的代谢产物而导致鱼品腐败,即成为冷藏过程中的特定腐败菌(SSO)[1]。目前国内外一般认为在冷藏过程中,耐冷的革兰氏阴性细菌腐败希瓦氏菌和假单胞菌往往是优势腐败菌,这对于很多种鱼、贝类和甲壳类都是适用的,无论是温带水域、亚热带水域和热带水域[18]。腐败希瓦氏菌是海洋性革兰氏阴性菌,
腐败活性强,能产生H2S、还原TMAO等,是常见的冷藏海产鱼类腐败菌之一 ;假单胞菌属细菌则在淡水鱼和海水鱼都有报道,虽然不产生H2S和还原T M A O,但产生大量醛、酮、酯等产物,从而导致感官品质的下降[19]。本研究的结果与之前的报道基本吻合,腐败希瓦氏菌和荧光假单胞菌是牙鲆中两种主要的腐败菌,同时腐败希瓦氏菌又是优势腐败菌,考虑到其数量上的优势,应在今后的加工和保藏过程中重点予以监控。
2.3 特异性IgY抗体效价测定
M1-IgY和M2-IgY抗体对腐败希瓦氏菌和荧光假单胞菌产生的效价如图1、2所示。 ELISA测定结果表明M1-IgY和M2-IgY对腐败希瓦氏菌的效价分别为1:1000、1:2000(图1),对荧光假单胞菌的效价分别为1:2000、1:5000(图2)。无论是对腐败希瓦氏菌还是荧光假单胞菌,M2-IgY表现出更高的效价。

图1 混合抗体对腐败希瓦氏菌的效价(n=3)Fig.1 Titer of mixed IgY againstShewanella putrefaciens(n=3)

图2 混合抗体对荧光假单胞菌的效价(n=3)Fig.2 Titer of mixed IgY againstPseudomonas fluorescens(n=3)
2.4 液体培养条件下IgY的抑菌效果
由于腐败希瓦氏菌和荧光假单胞菌是冷藏养殖牙鲆中两种主要的腐败菌,所以进行两种混合IgY对腐败希瓦氏菌和荧光假单胞菌抑制作用的验证实验,首先进行常规的液体培养生长抑制实验,结果如图3、4所示。在菌体生长的初期(2h),特异性IgY抗体对两种菌的生长影响并不明显,但经过4h后,阴性抗体N-IgY对两种菌依然没有显示明显的抑制作用,而培养基中加入M1-IgY和M2-IgY抗体的,腐败希瓦氏菌和荧光假单胞菌的生长开始受到抑制,随着培养时间的延长,这种抑制作用也逐渐显著。 根据腐败希瓦氏菌菌体细胞与OD600nm的对应关系标准曲线(图5),当培养8h时,与空白对照相比,100mg/mL 的M1-IgY和M2-IgY抗体分别可以使腐败希瓦氏菌减少61.6%和67.2%。根据荧光假单胞菌菌体细胞与OD600nm的对应关系标准曲线(图6),当培养8h,100mg/mL 的M1-IgY和M2-IgY抗体分别可以使荧光假单胞菌减少69.2%和77.8%。在培养的过程中,无论是对腐败希瓦氏菌还是荧光假单胞菌,M2-IgY抗体的抑菌效果要高于M1-IgY的抑菌效果,这应该是与M2-IgY的效价比M1-IgY抗体的效价高有关。

图3 25℃营养肉汤中混合IgY对腐败希瓦氏菌的抑菌性能(n=3)Fig.3 Growth curves ofShewanella putrefaciensin the presence of two IgYs at 25 ℃ (n=3)

图4 25℃营养肉汤中混合IgY对荧光假单胞菌的抑菌性能(n=3)Fig.4 Growth curves ofPseudomona fluorescensin the presence of two kind of IgY at 25 ℃ (n=3)

图5 腐败希瓦氏菌菌体计数标准曲线(n=3)Fig.5 Calibration curve forShewanella putrefaciensin NB medium (n=3)

图6 荧光假单胞菌菌体计数曲线(n=3)Fig.6 Calibration curve forPseudomona fluorescensin NB medium (n=3)
2.5 固体培养条件下IgY的抑菌效果
考虑到腐败希瓦氏菌和假单胞菌属引起的腐败常常发生在肉制品、水产品等固体食品原料中,因此研究IgY抗体在固体培养条件下的抑菌效果将会更加有效并且有助于其在实际样品中的应用。固体培养条件下IgY也显示出了较为显著的抑菌效果。如表2所示,在固体培养平板上,24h后,经过M1-IgY抗体和M2-IgY抗体处理组与空白对照组相比对腐败希瓦氏菌的抑制率分别为27.8%和38.3%,对荧光假单胞菌的抑制率分别为31.1%和40.0%。在固体培养条件下两种混合抗体的抑菌效果基本上与液体培养条件下的抑菌效果保持了很好的一致性。
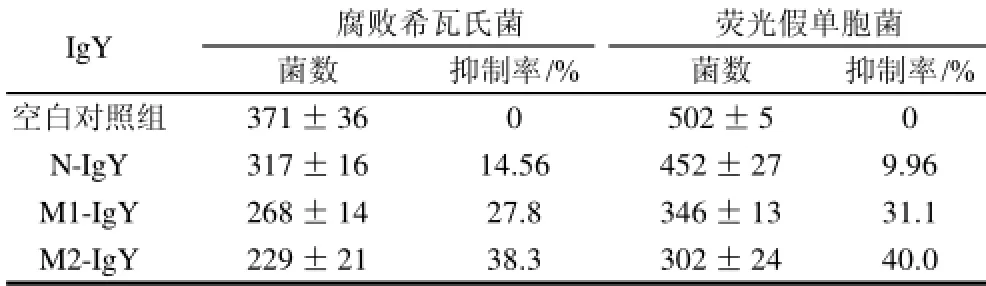
表2 固体培养基条件下IgY抗体的抑菌效果(n=3)Table 2 Antibacterial effect of mixed IgY in solid NA medium (100mg/ mL) (n=3)
3 结 论
在4℃冷藏条件下,养殖牙鲆货架期终点时的优势腐败菌为腐败希瓦氏菌,所占的比例为58.4%,并且存在水产品中常见的腐败菌假单胞菌属细菌,其中荧光假单胞菌所占的比例最大。将牙鲆货架期终点时3种主要的腐败菌腐败希瓦氏菌、荧光假单胞菌和腐臭假单胞菌作为混合抗原制备的卵黄抗体,无论是在液体环境还是在固体培养条件下,对水产品中两种常见的优势腐败菌腐败希瓦氏菌和荧光假单胞菌都具有明显的抑制趋势,这表明其具有非常重要的研究开发价值,有望作为一种新型的天然生物抑菌剂应用于水产食品的抑菌保鲜。通过卵黄抗体与其他生物抑菌剂的复合使用,并应用于实际样品中,增强协同作用,应用前景将很广阔。
[1]DALGAARD P. Qualitative and quantitative characterization of spoilage bacteria from packed fish[J]. Int J Food Microbiol, 1995, 26: 319-333.
[2]GENNARI M, TOMASELLI S, COTRONA V. The microflora of fresh and spoiled sardines (Sardina pilchadus) caught in Adriatic (Mediterranean) sea and stored in ice[J]. Food Microbiol, 1999, 16: 15-28.
[3]GRAM L, HUSS H H. Microbiological spoilage of fish and products[J]. Int J Food Microbiol, 1996, 33: 121-137.
[4]GRAM L, TROLL G, HUSS H H. Detection of specific spoilage bacteria from fish stored at low (0℃) and high (20℃) temperature[J]. Int J Food Microbiol, 1987, 4: 65-72.
[5]郭全友, 杨宪时, 许钟, 等. 养殖大黄鱼冷藏过程中细菌菌相的变化[J].中国水产科学, 2007, 14(2): 301-308.
[6]刘寿春, 周康, 钟赛意, 等. 淡水养殖罗非鱼中病原菌和腐败菌的分离与鉴定初探[J]. 食品科学, 2008, 29(5): 327-331.
[7]赵海鹏, 谢晶. 生物保鲜剂在水产品保鲜中的应用[J]. 吉林农业科学, 2009, 34(4): 60-64.
[8]LEE K A, CHANG S K, LEE Y J, et al. Acid stability of anti Helicobacter pylori IgY in aqueous polyol solution[J]. Biochemistry and Molecular Biology, 2002, 35 (9): 488-493.
[9]LEE E N, SUNWOO H H, MENNINEN K, et al. in vitro Studies of chicken egg yolk antibody (IgY) against Salmonella enteritidis and Salmonella typhimurium[J]. Poultry Sci, 2002, 81: 632-641.
[10]李晓华, 杨晓燕, 戴爱玲. 抗鸡念珠菌卵黄抗体的研制及应用[J]. 福建农林大学学报: 自然科学版, 2006, 35(6): 628-631.
[11]ZHEN Y H, JIN L J, GUO J, et al. Characterization of specific egg yolk immunoglobulin (IgY) against mastitis-causing Escherichia coli[J]. Vet Microbiol, 2008, 130: 126-133.
[12]王波, 张朝晖, 左言明, 等. 牙鲆属主要经济鱼类的生物学及养殖研究概况[J]. 海洋水产研究, 2004, 25(5): 86-92.
[13]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 162-170.
[14]隋建新, 林洪, 曹立民, 等. 单增李斯特菌鸡卵黄抗体的制备及其抑菌活性研究[J]. 食品与发酵工业, 2009, 35(2): 1-6.
[15]隋建新, 林洪, 刘春娥, 等. 恩诺沙星完全抗原的合成及其偶联条件的初步优化研究[J]. 中国食品学报, 2006(6): 167-172.
[16]IBRAHIM S K. Antimicrobial and antioxidant effects of sodium acetate, sodium lactate, and sodium citrate in refrigerated sliced salmon[J]. Food Control, 2007, 18: 566-575.
[17]郭全友, 许钟, 杨宪时. 冷藏养殖大黄鱼品质变化特征及细菌相分析[J].上海水产大学学报, 2006, 15(2): 216-221.
[18]GRAM L, HUSS H H. The microbiological safety and quality of food [M]. Gaithersburg Maryland USA: Aspen Pbulishers Inc, 2000: 472-506.
[19]DALGAARD P, GRAM L, HUSS H H. Spoilage and shelf life of cod fillets packed in vaccum or modified atmosphere[J]. Int J Food Microbiol, 1993, 19: 283-294.
Characterization of Chicken Egg Yolk Antibodies against Dominant Spoilage Organisms in Paralichthys olivaceus during Cold Storage
XU Ya-fu,LIN Hong,ZHANG Qian,TIAN Liang-liang,ZHAO Shuo,SUI Jian-xin,CAO Li-min* (Food Safety Laboratory, Ocean University of China, Qingdao 266003, China)
The dominant spoilage organisms in cultured Paralichthys olivaceus during cold storage at 4 ℃ were qualitatively and quantitatively investigated. Based on the colony morphology, biochemical and physiological characteristics, spoilage bacteria were isolated at the end of shelf life and identified using bacteria identification systems. Shewanella putrefaciens was dominated spoilage bacteria, which accounted for about 58.4% of all bacteria at the end of shelf life at 4 ℃. Pseudomonas which were common spoilage bacteria in aquatic products included Pseudomonas fluorescens, Pseudomonas taetrolens and Pseudomonas marginalis,with a corresponding proportion of 63.2%, 29.2% and 7.6%, respectively. Two types of egg yolk antibodies (IgY) against Shewanella putrefaciens, Pseudomonas fluorescens and Pseudomonas taetrolens were obtained by immunizing leghorn chicken by two methods, and their antibacterial efficiencies in liquid and solid media were evaluated. After incubation for 8 h in liquid culture, the inhibition ratio of the two IgYs at 100 mg/mL against antigen bacteria could attain between 61% and 78%, and after incubation for 24 h in solid culture, the inhibition ratio could reached between 27% and 40%. This demonstrates the potential application of egg yolk antibody as a natural antimicrobial agent for preservation and bacteria inhibition.
Paralichthys olivaceus;dominated spoilage organisms;Shewanella putrefaciens;Pseudomonas;Egg yolk immunoglobulin;antimicrobial activity
TS254. 4
A
1002-6630(2010)23-0109-05
2010-09-17
国家自然科学基金项目(30972288);国家现代农业(鲆鲽类)产业技术体系项目(nycytx-50-G09)
胥亚夫(1985—),女,硕士研究生,研究方向为水产品质量安全。E-mail:fayalisa@163.com
*通信作者:曹立民(1972—),男,副教授,博士,研究方向为水产品质量安全。E-mail:caolimin@ouc.edu.cn

