胆固醇氧化酶高产菌株的筛选及鉴定
蔡 丹,张娜娜,刘景圣*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
胆固醇氧化酶高产菌株的筛选及鉴定
蔡 丹,张娜娜,刘景圣*
(吉林农业大学食品科学与工程学院,吉林 长春 130118)
将从不同地点采集到的9个样品进行分离筛选,从中分离到23株以胆固醇为唯一碳源的菌株,确定其中1株胞外胆固醇氧化酶高产菌株A3,其胆固醇氧化酶的活力为525U/L。经过形态学和生理生化实验初步鉴定,该菌株属于短杆菌属(Brevibacterium sp.)。
胆固醇氧化酶;菌株;筛选
胆固醇(cholesterol)又叫胆甾醇,是机体内重要的固醇类物质,具有多种多样的生理功能,它是细胞膜的组成部分,与膜的通透性及神经传导密切相关,它也是类固醇激素、VD、胆汁酸等的前体物质,同时参与机体免疫系统。所以,胆固醇是人类维持正常生理活动所必需的营养物质,具有重要的生理功能[1-2]。但是血清中胆固醇含量过高也会影响人类的健康,目前因胆固醇过高而引起的动脉粥样硬化、冠心病、脑中风等心脑血管疾病已严重威胁人体健康。为了避免人体从饮食中摄取过多的胆固醇,采用合适的加工技术降低食品中的胆固醇含量是解决这一问题的有效途径。采用生物学方法尤其是利用微生物产生的胆固醇氧化酶分解食品中的胆固醇成为一种比较经济而有效的降低食品中胆固醇的方法[3-5]。胆固醇氧化酶(cholesterol ox idase,EC1.1.3.6,COD)作为胆固醇代谢途径第一步反应的关键酶,能专一性地催化胆固醇生成胆甾-4-烯-3-酮和H2O2,在食品加工领域具有良好的应用价值[6-9]。
本实验主要研究胆固醇氧化酶高产菌株的筛选及鉴定,以期丰富胆固醇氧化酶的菌种资源,为胆固醇氧化酶的工业化应用提供可靠的参考。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
样品:分别从双阳油田、吉林金翼蛋品有限公司、吉林省阿满食品有限公司等处采集土样样品,记录好采集地点、时间及天气条件等。
胆固醇标品、辣根过氧化物酶、Triton X-100 北京鼎国生物技术有限公司;4-氨基-安替比林 国药集团化学试剂有限公司;叠氮钠、苯酚、过氧化氢、异丙醇、磷酸二氢钾、磷酸氢二钾等均为国产分析纯。
1.1.2 培养基
基础培养基:牛肉膏3g、蛋白胨10g、NaCl 5g、蒸馏水1L,pH 7.5,121℃灭菌20min;选择培养基:胆固醇2g、NH4NO30.2g、NaCl 1g、KH2PO41.6g、Triton X-100 3 mL、琼脂 20 g、蒸馏水 1L,pH7.5,121℃灭菌20min;发酵培养基:胆固醇1g、葡萄糖 5g、
酵母粉 6g、CH3COONH42g、K2HPO40.2g、MgSO4· 7H2O 0.05g、NaCl 1g、FeSO4·7H2O 0.01g、 Triton X-100 3mL、蒸馏水1L, pH7.5,121℃灭菌20min;菌种鉴定培养基:1)葡萄糖发酵培养基:葡萄糖5g、牛肉膏5g、蛋白胨10g、NaCl 3g、Na2HPO4·12H2O 2g、加入0.2%溴麝香草酚蓝溶液使其体积分数为1.2%、蒸馏水1L,pH7.0,121℃灭菌20min;2)甲基红实验培养基:蛋白胨5g、葡萄糖5g、K2HPO45g、蒸馏水1L,pH 7.0,121℃灭菌20min;3)柠檬酸盐实验培养基:柠檬酸钠5g、NaCl 5g、MgSO4·7H2O 0.2g、(NH4)H2PO41g、K2HPO41g、琼脂20g、蒸馏水1L,0.2%溴麝香草酚蓝溶液40mL,pH 7.0,121℃灭菌20min;4)明胶液化实验培养基:明胶120g、蛋白胨5g、牛肉膏3g、蒸馏水1L,pH6.8~7.0,121℃灭菌10min;5)淀粉水解实验培养基:蛋白胨10g、NaCl 5 g、牛肉膏3g、可溶性淀粉2g,pH7.2,121℃灭菌20min;6)硝酸盐还原实验培养基:KNO30.2g、蛋白胨5g、牛肉膏3g、蒸馏水1L,pH7.4,121℃灭菌20min;7)硫化氢产生实验培养基:牛肉膏3g、酵母浸粉3g、蛋白胨10g、FeSO4· 7H2O 0.2g、Na2S2O30.3g、NaCl 5g、琼脂12g、蒸馏水1L,pH7.4,121℃灭菌20min;8)纤维素水解实验培养基:K2HPO42.0g、NH4NO32.0g、MgSO4·7H2O 0.2g、酵母膏5.0g、纤维素20.0g、pH7.2,121℃灭菌20min;9)V-P实验培养基:蛋白胨5g、葡萄糖5g、K2HPO45g、蒸馏水1L,pH7.0,121℃灭菌20min。
1.2 仪器与设备
JNOEC-XS-402型实验室生物显微镜 江南光电(集团)股份有限公司;HD-1630超净工作台 北京东联哈尔仪器制造有限公司;YXQ-SG41-280压力蒸汽灭菌器 上海华线医用核子仪器有限公司;PHS-3C精密pH计 上海雷磁仪器厂;TDA-8002水浴锅 余姚市东方电工仪器厂;HPX-9162MBE数显电热培养箱 上海博讯实业有限公司;AUY220EXP电子天平 北京塞多利斯有限公司;UT-1810紫外分光光光度计 北京普析通用仪器有限责任公司;LG10-2.4A离心机 湖南星科科学仪器公司;HZQ-F160全温振荡培养箱 哈尔滨市东明医疗仪器厂。
1.3 产胆固醇氧化酶菌株的分离筛选
1.3.1 初筛
称取样品各1g,分别加入盛有玻璃珠和100mL无菌生理盐水的三角瓶中,振荡20min后,以10%的接种量接入100mL基础培养基中,37℃、200r/min摇床培养24h。然后将培养液进行梯度稀释,选取合适的3个梯度,分别为10-4、10-5、10-6涂筛选平板,于37℃倒置培养24h后,挑取不同菌落形态的菌株进行平板划线分离,得到单菌落,转接到斜面培养基,4℃保藏。
1.3.2 复筛
将斜面种子挑取一环接入发酵培养基中,37℃、200r/min摇床培养48h。吸取5mL发酵液进行离心(4000r/min,20min),分别测上清液的酶活力。
1.3.3 胆固醇氧化酶酶活力的测定
采用过氧化氢比色法[10]。在酶的催化过程中,氧化1mol胆固醇可产生1mol过氧化氢,过氧化氢在过氧化物酶的作用下,可使4-氨基-安替比林与苯酚形成亚醌类红色的化合物,在波长500nm处有最大吸收峰,通过测量胆固醇被氧化的量,从而计算出胆固醇氧化酶酶活力。
1.3.3.1 标准曲线的绘制
分别取溶液B(每升溶液B中含4-氨基-安替比林1mmol,苯酚6mmol,pH7.5磷酸钾缓冲液25mmol,叠氮钠0.2g,辣根过氧化物酶6000U)3mL于6支试管中,37℃保温3min;每份分别加入2.584mmol/L的过氧化氢0、50、100、150、200、250μL,反应5min,于波长500nm处测定其吸光度。以过氧化氢浓度为纵坐标,吸光度为横坐标绘制标准曲线。
1.3.3.2 胆固醇氧化酶酶活力的测定
取溶液B(每升溶液B中含4-氨基-安替比林1mmol,苯酚6mmol,pH7.5磷酸钾缓冲液25mmol,叠氮钠0.2g,辣根过氧化物酶6000U)3mL,溶液D[溶液D为胆固醇-异丙醇溶液(含Triton X-100,4.26%)0.826%]150μL于试管中,37℃保温3min,加入50μL发酵上清液,准确反应5min,于沸水中加热3min,冷却后,在波长500nm处测吸光度。用标准曲线计算胆固醇氧化酶酶活力。
1.4 高产菌株的确定及菌种鉴定
1.4.1 高产菌株的确定
用过氧化氢比色法测定样品中胆固醇氧化酶酶活力后,选取高产菌株为目标菌株。
1.4.2 高产菌株的鉴定
1.4.2.1 形态鉴定
采用革兰氏染色法,用显微镜观察培养24h菌体细胞的形态。
1.4.2.2 生理生化实验法鉴定
按照《微生物学实验技术》[11]、《常见细菌系统鉴定手册》[12]及《伯杰氏细菌鉴定手册》[13]的方法,对待测菌株分别进行葡萄糖发酵实验、甲基红实验、柠檬酸盐实验、接触酶实验、明胶液化实验、淀粉水解实验、硝酸盐还原实验和硫化氢产生实验,记录实验结果。

表1 菌株生理生化实验结果Table 1 Physiological and biochemical experimental results
2 结果与分析
2.1 产胆固醇氧化酶菌株的分离筛选
2.1.1 初筛
用以胆固醇为单一碳源的筛选平板进行分离,得到不同形态的菌株23株,选择培养基平板生长状态见图1。

图1 选择培养基平板Fig.1 Selection of culture medium
2.1.2 复筛
将23株初筛菌株接入发酵培养基中,37℃,200r/min摇床培养48h,离心,分别测上清液酶活力。得到8株上清液酶活力相对较高的菌株,确定这8株菌株可产胞外胆固醇氧化酶,其中菌株A3酶活力可达525U/L。所以确定菌株A3为本实验的目标菌株。
2.2 胆固醇氧化酶酶活力的测定
以过氧化氢浓度为纵坐标,A500nm为横坐标,绘制过氧化氢标准曲线如图2。

图2 过氧化氢浓度标准曲线Fig.2 Standard curve of hydrogen peroxide
胆固醇氧化酶酶活力定义为:在37℃,pH7.5,1min内,催化1μmol胆固醇氧化为胆甾-4-烯-3-酮所需的酶。根据酶活力定义和过氧化氢浓度标准曲线方程,可以得出酶活力的计算公式为:
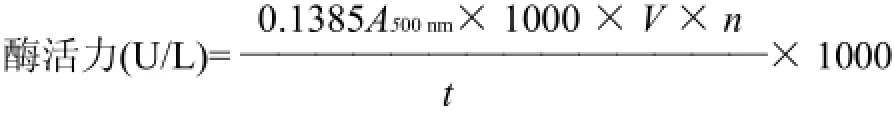
式中:A500nm为反应液吸光度;V为反应液体积/ mL;n为酶液稀释倍数;t为反应时间/min。
2.3 高产菌株的确定及菌种鉴定
2.3.1 形态鉴定
将菌株A3在固体基础培养基上,37℃培养24h,菌落呈乳白色,表面有光泽,扁平,圆形边缘整齐。用显微镜观察培养24h菌体细胞的形态,菌体细胞呈杆状,形状规则,无分枝,经革兰氏染色检验,菌体呈蓝紫色,确定为革兰氏阳性菌,见图3。

图3 菌株A3菌落形态及革兰氏染色图片Fig.3 Strain A3 colonies and Gram staining
2.3.2 生理生化实验鉴定
对待测菌株分别进行葡萄糖发酵实验、甲基红实验、柠檬酸盐实验等生理生化鉴定实验后,其各项生理生化特征见表1。根据实验结果,并参照《伯杰氏细菌鉴定手册》[13],初步确定该菌株属于短杆菌属(Brevibacterium sp.)。
3 结 论
本实验从被油脂污染的自然环境中采集到9个样品,从中分离得到23株以胆固醇为唯一碳源的菌株,并通过复筛得到1株胞外高产胆固醇氧化酶菌株A3,其胆固醇氧化酶的活力可达到525U/L。经过形态学和生理生化实验的初步鉴定,该菌株属于短杆菌属(Brevibacterium sp.)。
[1]郑建仙. 功能性食品∶ 第三卷 [M]. 北京∶ 中国轻工业出版社, 1999∶414-415.
[2]牛天贵, 吕莹, 蔡同一, 等. 降解食品中胆固醇的芽胞杆菌T12-1的筛选与应用研究[J]. 中国农业大学学报, 2001, 6(1)∶ 74-78.
[3]张佳程, 王世龙. 超临界萃取法与环糊精法脱除蛋黄中胆固醇效果的比较[J]. 食品工业科技, 2000(5)∶ 34-35.
[4]张佳程, 骆承庠. 生物方法降低食品中胆固醇的研究趋势[J]. 食品
科学, 1997, 18(11)∶ 50-53.
[5]江正强, 沈再春, 阎巧娟. 用胆固醇氧化酶脱除猪油中的胆固醇[J].中国农业大学学报, 1996, 1(2)∶ 100-103.
[6]SOMOKUTI G A, DANIEL K Y, SOLIMAN D K, et al. Expression of Streptomyces sp. cholesterol oxidase in Lactobacillus casei[J]. Applied Microbiology Biotechnology, 1992, 37∶ 330-334.
[7]PARK M S, KWON B, SHIM J J, et al. Heterologous expression of cholesterol oxidase in Bifidobacterium longum under the control of 16S rRNA gene promoter of bifidobacteria.[J]. Biotechnology Letters, 2008, 30(1)∶ 165-172.
[8]吕陈峰, 王龙刚, 杨胜利, 等. 胆固醇氧化酶转化蛋黄胆固醇工艺的优化[J]. 无锡轻工大学学报, 2001, 20(6)∶ 555-559.
[9]LUChenfeng, TANG Yixin, WANG Longgang, et al. Bioconversion of yolk cholesterol by extracellular cholesterol oxidase from Brevibacterium sp.[J]. Food Chemistry, 2002, 77(4)∶ 457-463.
[10]季文明, 陈毅力, 王武. 比色法测定胆固醇氧化酶酶活[J]. 无锡轻工大学学报, 2000, 19(3)∶ 251-254.
[11]杜连祥, 路福平, 王素英, 等. 微生物学实验技术[M]. 北京∶ 中国轻工业出版社, 2006.
[12]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 2版. 北京∶ 科学出版社, 2001.
[13]布坎南 R E, 吉本斯N E. 伯杰氏细菌鉴定手册[M]. 8版. 北京∶ 科学出版社, 1984.
Screening and Identification of Cholesterol Oxidase-producing Strains with High Activity
CAI Dan,ZHANG Na-na,LIU Jing-sheng*
(College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Twenty-three strains using cholesterol as the sole carbon source were isolated from nine samples collected from different locations. One strain with high yield of extracellular cholesterol oxidase was screened and named as strain A3. The highest activity of cholesterol oxidase was 525 U/L. The strain A3 was identified as Brevibacterium sp. through analyzing its morphology, physiological and biochemical characteristics.
cholesterol oxidase;strain;screening
Q93.331
A
1002-6630(2010)09-0202-04
2009-12-30
吉林农业大学青年启动基金项目(2007027)
蔡丹(1980—),女,讲师,博士研究生,研究方向为乳品科学与功能性食品开发。E-mail:infinite_cd@yahoo.cn
*通信作者:刘景圣(1964—),男,教授,博士,研究方向为乳品科学与功能性食品开发。E-mail:liujs1007@vip.sina.com.cn

