红曲霉合生素对延边黄牛瘤胃内环境的影响
丛明柱 张 敏
近年来,国内外掀起了利用红曲开发保健食品的热潮,对红曲霉中功能因子的分子结构和安全性等方面展开了广泛而深入的研究。红曲霉制剂被广泛应用于食品着色上。红曲霉与中药合生素在动物生产上的研究报道很少,特别是对反刍动物瘤胃内环境影响的报道更少。本试验使用的健胃中药含有机酸,能提供瘤胃微生物代谢所需的中间产物,能调节胃肠内的pH值,防止有害细菌的繁殖。红曲霉中含多种活性酶和可提供瘤胃微生物扩繁的活性肽,可促进瘤胃内氨氮的吸收利用。本文旨在研究红曲霉与中药合生素对延边黄牛瘤胃内环境的影响,为开发育肥牛新型饲料添加剂奠定基础。
1 材料与方法
1.1 红曲霉湿粉的制作
将蒸熟的大米装入平皿内,约0.5~0.7 cm,高压灭菌25 min,同时用一只三角瓶内装0.2%的冰乙酸溶液少许,装入大米的平皿冷却后取斜面试管中紫色红曲霉(M.purpureus)5~8 次注入到 10~20 ml的 0.2%的冰乙酸溶液中,取1 ml接入到大米培养基内,于32℃的培养箱内培养10~14 d。
烘干:将培养好的红曲霉湿料摊入容器内,放入55℃的烘箱内,干燥12~14 h即可,然后粉碎制成粉状。
1.2 红曲霉+中药合生素的制备
将山药、神曲、山楂、红枣和红曲霉菌块分别粉碎,采用实验室内的微量混合机混合均匀备用。
1.3 试验动物
本试验在延边大学农学院教学牧场完成。选择6头25月龄左右、健康、体重相近[(325±25)kg]、体况良好、安装永久性瘤胃瘘管的延边黄牛母牛。
1.4 饲养管理
所有供试牛在试验前驱除体内、体外寄生虫,并且口服健胃散健胃。每天分两次饲喂(8:00和16:00),自由饮水,常规光照。饲喂前将精料与粗料混合均匀。每次饲喂后,清扫牛舍,保持牛体表的清洁,保证牛有清洁、干净的饮水和休息环境。牛入舍前,舍内及器具均彻底消毒。预饲期让牛逐渐适应新的环境和饲养管理方式,在此期间精料的喂量由少到多。试验中经常刷拭牛体,保持牛体清洁,被毛柔顺。定期放开运动。
1.5 试验设计
采用3×3完全拉丁方设计。基础日粮饲喂量由精料补充料、玉米青贮料组成,日粮精粗比为36:64。试验分为A、B、C三组。每组基础日粮组成一致,首先A组饲喂基础日粮,B组饲喂基础日粮加0.5%红曲霉,C组饲喂基础日粮加红曲霉+中药合生素制剂0.5%轮换饲喂。精料组成及营养水平见表1。
1.6 瘤胃液的采集与处理
试验分三期,每期12 d,每期试验第10 d于早晨8:00饲喂前采集瘤胃液作为0 h样品进行分析,同时按饲喂后每隔3 h采集一次,即3、6、9 h分别采集样品。从瘤胃前、中、后部位采样,尽量使采样均匀。各时间点分别采集瘤胃液300 ml,在测定各项指标前于-25℃保存。
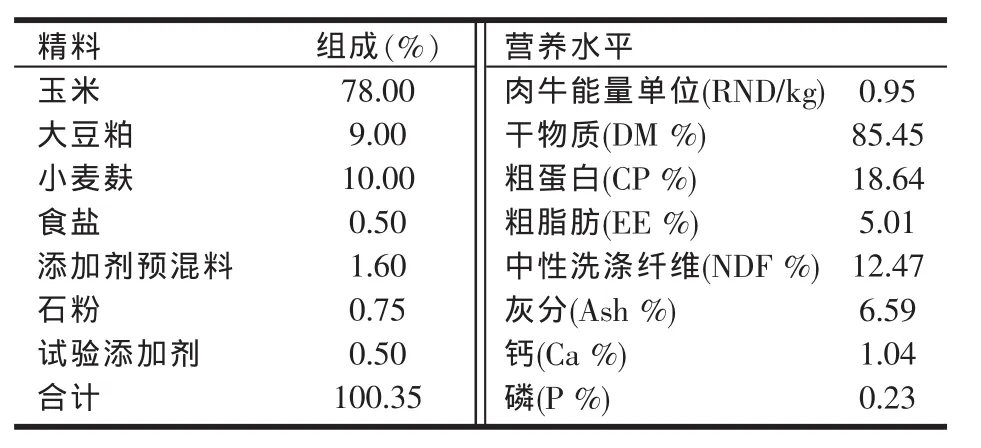
表1 供试牛日粮精料组成及营养水平
1.7 测定项目与方法
1.7.1 pH值的测定
采样后,四层纱布过滤,用PHS-3C型酸度计(萧山市分析仪器厂,复合电极)直接测定。
1.7.2 瘤胃原虫计数
将瘤胃液用2层医用纱布过滤后,立即用移液枪取1 ml瘤胃液置于试管(避光,锡箔包裹)中,加4 ml MFS染色液(35%福尔马林100 ml,氯化钠8.0 g,甲基绿0.6 g,混合后定容至1000 ml),即将样品稀释5倍,摇匀,静置30 min以上,用吸管(管口径大于1 mm)将摇匀的样品稀释液以连续不断的液流充满血球计数板的计数室,盖上盖玻片,于光学显微镜下观察(5×40)。计算公式:
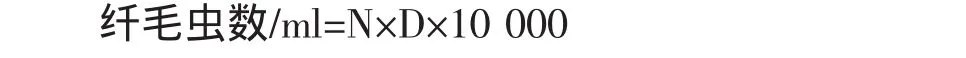
式中:N——所有方格中纤毛虫的总数;
D——稀释倍数;
10000——0.1 mm3换算为1 ml时的倍数。
1.7.3 NH3-N 的测定
将瘤胃液在3000 r/min离心15 min,取上层液1 ml保存在1.5 ml的微型离心管内,然后放于-20℃冰箱内冷冻保存。根据Chaney等(1962)的方法,利用分光光度计在630 nm下测定吸光度后计算。
1.7.4 菌体蛋白(BCP)的测定
菌体蛋白测定参照Cotta等(1982)和Broderick等(1989)阐述的差速离心法进行。瘤胃液经两层纱布过滤后,取30 ml经四层纱布过滤的瘤胃液于50 ml离心管中,低速1000 r/min离心10 min去除原虫和饲料大颗粒,之后准确量取20 ml装于高速离心管中4℃下13000 r/min离心20 min,以分离出细菌,弃上清液,用0.9%的氯化钠溶液洗涤,再13000 r/min离心20 min,弃掉上清液,重复2次。弃上清液后,借助玻璃棒小心无损地将高速离心的细菌沉淀转移到消化管中,用凯氏定氮法测定BCP的含量。
1.8 数据处理
试验数据应用SPSS 11.5统计软件进行差异分析,数据结果以平均数±标准差表示。
2 结果与分析
2.1 饲喂红曲霉+中药合生素对瘤胃内pH值的影响(见表 2、图 1)
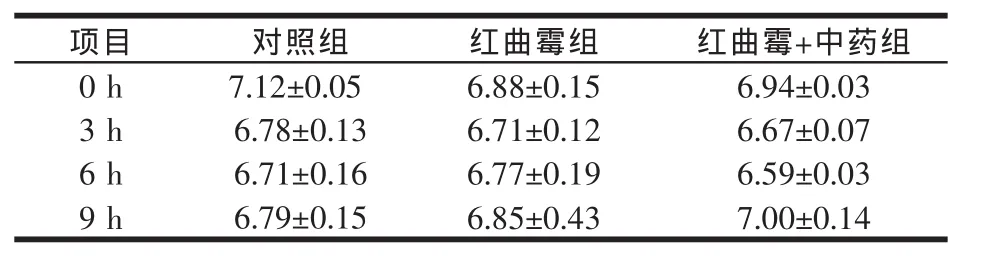
表2 瘤胃液pH值的变化

图1 饲喂红曲霉+中药合生素对瘤胃pH值的影响
各试验组的 pH值在 6.59~7.12,Kopecny和 Wallace(1982)建议适合瘤胃微生物蛋白水解酶活性作用的pH值为5.6~7.5,属于正常变动范围内。而且从采食后各时间点与平均值可见各试验组间差异不显著(P>0.05)。
2.2 饲喂红曲霉+中药合生素对瘤胃内NH3-N浓度的影响(见表3、图2)

表3 NH3-N 浓度的变化(mg/100 ml)
从表3、图2可以看出,试验中各组氨态氮浓度呈先上升后下降后略有回升的趋势,浓度变化范围为9.34~14.20 mg/100 ml。Slyter(1979)认为,NH3-N浓度最佳范围是0.35~29 mg/100 ml,这表明牛瘤胃内NH3-N浓度均处于合成瘤胃微生物的最佳浓度范围内。从表3可以看出,NH3-N浓度红曲霉+中药组在3、6、9 h 与对照组相比差异显著(P<0.05),红曲霉组在 6、9 h与对照组相比差异显著(P<0.05),都高于对照组,分别高出 10.76%、40.47%、12.17%,38.22%、26.16%。

图2 饲喂红曲霉+中药合生素对瘤胃NH3-N浓度的影响
2.3 饲喂红曲霉+中药合生素对瘤胃内纤毛虫数量的影响(见表 4、图 3)

表4 瘤胃液中纤毛虫数量的变化(×105个/ml)

图3 饲喂红曲霉+中药合生素对瘤胃内纤毛虫数量的影响
由表4可知,对照组、红曲霉组和红曲霉+中药组在采食3 h后纤毛虫数量有下降的趋势,至采食6 h后开始逐渐回升。这可能是由于此时瘤胃pH值逐渐降低,瘤胃内环境的变化引起所致。其中6 h时红曲霉+中药组与对照组、红曲霉组相比分别低25.66%、18.74%,差异显著(P<0.05)。其它时间差异不显著。
2.4 饲喂红曲霉+中药合生素对瘤胃微生物蛋白质合成量的影响(见表5、图4)

表5 BCP浓度的变化(mg/100 ml)

图4 饲喂红曲霉+中药合生素对瘤胃内微生物蛋白质(BCP)合成量的影响
由图4可见,饲喂后各组BCP含量均呈先上升后下降的趋势。从表5可以看出饲喂后3 h红曲霉组和红曲霉+中药组与对照组差异显著(P<0.05)。6~9 h红曲霉+中药组与其它两组差异显著(P<0.05)。而红曲霉+中药组在饲喂6、9 h内的值显著高于其它两组(P<0.05)。分别高出 16.30%、10.16%;12.17%、8.27%。其变化范围在18.69~24.20 mg/100 ml。
3 讨论
3.1 饲喂红曲霉+中药合生素对瘤胃pH值的影响
pH值是反映瘤胃发酵水平的一项重要指标,综合反映瘤胃微生物、代谢产物有机酸产生、吸收、排出及综合状况。它直接受唾液分泌、挥发性脂肪酸及其它有机酸生成、吸收和排出等因素的影响,引起瘤胃pH值波动的根本原因则是日粮结构和日粮营养(Reddy,1987)。韩正康和Murphy等指出,瘤胃内pH值有规律的变动,取决于饲粮性质和摄食时间,一般饲喂后2~6 h达到最低值。本试验中试验组pH值随时间的变化趋势大致与此相同。各试验组的pH值在6.59~7.12,Kopecny 和 Wallace(1982)建议适合瘤胃微生物蛋白水解酶活性作用的pH值为5.6~7.5。本试验中。各组pH值变化规律与预期相同,且在正常范围内,对照组和试验组不同时间点pH值变化均不显著,说明饲喂红曲霉+中药合生素不影响瘤胃pH值。
3.2 饲喂红曲霉+中药合生素对瘤胃NH3-N浓度的影响
NH3-N浓度在一定程度上反映了瘤胃微生物分解含氮物质产生NH3的速度及其对NH3的摄取利用情况,反映了在特定日粮组成下,蛋白质降解与合成之间所达到的平衡(McDonald,1988)。Slyter(1979)认为,NH3-N 浓度最佳范围是 0.35~29 mg/100 ml。从表3可以看出,试验中NH3-N浓度变化范围为9.34~14.20 mg/100 ml,这表明牛瘤胃内NH3-N浓度均处于合成瘤胃微生物的最佳浓度范围内。红曲霉+中药组在 3、6、9 h,红曲霉组在 6、9 h NH3-N 浓度都显著高于对照组。这是因为:随着进食,红曲霉+中药组为微生物提供了必要的营养,饲料蛋白分解加快,使其NH3-N浓度略高,但随着氨在瘤胃内被微生物利用和瘤胃壁吸收,浓度逐渐下降,到达9 h后又趋于平衡状态。这与Okeke等(1983)得出的结果相同。
3.3 饲喂红曲霉+中药合生素对瘤胃内纤毛虫数量的影响
原虫在反刍动物的营养代谢方面占据很重要的位置,它是瘤胃微生物区系不可或缺的正常组分。瘤胃纤毛虫的种类和种群数量依据宿主的饲喂条件、生理等因素的变化而发生变化,因此,根据这种变化,可将其作为衡量瘤胃环境状况的一个指标。本试验可以看出对照组、红曲霉组和红曲霉+中药组在采食3 h后有下降的趋势,至下次饲喂前回升。这可能是由于此时瘤胃pH值逐渐降低,瘤胃内环境的变化引起所致。其中6 h时红曲霉+中药组与对照组、红曲霉组相比差异显著(P<0.05)。红曲霉+中药组略低于红曲霉和对照组(P<0.05)。其它时间差异不显著。
3.4 饲喂红曲霉+中药合生素对瘤胃内微生物蛋白质(BCP)合成量的影响
BCP主要是由细菌利用饲料中的蛋白质分解产生的NH3作为氮源,利用碳水化合物发酵产生的挥发性脂肪酸作为能源而合成的。因此BCP合成的数量间接反映了细菌的活性及数量。本试验中可见,饲喂后3 h红曲霉组和红曲霉+中药组与对照组BCP差异显著(P<0.05);6~9 h红曲霉+中药组与其它两组差异显著(P<0.05)。其变化范围在 18.69~24.20 mg/100 ml。在各处理组中,中药+红曲霉组BCP水平普遍较高,说明细菌充分利用氨合成了BCP。Jounay等(1999)报道由于对纤毛虫的抑制作用,导致瘤胃细菌利用氨合成菌体蛋白的能力增强。红曲霉+中药组对纤毛虫有轻微的抑制作用,这也是导致瘤胃细菌利用氨合成菌体蛋白的量增加的原因之一。
4 结论
红曲霉+中药组可以改善瘤胃的内环境,具有明显促进菌体蛋白合成、抑制纤毛虫生长的作用,提高其对饲料营养物质的利用率。
[1]Chaney A L,Marbach E P.Modified reagents for determination of urea and ammonia[J].Clinical Chem.,1962(8):130-132.
[2]Cotta M A,Russell J B.Effect of peptides and amino acids on eficiency of rumen bacterial protein synthesis in continuous culture[J].J.Dairy Sci.,1982,65:226-234.
[3]Broderick G A,Craig W M.Metabolism of peptides and amino acids during in vitro protein degradation by mixed rklmen organisms[J].J.Dairy Sci.,1989,72:2540-2548.
[4]Kopecny J,Wallace.Cellular location and some properties of proteolytic enzymes of rumen bacteria[J].Appl.Environ.Microbiol,1982,43:1026-1033.
[5]刘亚力,幺红霞,杨建策.绿色饲料添加剂的研究和应用[J].饲料博览.2001,(6):22-26.
[6]Slyter L L.Monensin and dichloroacetamide influences on methane and volatile fatty acid production by rumen bacteria in vitro[J].Appl.Environ.Microbiol.,1979,37:283-288.
[7]Reddy K J,Reddy M R.Effects of feeding various nitrogen fractions and total VFA in the rumen fluid of sheep[J].Joumal of Animal Science,1993,55(9):81.
[8]韩正康,陈杰.反刍动物瘤胃消化和代谢[M].北京:科学出版社,1988:25.
[9]Murphy J J,Kennelly J J.Effect of protein concentrate and protein source on the degradability of dry matter and protein in situ[J].J.Dairy Sci.,1987,70:1841~1849.
[10]Okeke G C,Buchanan J G,Grovum W L.Efect of bufers on luminal rate of passage and degradation from the lumen[J].J.Anim.Sci.,1983,56:1393.
[11]Jounay J,K.Pushida.The role of protozoa in feed digestion[J].J.Review.AJAS.1999,12:113-128.
[12]贾娟,张军.红曲霉菌的应用研究[J].农产品加工·学刊,2005,30(1):25-28.
[13]纪远中.红曲及红曲霉的研究现状及进展[J].天津药学,2005,17(2):65-67.
[14]Endo A-Monacolin K.Anew hypocholesteroiemic agent produced by Monascus species[J].J.Antibiotics,1979,32(8):852-854.
[15]冯仰廉,等.反刍动物营养学[M].北京:科学出版社,2004.

