牙周膜干细胞向脂肪细胞方向定向诱导分化实验
贺慧霞 刘洪臣 王东胜 曹均凯 张海钟 鄂玲玲
(中国人民解放军总医院 口腔医学研究所,北京 100853)
牙周膜干细胞向脂肪细胞方向定向诱导分化实验
贺慧霞 刘洪臣 王东胜 曹均凯 张海钟 鄂玲玲
(中国人民解放军总医院 口腔医学研究所,北京 100853)
目的 探讨人牙周膜干细胞(PDLSCs)向脂肪细胞定向分化潜能,分析其分化过程中形态与功能变化。方法 免疫磁珠法分离人PDLSCs,用成脂诱导液连续诱导21 d,通过倒置显微镜、透射电镜、流式细胞仪、RTPCR、Western blot及免疫荧光方法观察诱导细胞形态、结构变化,分析其表面脂肪细胞特异性标志——低密度脂蛋白(LPL)和过氧化物酶体增殖物受体γ(PPAR-γ)的基因及蛋白表达时相及表达量,油红O染色检测脂滴分泌情况。结果 诱导21 d,诱导细胞呈脂肪细胞样圆形细胞,超微结构观察可见胞浆中大量脂肪细胞特征性脂滴。流式分析结果显示,有96.54%的PDLSCs向脂肪细胞分化。诱导细胞表达脂肪细胞特异性表面标志LPL mRNA和PPAR-γ mRNA及PPAR-γ蛋白,且随诱导时间延长PPAR-γ蛋白表达量增加。诱导细胞产生油红O阳性染色的脂滴。结论人PDLSCs在适当条件下可定向分化为脂肪细胞样细胞,并具有脂肪细胞形态、结构和功能特点,具有可塑性。
牙周膜干细胞; 诱导; 分化; 脂肪细胞
牙周膜干细胞(periodontal ligament stem cells,PDLSCs)是牙周组织发育完成后存留于牙周膜中未分化的间充质细胞。与骨髓基质干细胞(bone marrow stromal stem cells,BMSCs)相似,PDLSCs不仅具有自我更新的能力,还具有在一定诱导条件下向脂肪、软骨、神经、肌肉等多个非来源组织的不同细胞分化的潜能。目前研究[1-2]已证实,BMSCs具有分化为包括骨、韧带、脂肪、软骨、肌肉在内的几乎所有组织细胞的潜能,并可向不同胚层的细胞类型分化,成为多种组织或器官组织工程的种子细胞。PDLSCs也具有多向分化潜能,但目前有关PDLSCs横向分化的报道较少。本研究从细胞、分子及基因水平探讨PDLSCs向脂肪细胞分化的潜能、特点和机制,以进一步认识PDLSCs的生物学特性,为从不同角度认识PDLSCs的特性,研究其分化机制提供依据。
1 材料和方法
1.1 主要试剂和仪器
LG-DMEM培养基、胎牛血清、L-谷氨酰胺(Gibco公司,美国),胰蛋白酶(Amresco公司,美国),Ⅰ型胶原酶(Sigma公司,美国),Dispase(Roche公司,美国),小鼠抗人STRO-1单克隆抗体(R&D公司,美国)。磁珠结合的抗小鼠IgM二抗(Dynal公司,挪威)。兔抗人过氧化物酶体增殖物受体γ(peroxisome proliferator activated receptor-γ,PPAR-γ)、油红O(Sigma公司,美国),罗丹红标记羊抗兔Ig G(中国博士德生物有限公司)。吲哚美辛、胰岛素、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)、地塞米松(Cyagen-Bioscience公司,美国)。TRizol(Promega公司,美国),Ribonuclease核酸酶抑制剂(Takara D2310A)、M-MLV反转录酶(Promega M170A)、Taq DNA合成酶(Takara公司,美国);cDNA第一链合成试剂盒、PCR Mastermix、Marker、EB染料(中国天根公司)。二氧化碳恒温孵箱(Thermo Forma公司,美国),IX70型倒置相差显微镜(Olympus公司,日本),磁力架(15mL,Dynal公司,挪威),流式细胞仪(BD Bioscience公司,美国),PCR检测系统(杭州博日科技有限公司),DYCP-31D型水平式电泳槽(北京六一仪器厂),紫外分光光度计UV-2000(Unico公司,美国)。
1.2 主要试剂配制
成脂诱导液A:基础培养基A、100mmol·L-1吲哚美辛、250 mmol·L-1IBMX、5mg·mL-1胰岛素、1mmol·L-1地塞米松、20%FBS。成脂诱导维持液B:基础培养基B、5mg·mL-1胰岛素。油红O复合染液:油红O干粉0.5 g,溶于100mL异丙醇,过滤后常温棕色瓶保存。
1.3 方法
1.3.1 细胞培养和分离 收集临床正畸拔除的、健康的前磨牙或阻生第三磨牙(15~29岁),参照Seo等[3]方法培养和分离PDLSCs。方法简述如下:无菌条件下,刮取根中1/3部牙周膜组织,剪碎,加入含3mg·mL-1Ⅰ型胶原和4mg·mL-1Dispase的消化液,37℃消化1 h,将细胞悬液通过70μm细胞筛网,用含20%胎牛血清的LG-DMEM培养基接种至培养瓶中,置37℃、含5%二氧化碳的孵箱中培养,3 d换液,细胞生长达80%汇合时传代,取第3代细胞用STRO-1免疫磁珠分选系统分离PDLSCs并鉴定[4]。
1.3.2 脂肪诱导 取磁珠分离的第2代PDLSCs,以每毫升2×104个密度接种于培养瓶内,培养3 d待细胞长到90%汇合后,换A液诱导3 d,然后换B液诱导1 d。按照3∶1方案,连续诱导21 d,每日镜下观察细胞生长及形态变化,以未诱导细胞为对照。
1.3.3 透射电镜观察 分别取诱导与未诱导细胞各约2×106个,1 200 r·min-1离心5min,以3%戊二醛固定2 h,再用1%四氧化锇固定2 h,经梯度丙酮脱水、环氧树脂浸透包埋、超薄切片、醋酸双氧铀和醋酸铅双重染色后,透射电镜观察、摄片。
1.3.4 RT-PCR检测 分别收集诱导和未诱导细胞各约2×106个,检测低密度脂蛋白(low density lipoprotein,LPL)mRNA、PPAR-γmRNA表达时相和丰度。引物设计LPL:上游:5′-GGGCATGTTGACATTTACCC-3′,下游:5′-AGCCCTTTCTCAAAGGCTTC-3′(NM_000237,预计产物大小221bp);PPAR-γ:上游:5′-TGAAACGAGTCAGCTGGATG-3′;下游:5′-TGAAATTCATGGCTGTGGAA-3′(NM_138711,162 bp);β-actin:上游:5′-TGACGTGGACATCCGCAAAG-3′,下游:5′-CTGGAAGGTGGACAGCGAGG-3′(NM_001101,205 bp)。
1.3.5 PPAR-γ免疫荧光染色 收集连续诱导21 d的细胞,制作细胞爬片,PBS洗涤3遍。5%牛血清白蛋白封闭20min,加入PPAR-γ一抗(工作浓度为1∶50),4℃孵育过夜,PBS洗3遍。避光条件下加入TRITC标记二抗,37℃孵育40min,PBS洗后甘油封片,激光共聚焦观察。PBS代替一抗做阴性对照。
1.3.6 Western blot半定量检测PPAR-γ蛋白表达收集未诱导和连续诱导21 d的细胞各约每毫升5×106个,常规方法加入RIPA裂解液于冰上进行蛋白提取。紫外分光光度仪做蛋白定量分析,SDS-PAGE凝胶电泳,PVDF膜在300 mA的恒流条件下转膜100min。再以5%脱脂奶粉4℃封闭过夜,加入兔抗人PPAR-γ抗体,同时加入β-actin作为内参对照。常温孵育4 h,TBS洗膜后,经辣根过氧化物酶标记的羊抗兔IgG孵育50min。最后将膜置于滤纸上,加入化学发光液,X线片显影、定影、摄片。
1.3.7 油红O染色 将连续诱导21 d的细胞弃诱导液,PBS洗2遍,10%甲醛固定10min。室温下油红O染色30min,弃染液,60%异丙醇洗2遍,蒸馏水洗2遍,苏木素核复染,镜下观察。
2 结果
2.1 细胞形态观察
与对照组比较(图1左),PDLSCs脂肪诱导7 d,细胞体积变大,突起变短或消失,呈圆形、卵圆形或短梭形,胞浆中开始出现高折光性的细小脂滴。随着诱导时间的延长,出现脂滴的细胞逐渐增多,成葡萄串状,细胞体积逐渐增大,胞内及细胞之间尚可见融合的脂滴(图1右)。
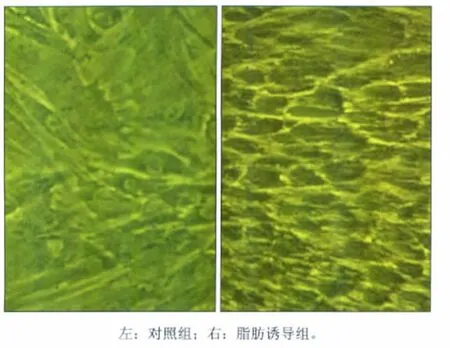
图1 PDLSCs对照组与脂肪诱导组细胞形态比较 倒置相差显微镜 ×200Fig 1 A comparison on cell morphology between control group and adipogenic induction group inverted phase contrast microscope ×200
2.2 透射电镜观察
与未诱导细胞比较(图2左),诱导细胞呈脂肪细胞的超微结构特点。表现为细胞体积显著增大,胞浆中充满了大小不等的脂滴,脂滴是无结构的膜被囊状小泡。胞浆内细胞器较少,被压向一边。胞核增大,核仁大而明显,异染色质较多,位于核膜内缘(图2右)。
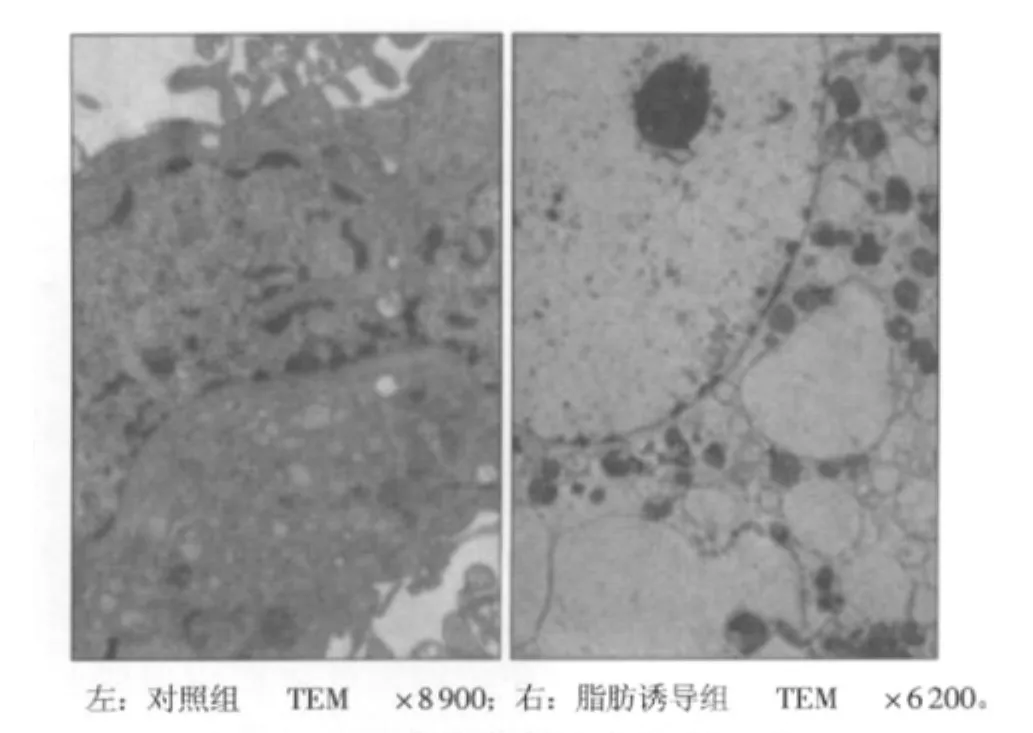
图2 对照组与脂肪诱导组超微结构比较Fig 2 Comparative study on cell ultrastructure between control group and induction group
2.3 RT-PCR检测
脂肪诱导21 d,诱导细胞均表达脂肪细胞特异性基因LPL和PPAR-γ的mRNA(图3),且LPLmRNA表达丰度高。对照组均不表达这2种基因。
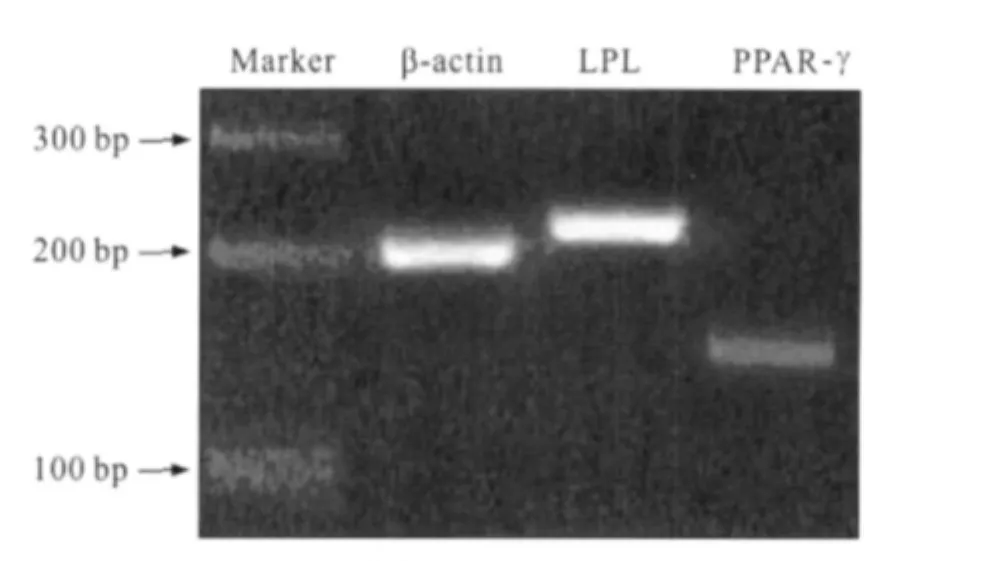
图3 脂肪诱导21 d,诱导细胞表达LPLmRNA和PPAR-γmRNAFig 3 After a 21-day-induction,the induced cells express LPL mRNA and PPAR-γmRNA
2.4 Western blot检测
诱导细胞中脂肪细胞数量增加,细胞表面特异性分子PPAR-γ表达量也增多,诱导21 d较14 d蛋白表达量显著增加(图4)。对照组则无PPAR-γ表达。
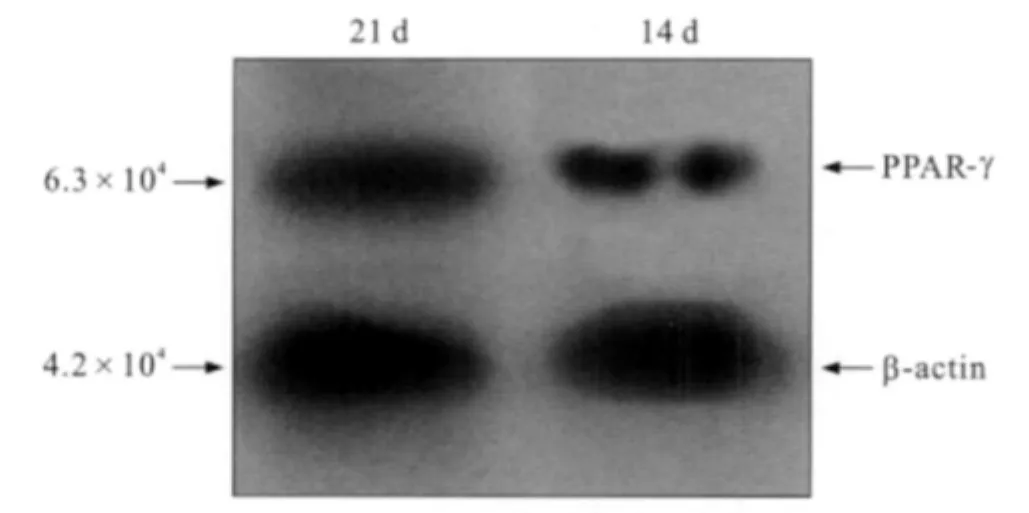
图4 脂肪诱导14、21 d,诱导细胞PPAR-γ蛋白表达量增加Fig 4 After induced by adipogenic medium for 14 d and 21 d,the induced cells increasingly express PPAR-γprotein
2.5 免疫荧光染色
大多数诱导细胞PPAR-γ抗体染色阳性,胞浆呈红色荧光,但荧光中等强度(图5),对照组无荧光显示。
2.6 油红O染色

图5 脂肪诱导细胞PPAR-γ抗体染色阳性 TRITC免疫荧光×400Fig 5 The induced cell stained positively with PPAR-γantibody TRITC immunofluorescence staining ×400
脂肪诱导21 d,诱导细胞内及细胞间有油红O特异性着色的脂滴形成,脂滴大小不等,呈红色,有的位于细胞内融合成串珠状,着色较浅;有的汇聚于细胞间成片状,着色较重(图6)。对照组无染色。
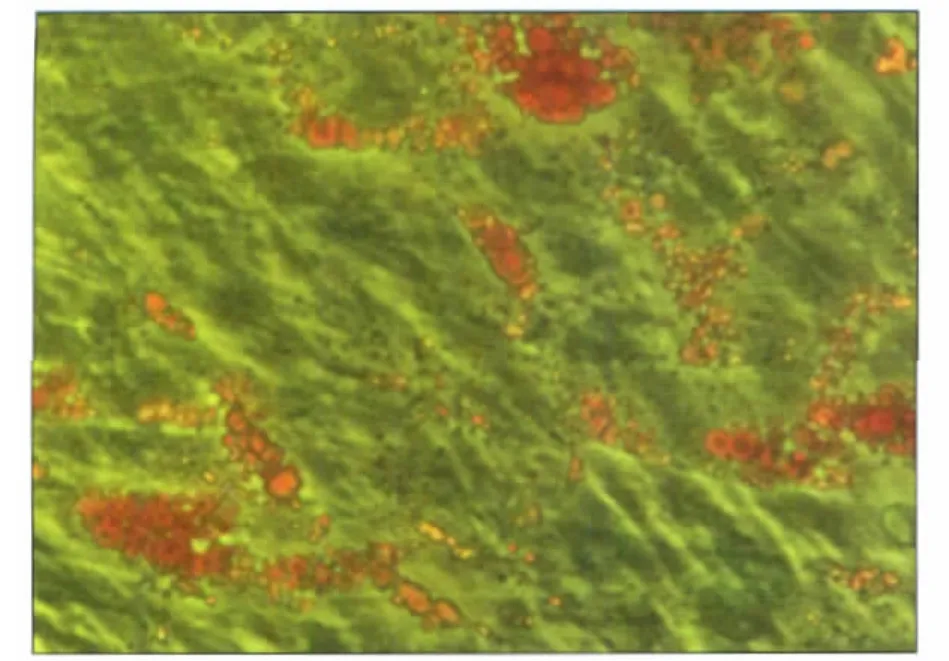
图6 脂肪诱导21 d,诱导细胞产生大量油红O染色的脂滴油红O染色 ×100Fig 6 After 21-day-induction,oil red O staining revealed the appearance of fat drops oil red O staining ×100
3 讨论
横向分化潜能被认为是干细胞的主要特性之一,也是鉴定干细胞的重要指标。生理状况下,牙周膜中没有脂肪组织,PDLSCs的形成细胞中也没有任何脂肪细胞,那么PDLSCs能否分化为功能性的脂肪细胞呢?本实验采用了地塞米松、胰岛素、吲哚美辛和IBMX联合诱导。其中地塞米松能激活核激素受体超家族成员糖皮质激素受体,诱导脂肪合成和转运相关基因启动表达的重要调控蛋白C/EBP的表达,同时降低脂肪细胞分化抑制因子pref-1的表达[5]。IBMX则通过抑制cAMP的降解,提高细胞内cAMP的水平,而cAMP是一种重要的脂肪诱导剂[6]。胰岛素与胰岛素受体-1(insulin receptor-1,IR-1)结合,能激活并调节ERK1/ERK2信号传导途径,通过降低核蛋白磷酸酶PPA的活性来调节CREB的磷酸化和转录活性。CREB的激活不仅促进C/EBP的表达,也增加PPAR-γ的表达[7]。PPAR-γ在脂肪细胞分化的早期表达,是脂肪细胞分化过程中必需的关键转录因子,激活后可促使BMSCs、PDLSCs等向脂肪细胞分化,其表达水平反映了脂肪细胞分化的活跃程度。地塞米松、胰岛素、IBMX和吲哚美辛这4种诱导剂联合应用诱导干细胞虽有文献报道[8],但用于PDLSCs成脂诱导研究极少,且诱导后细胞形态、功能变化研究尚未见报道。本实验采用此诱导方案,通过PPAR-γ流式细胞分析也证实其中有96.54%PDLSCs诱导分化为脂肪细胞,表明此方案是体外诱导PDLSCs向脂肪细胞方向分化有效途径。
PDLSCs脂肪诱导过程中,细胞形态、结构和功能均发生了显著变化。诱导7 d细胞形态开始由成纤维样梭形细胞变为短突起或多角形细胞,至21 d时细胞体积增大,胞内出现高折射率的脂滴,呈脂肪细胞样细胞表现。进一步通过透射电镜发现了特征性细胞内脂滴的形成,且细胞器较少。细胞形态变化常常伴随着功能的改变,通过RT-PCR基因分析检测到诱导细胞表达脂肪细胞特异性PPAR-γmRNA和LPLmRNA,而且免疫荧光和Western blot也显示,诱导细胞分泌功能性PPAR-γ蛋白,且具有时间依赖性,而且分泌大量油红O染色阳性的脂滴。这些研究均表明,诱导细胞具有脂肪细胞的形态、结构和功能,同时也表明PDLSCs具有横向分化潜能。
从细胞来源看,成熟的脂肪细胞经脂肪前体细胞诱导分化而来,而脂肪前体细胞又来源于中胚层中多能干细胞经逐步分化产生的间充质干细胞[9-10]。间充质干细胞是如何分化为脂肪细胞呢?目前对其分化的分子机制尚不十分明了,但对其中的一些重要环节研究有了新的进展。研究[11-12]发现,核激素受体家族成员PPAR-γ、转录因子家族成员C/EBP以及脂肪决定分化因子1是目前已鉴定出的、对脂肪细胞分化和脂肪生成起决定性作用的调控因子。各种信号分子形成网络调控模式,调节着细胞向脂肪细胞的分化。其中细胞内cAMP的水平起关键性作用,成脂诱导剂通过抑制cAMP的降解而提高胞内cAMP的水平,cAMP可通过激活cAMP反应元件结合蛋白来调控C/EBPa和C/EBPb表达,并进而促进脂肪细胞的产生[6]。而CREB的激活不仅可以促进C/EBP的表达,还能够增加PPAR-γ的表达。本实验结果表明诱导细胞21 d PPAR-γ表达量显著高于14 d的表达量,提示随诱导时间延长,可能有更多的PDLSCs分化为成熟的脂肪细胞。
PPAR-γ和LPL是成熟脂肪细胞的标志酶。PPAR-γ是过氧化物酶体增殖剂激活受体,属于Ⅱ型核激素受体超家族,是需要配体激活的一类核受体。PPAR-γ不仅能刺激前脂肪细胞分化为成熟脂肪细胞,使脂肪细胞的数目增加,而且与成熟脂肪细胞内脂肪形成密切相关,在脂肪细胞分化的早期起十分重要作用并促进细胞内脂质积聚[13]。LPL则是脂肪细胞分化晚期表达的蛋白,特异性表达于脂肪细胞膜表面,是成熟的脂肪细胞标志脂蛋白脂酶,参与脂质代谢[9,14]。这些研究表明PDLSCs脂肪诱导后细胞分化为成熟的、功能性脂肪细胞。国内韩劼等[15]曾报道对人牙周膜成纤维细胞进行脂肪诱导,通过透射电镜和油红O染色发现有脂滴形成,认为牙周膜细胞具有分化为脂肪细胞的潜能。实际上,牙周膜细胞是不同分化潜能和分化阶段的混合细胞群,而形成脂滴只是脂肪细胞的特征之一。本研究对经STRO-1免疫磁珠分离纯化的PDLSCs进行脂肪诱导,有96.54%的细胞分化为脂肪细胞,这些分化细胞具有成熟脂肪细胞的形态、结构和功能。这不仅表明PDLSCs具有横向分化潜能,也将为PDLSCs分化调控机制研究提供重要依据。另外,PDLSCs如此高效的成脂诱导潜能,有望成为修复软组织缺损及整形美容的可靠、简便的又一干细胞来源。
[1] Mauney JR,Volloch V,Kaplan DL.Role of adult mesenchymal stem cells in bone tissue-engineering applications:Current status and future prospects[J].Tissue Eng,2005,11(5/6):787-802.
[2] 王荣,孙正,刘华松.BMSC-HA/TCP修复牙槽骨缺损后牙齿移动的实验研究[J].中华老年口腔医学杂志,2008,6(1):35-37.
WANG Rong,SUN Zheng,LIU Hua-song.Tooth movement after restoration for alveolar bone defect with BMSC-HA/TCP scaffold [J].Chin JGeriatric Dent,2008,6(1):35-37.
[3] Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J]. Lancet,2004,364(9429):149-155.
[4] 贺慧霞,刘洪臣,王东胜,等.人与犬牙周膜干细胞的生长特性比较[J].口腔颌面修复学杂志,2009,10(2):65-68.
HE Hui-xia,LIU Hong-chen,WANG Dong-sheng,et al.Comparative study on the growth characteristics of periodontal ligament stem cells isolated from human and dog[J].Chin J Prosthodont,2009,10(2):65-68.
[5] Wu Z,Bucher NL,Farmer SR.Induction of peroxisome proliferator-activated receptor gamma during the conversion of 3T3 fibroblasts into adipocytes is mediated by C/EBPbeta,C/EBP delta,and glucocorticoids[J].Mol Cell Biol,1996,16(8):4128-4136.
[6] Klemm DJ,Roesler WJ,Boras T,et al.Insulin stimulates CAMP-response element binding protein activity in HepG2 and 3T3-L1 cell lines[J].J Biol Chem,1998,273(2):917-923.
[7] Hillel AT,Varghese S,Petsche J,et al.Embryonic germ cells are capable of adipogenic differentiation in vitro and in vivo[J]. Tissue Eng Part A,2009,15(3):479-486.
[8] 庄淑波,刘毅.大鼠骨髓间充质干细胞体外成脂分化能力的实验研究[J].中国美容医学,2006,15(11):1222-1224.
ZHUANG Shu-bo,LIU Yi.Experimental study on ratmesenchymal stem cells differentiation into adipocytes in vitro[J].Chin J Aesthetic Medicine,2006,15(11):1222-1224.
[9] Rosen ED,Walkey CJ,Puigserver P,et al.Transcriptional regulation of adipogenesis[J].Genes Dev,2000,14(11):1293-1307.
[10]周永胜,刘云松,周书敏,等.人脂肪基质细胞的分离、培养、增殖及传代稳定性[J].口腔颌面修复学杂志,2006,7(3):161-168.
ZHOU Yong-sheng,LIU Yun-song,ZHOU Shu-min,et al.Cultivation,proliferation and passage of human adipose tissue derived stromal cells in vitro[J].Chin J Prosthodont,2006,7(3):161-168.
[11] Tang QQ,Jiang MS,Lane MD.Repressive effect of Spl on the C/EBPalpha gene promoter:Role in adipocyte differentiation[J]. Mol Cell Biol,1999,19(7):4855-4865.
[12] Smas CM,Chen L,Zhao L,et al.Transcriptional repression of pref-1 by glucocorticoids promotes 3T3-L1 adipocyte differentiation[J].Biol Chem,1999,274(18):12632-12641.
[13]Kolehmainen M,Uusitupa MI,Alhava E,et al.Effect of the pro12Ala polymorphism in the perioxisome proliferator-activated receptor(PPAR)gamma 2 gene on the expression of PPAR gamma target genes in adipose tissue of massively obese subjects[J].J Clin Endocrinol Metab,2003,88(4):1717-1722.
[14] Nagatomo K,Komaki M,Sekiya I,et al.Stem cell properties of human periodontal ligament cells[J].J Periodontal Res,2006,41(4):303-310.
[15]韩劼,孟焕新,唐军民,等.人牙周膜细胞体外定向诱导分化为脂肪细胞的研究[J].口腔医学研究,2006,22(2):133-136.
HAN Jie,MENG Huan-xin,TANG Jun-min,et al.Study on induced differentiation of human periodontal ligament cells into adipocytes in vitro[J].J Oral Sci Res,2006,22(2):133-136.
(本文编辑 汤亚玲)
Experiment on inducing human periodontal ligament stem cells into adipose cells
HE Hui-xia,LIU Hongchen,WANG Dong-sheng,CAO Jun-kai,ZHANG Hai-zhong,E Ling-ling.(Institute of Dental Research,General Hospital of Chinese PLA,Beijing100853,China)
ObjectiveTo explore the capability of human periodontal ligament stem cells(PDLSCs)differentiating into adipose cellsin vitroand to determine their changes in cell morphology,structure and function during differentiation.MethodsPDLSCs isolated by magnetic-activated cell selection were treated continuously with adipogenic medium for 21 d.Then the cell morphology,ultrastructure,adipose specific markers of low density lipoprotein(LPL)and peroxisome proliferator activated receptor-γ(PPAR-γ) were analyzed by inverted contrast microscope,transmission electron microscope(TEM),flow cytometry,immunofluorescence,RT-PCR and Western blot,respectively. These adipose-like cells were also identified by oil red O staining to determine the formation of lipid droplet,and the non-induced cells were used as control.Results After continuous induction,the treated cells differentiated into adipose-like cells with round shape,and large amount of lipid drop in cytoplasm.96.54%of the PDLSCs were found to differentiate into adipose cells as showed by flow cytometry,the specific markers of LPL mRNA and PPAR-γ mRNA,and oil red O staining,respectively.Further,PPAR-γprotein was detected in the induced cells in a timedependent manner.ConclusionHuman PDLSCs have the potential of differentiating into adipose cells under appropriate condition,and the differentiated cells exhibited characteristics of adipose cells both from cell morphology and from their functions.
periodontal ligament stem cells; induce; differentiate; adipose cell
R 781
A
10.3969/j.issn.1000-1182.2010.02.022
1000-1182(2010)02-0203-05
2009-05-25;
2009-10-29
中国博士后科学基金资助项目(20070420077);中国博士后科学基金特别资助项目(200801061);国家自然科学基金资助项目(30772450)
贺慧霞(1970—),女,甘肃人,副主任医师,博士
刘洪臣,Tel:010-66939974

