不同方法制备抗原致敏的树突状细胞介导T淋巴细胞对Tca8113细胞杀伤作用的影响
郅克谦 徐燕 任文豪 高岭 赵璐 杨勇 张引成
(西安交通大学医学院附属口腔医院 口腔颌面头颈肿瘤外科,陕西 西安 710004)
不同方法制备抗原致敏的树突状细胞介导T淋巴细胞对Tca8113细胞杀伤作用的影响
郅克谦 徐燕 任文豪 高岭 赵璐 杨勇 张引成
(西安交通大学医学院附属口腔医院 口腔颌面头颈肿瘤外科,陕西 西安 710004)
目的 探讨树突状细胞(DCs)疫苗治疗舌癌的可行性,并选择较优的抗原负载方式。方法 分别采用弱酸洗脱法、反复冻融法制备Tca8113细胞抗原,并分为3组:弱酸洗脱抗原组、反复冻融抗原组、对照组(不加肿瘤抗原)。从外周血单核细胞中诱导DCs,分离出T淋巴细胞。以不同效靶比将DCs和T淋巴细胞混合培养,MTT法测光密度值,计算刺激指数。DCs抗原负载后,与T淋巴细胞混合,以不同效靶比加入预先接种了Tca8113细胞的培养板。MTT法测光密度值,计算杀伤率。结果 2种方法体外成功地构建了DCs疫苗,抗原致敏组与对照组比较差异显著,且弱酸洗脱组优于反复冻融组。DCs疫苗可诱导细胞毒性T淋巴细胞有效的杀伤Tca8113细胞,并表现明显的剂量效应。结论 DCs疫苗致敏T淋巴细胞能够有效的杀伤Tca8113细胞,酸洗脱抗原冲击致敏的DCs疫苗在舌癌的免疫治疗中优于冻融抗原。
树突状细胞; 舌癌; 免疫治疗
以各种方式诱导机体产生肿瘤特异性T淋巴细胞免疫反应,已成为有效的临床抗肿瘤治疗手段。树突状细胞(dendritic cells,DCs)疫苗在恶性淋巴瘤、恶性黑色素瘤、前列腺癌等肿瘤的治疗中取得了令人鼓舞的疗效[1-2]。本研究选用舌癌Tca8113细胞系,弱酸洗脱法和反复冻融法2种方法获得肿瘤抗原,再与同种异体外周血来源DCs混合培养,获得负载不同抗原的DCs,然后将抗原负载的DCs与自体T淋巴细胞共同孵育,得到致敏的细胞毒性T淋巴细胞(cytotoxicity T lymphocyte,CTL),与Tca8113细胞作用,检测其对舌癌细胞的杀伤效果,探讨DCs疫苗治疗舌癌的可行性,并选择较优的抗原负载方式。
1 材料和方法
1.1 主要试剂及仪器
Tca8113细胞株(口腔疾病研究国家重点实验室,四川大学),人淋巴细胞分离液(天津灏阳生物科技有限公司),重组人粒-巨噬细胞集落刺激因子(recombinant human granulocyte-macrophage colonystimulating factor,rhGM-CSF)、重组人白细胞介素-4(recombinant human interleukin-4,rhIL-4)(Cytolab/Peprotech ASIA公司,美国),Bradford蛋白浓度测定试剂盒(江苏碧云天生物公司),胰蛋白酶(Gibco公司,美国),AF-Ⅱ Nikon荧光显微镜(Nikon公司,日本),Biotrak-Ⅱ酶联免疫分光光度仪(Amersham Biosciences公司,美国)。
1.2 方法
1.2.1 DCs体外诱导培养、扩增、鉴定及保存 健康志愿者肘静脉取血40mL,加入250 U·mL-1肝素溶液4mL,等体积PBS(pH 7.2~7.4)稀释。按分离液与抗凝血2∶1的体积比加入淋巴细胞分离液,密度梯度离心。取界面层细胞,置于50mL离心管中,PBS悬浮细胞,离心(1 500 r·min-1,10min)洗细胞3次。将洗涤后的细胞重悬于含10%FBS的RPMI1640培养基中,调整细胞密度为每毫升2×106个。加入24孔培养板,每孔1mL,置于37℃,5%CO2培养箱中孵育3 h。每孔重新加入含10%胎牛血清的RPMI1640完全培养基1mL,并加入rhGM-CSF50μg·L-1,rhIL-4 40μg·L-1,置于37℃,5%CO2培养箱中培养。另设1孔为对照孔,不加任何细胞因子。每3 d半换液1次,并补充培养液和细胞因子,使细胞因子终浓度同上。于培养第7天获得DCs。
培养第7天的DCs,取1孔细胞悬液,离心,PBS洗涤(1 000 r·min-1,每次5min),涂附于预先用多聚赖氨酸包被的载玻片上,自然干燥,4℃冷丙酮固定10min,置于PBS中振洗5min,滤纸吸干,滴加过氧化氢酶阻断剂10min,正常羊血清封闭5min,滴加一抗CD1a抗体置湿盒内,37℃孵育2 h,滴加生物素标记的二抗37℃孵育30min,滴加链亲和素过氧化物酶液,37℃孵育20 min。每步骤后均用PBS缓冲液洗涤3次,每次5min。DAB显色,苏木精复染,干燥后中性树胶封片。检测DCs的特征性表型CD1a。倒置相差显微镜观察细胞形态变化;普通光镜观察经苏木精-伊红染色和免疫细胞化学染色的DCs形态;透射电镜观察细胞超微形态。
1.2.2 舌癌细胞不同形式肿瘤抗原的制备 弱酸洗脱法:Tca8113细胞置于含10%FBS的RPMI 1640中培养5 d,取对数生长期的细胞,0.25%胰蛋白酶消化,用RPMI1640培养基制成细胞悬液,1 000 r·min-1离心5min,PBS洗细胞2次,加入10mL弱酸提取液(0.13mol·L-1Citrate acid,0.066mol·L-1Na2HPO4,调节pH至3.3,细胞密度为每毫升1×107个)混匀,2 000 r·min-1离心5min,吸取上清,即为抗原肽洗脱液;将其加入到透析袋中扎紧袋口,放入约3 000mL双蒸水中,搅拌,4 h后换双蒸水,至pH值大于7.2,置入超滤离心管,4 000 r·min-1,20min浓缩液体,加入PBS 10mL溶解,离心后经0.22μm微孔滤膜过滤除菌,分装,-20℃保存。
细胞冻融法:Tca8113细胞置于含10%FBS的RPMI1640中培养7 d,取对数生长期的细胞,0.25%胰蛋白酶消化,用RPMI1640培养基制成细胞悬液,1 000 r·min-1离心5min,PBS洗细胞2次,PBS调整细胞密度为每毫升1×107个,放入离心管内,封口,于43℃水浴中静置30min,置于-80℃冰箱中快速冷冻20min,再迅速放入37℃水浴中解冻10min,反复4次,2 000 r·min-1离心20min,取上清液,经0.22μm微孔滤膜过滤除菌后即为肿瘤冻融抗原,分装,4℃保存。
1.3 自体T淋巴细胞反应
培养至7 d的DCs细胞,RPMI1640调整细胞密度为每毫升1×106个,移入12孔培养板,每孔2mL,部分孔内加入冻融抗原0.1mL,部分加入酸洗脱抗原肽0.1mL,继续培养24 h,对照组不加抗原。丝裂霉素C(25μg·mL-1),37℃,5%CO2孵育1 h后,用含10%FBS的RPMI1640充分洗涤去除丝裂霉素C,并补充细胞因子,使rhGM-CSF终浓度为50μg·L-1,rhIL-4为40μg·L-1。按DCs与T细胞分别为1∶10、1∶50、1∶100的比例将DCs和T细胞接种于96孔圆底培养板,T细胞密度达到每毫升1×104个,每孔200μL,37℃,5%CO2继续培养72 h。实验分组:A组为冻融抗原致敏DCs加T细胞,B组为酸洗脱抗原致敏DCs加T细胞,C组为实验对照组,未致敏DCs加T细胞。A、B、C组按效靶比为1∶10、1∶50、1∶100的比例各自分为A1、A2、A3、B1、B2、B3、C1、C2、C3组。测定每孔的光密度值,计算刺激指数。
1.4 致敏DCs疫苗对靶细胞的杀伤效应
上述经DCs致敏的T淋巴细胞以25∶1、50∶1、100∶1的比例加入预先接种了Tca8113细胞的96孔平底培养板中,总体积为200μL,不足的用10%小牛血清的RPMI1640培养基补齐,37℃,5%CO2培养48 h。于培养48 h结束前的4 h,吸弃悬浮细胞,每孔重新加培养基0.2mL,MTT液(5 g·L-1)20μL。37℃,5% CO2继续培养,于培养结束时,吸弃每孔中的上清液,加入DMSO 150μL,微量振荡器振荡10min,以彻底溶解晶体。用酶标仪检测各孔的光密度值。A组:T细胞加酸洗脱抗原肽致敏DCs加Tca8113,B组:T细胞加冻融瘤细胞抗原致敏DCs加Tca8113,C组:T细胞加未致敏DCs加Tca8113细胞。A、B、C组按25∶1、50∶1、100∶1的效靶比分为A1、A2、A3、B1、B2、B3、C1、C2、C3组,每组设3个复孔,光密度值以3孔均值表示,计算杀伤率。
2 结果
2.1 体外培养的DCs形态
外周血单核细胞贴壁3 h后获得黏附细胞,加入细胞因子,培养1~2 d见贴壁细胞数量减少,悬浮生长细胞数量增多,呈单层均匀分布。培养3~4 d,见细胞呈积聚趋势,簇状生长,形成大小不等的DCs细胞集落,形态较不规则,同时DCs细胞表面有许多微绒毛样突起,部分细胞突起较大。培养至第7天,可见到大量具有树突状突起的悬浮细胞。对照孔内细胞绝大部分呈贴壁生长状态,呈明显的星状或条索状。培养至第7天的树突状细胞,加入Tca8113细胞冻融抗原或者酸洗脱抗原继续培养24 h后,镜下观察可见细胞变大,悬浮细胞数量增加,呈簇状生长。苏木精-伊红染色后普通光镜下观察,细胞体积较大,近似圆形,细胞周围有毛刺样突起,胞质嗜酸染色,核较大且略偏一侧,着色较深,大部分为圆形,有时呈显叶状或短杆状。透射电镜下见树突状细胞呈圆形,细胞表面有许多微绒毛样的突起,个别细胞表面有较粗大的突起。细胞核形状不规则,核质比不高,核膜迂曲明显,核内染色质分布均匀,常染色质丰富,异染色质少,核仁可见,细胞质内核糖体丰富,线粒体短小,数量较多,少量的粗面内质网分散在细胞质中。
2.2 表型鉴定
免疫组化染色后表面呈褐色的为阳性细胞,可见CD1a阳性表达于DCs胞膜上。
2.3 自体T淋巴细胞反应
效靶比为1∶10时,A1、B1、C1组刺激指数值的差异有统计学意义(P<0.05),大小关系为A1>B1>C1。效靶比为1∶50时,A2、B2与C2组比较差异有统计学意义(P<0.01);A2、B2之间无差异(P>0.05)。效靶比为1∶100时,A3、B3、C3组之间无差异(表1)。以上数据说明经肿瘤冻融抗原或酸洗脱抗原致敏的DCs均可刺激T淋巴细胞增殖,未经抗原致敏的DCs不能刺激T淋巴细胞的增殖。抗原致敏的DCs刺激T细胞增殖能力,酸洗脱组大于冻融组,但效靶比为1∶100时,2组虽都有刺激作用,但作用较小。抗原致敏的DCs刺激T细胞增殖的作用随效靶比的增加而增大。
表1 各组细胞的刺激指数值(n=3,±s)Tab 1 Stimulation index values of each group(n=3,±s)
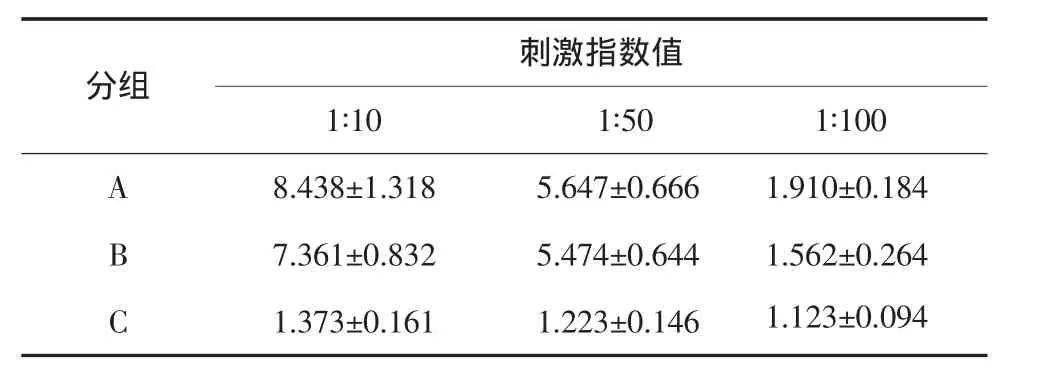
表1 各组细胞的刺激指数值(n=3,±s)Tab 1 Stimulation index values of each group(n=3,±s)
分组刺激指数值1∶10 1∶50 1∶100 A 8.438±1.318 5.647±0.666 1.910±0.184 B 7.361±0.832 5.474±0.644 1.562±0.264 C 1.373±0.161 1.223±0.146 1.123±0.094
2.4 DCs介导CTL对Tca8113细胞的杀伤作用
效靶比为25:1时,A1、B1组杀伤率均大于C1组,差异有统计学意义(P<0.01),A1、B1之间杀伤率的差异无统计学意义。效靶比为50∶1、100∶1时,A、B、C组之间杀伤率的差异有统计学意义(P<0.01),大小关系为A>B>C。不同效靶比时,A1、A2、A3之间杀伤率的差异有统计学意义(P<0.01),A1<A2<A3;B1、B2、B3比较差异有统计学意义(P<0.01),B1<B2<B3,C1小于C2、C3组,差异有统计学意义(P<0.05),C2、C3组差异无统计学意义(表2)。说明经Tca8113肿瘤细胞抗原致敏的树突状细胞可诱导细胞毒性T淋巴细胞有效的杀伤Tca8113细胞。酸洗脱组比冻融组杀伤率高。未经Tca8113肿瘤细胞抗原致敏的树突状细胞亦可诱导T淋巴细胞杀伤Tca8113细胞,但杀伤率较低,与抗原致敏组比较差异显著。细胞毒性T淋巴细胞杀伤Tca8113细胞作用随效靶比的增加而增大。
表2 CTL对Tca8113细胞杀伤作用(n=3,±s)Tab 2 Killing effect on Tca8113 cell by CTL(n=3,±s)
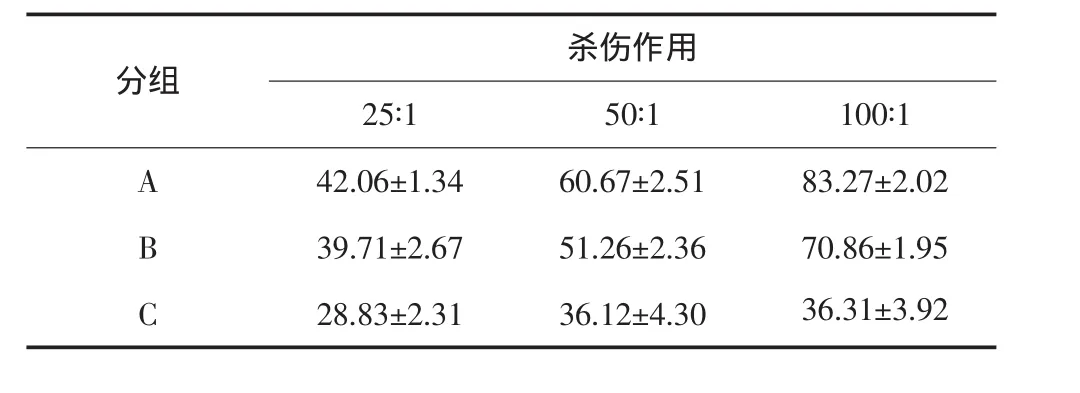
表2 CTL对Tca8113细胞杀伤作用(n=3,±s)Tab 2 Killing effect on Tca8113 cell by CTL(n=3,±s)
分组 杀伤作用25∶1 50∶1 100∶1 A 42.06±1.34 60.67±2.51 83.27±2.02 B 39.71±2.67 51.26±2.36 70.86±1.95 C 28.83±2.31 36.12±4.30 36.31±3.92
3 讨论
肿瘤抗原刺激树突状细胞的成熟和鉴定是树突状细胞疫苗研究的关键。Berthier等[3]认为DCs的培养分为启动培养和分化培养2个阶段:应用粒-巨噬细胞集落刺激因子、白介素-4 7 d,脐血、成人骨髓或外周血中的造血干细胞以及外周血中单核细胞可以产生大量的DCs;应用成熟诱导因子促使DCs成熟。本实验中,外周血单核细胞用GM-CSF和IL-4诱导7 d后,用Tca8113细胞的酸洗脱或者冻融抗原作用,细胞体积增大,树突状突起更加明显,且能够显著刺激初始型T淋巴细胞增殖,诱导针对Tca8113细胞特异性的CTL杀伤作用,表明所诱导的DCs摄取抗原后具有较强的抗原提呈作用,具有成熟DCs的典型特征及功能。笔者认为在细胞因子GM-CSF和IL-4的持续刺激下,DCs可能随着吞噬或胞饮抗原后分化成熟,对外源性抗原,DCs通过交叉抗原提呈的途径,即使用抗原加工的旁路途径使外源性抗原经由MHC-I类途径提呈给T淋巴细胞,DCs内的MHC-Ⅰ、Ⅱ类分子都可与外源性抗原肽结合并提呈,而且,DCs对抗原的这种交叉提呈可能不需要DCs成熟信号的刺激。DCs表面表达丰富的免疫分子,但迄今尚未发现能用于其鉴定的非常理想的特异性分子标记[4]。因此,目前鉴定DCs通常是通过细胞形态、组合性细胞表面标志以及混合淋巴细胞反应中刺激初始型T淋巴细胞增殖能力等来综合判断[5]。本实验培养的DCs有典型的细胞形态及抗原摄取、加工、提呈能力,且能刺激初始型T细胞增殖,诱导CTL特异性杀伤肿瘤效应,认为诱导出了成熟状态的DCs。通过对其表面不同时期表达的各种细胞分子进行分析,探讨抗原致敏的成熟DCs激活并刺激初始型T淋巴细胞增殖,诱导特异性CTL肿瘤杀伤效应的具体机制有待进一步研究。
目前大多数肿瘤(包括舌癌)尚未能明确鉴定和获取肿瘤相关抗原或特异性抗原,而且单一抗原的免疫攻击可能无法杀伤肿瘤,肿瘤易于产生针对单一抗原的免疫逃逸。全细胞肿瘤抗原刺激树突状细胞能避免肿瘤抗原多肽刺激存在的某些不足,如无需明确肿瘤抗原,可能有多种不同的肿瘤抗原冲击树突状细胞,从而诱导针对不同抗原决定簇的CTL克隆等。利用反复冻融法、弱酸洗脱法和超声破碎法提取的水溶性蛋白作为肿瘤抗原,具有多种抗原表位,更有利于对肿瘤细胞的免疫攻击。有学者通过免疫组化法分析口腔鳞癌中DCs表型认为,在口腔鳞癌组织中及颈部引流区淋巴结内的DCs,其浸润程度下降并存在功能成熟障碍。因此,增强肿瘤细胞内源性HLA-Ⅰ类抗原分子的表达和提呈对包括舌癌在内的恶性肿瘤的治疗是可行的。此外,细胞性肿瘤抗原易于获取和制备,虽理论上有诱发自体免疫性疾病的风险,但在临床研究中到目前为止并未发现与之相关的自体免疫反应,因而用肿瘤细胞全细胞抗原致敏DCs有较大的临床应用潜力。
本研究冻融抗原负载DCs组刺激初始型T淋巴细胞增殖效应和诱导的细胞毒效应明显强于未负载肿瘤抗原的DCs组,与王志勇等[6]的研究结果相一致。比较2种抗原致敏的DCs诱导CTL对舌癌细胞体外杀伤作用的大小,酸洗脱组大于冻融组(P<0.01)。可能原因为:冻融法比酸洗脱法在相同数量细胞中提取的抗原蛋白量大,但含有大量的杂蛋白,肿瘤抗原仅占其中的一部分,因而抗原性差。另外,冻融抗原组中可能存在抑制细胞免疫的成分,也造成了细胞毒效应的下降。冻融过程中,有些蛋白可能分解不彻底,相对分子质量过大会不利于DCs摄入和处理抗原。弱酸洗脱法可洗脱绝大部分细胞膜表面与MHC-Ⅰ类分子相结合的抗原肽,而对与MHC-Ⅱ类分子和其他非MHC结合的抗原无作用,也不会引起多肽结构改变,使酸洗脱物成分相对单一[7]。因此,以弱酸洗涤Tca8113细胞的方法获取的肿瘤抗原能够保留其特异性。弱酸洗脱法虽然只获得MHC-Ⅰ类分子肽,不含有MHC-Ⅱ类抗原肽,但由于DCs高表达MHC-Ⅰ类分子和共刺激分子、黏附分子,在体外可以不必需要CD4+T细胞的辅助直接诱导CTL的生成。
[1] Vantomme V,Dantinne C,Amrani N,et al.Immunologic analysis of a phaseⅠ/Ⅱ study of vaccination with MAGE-3 protein combined with the AS02B adjuvant in patients with MAGE-3-positive tumors[J].J Immunother,2004,27(2):124-135.
[2] Pandha HS,John RJ,Hutchinson J,et al.Dendritic cell immunotherapy for urological cancers using cryopreserved allogeneic tumour lysate-pulsed cells:A phaseⅠ/Ⅱ study[J].BJU Int,2004, 94(3):412-418.
[3] Berthier R,Martinon-Ego C,Laharie AM,et al.A two-step culture method starting with early growth factors permits enhanced production of functional dendritic cells from murine splenocytes[J].J Immunol Methods,2000,239(1/2):95-107.
[4] Shortman K,Liu YJ.Mouse and human dendritic cells subtypes [J].Nat Rev Immunol,2002,2(3):151-161.
[5] Crespo I,Paiva A,Couceiro A,et al.Immunophenotypic and functional characterization of cord blood dendritic cells[J].Stem Cells Dev,2004,13(1):63-70.
[6] 王志勇,李声伟,胡勤刚,等.树突状细胞体外诱导淋巴细胞抑制舌癌细胞生长的实验研究[J].实用口腔医学杂志,2004,20(5):517-520.
WANG Zhi-yong,LI Sheng-wei,HU Qin-gang,et al.Dendritic cells from human peripheralmonocyte induces lymphocytic respones against Tca8113 cells:An in vitro experiment[J].J Pract Stomatol,2004,20(5):517-520.
[7] Runnels HA,Moore JC,Jensen PE.A structural transition in classⅡmajor histocompatibility complex proteins at mildly acidic pH[J].J Exp Med,1996,183(1):127-136.
(本文编辑 汤亚玲)
Killing effect of cytotoxicty Tlymphocyte primed by two different methods preparation of dendritic cells pulsed with antigen on Tca8113 cells in vitro
ZHI Ke-qian,XU Yan,REN Wen-hao,GAO Ling,ZHAO Lu, YANG Yong,ZHANG Yin-cheng.(Dept.of Oral and Maxillofacial Surgery,Stomatological Hospital,Xi′an Jiaotong University,Xi′an710004,China)
ObjectiveTo study the feasibility of dendritic cells(DCs)vaccine on the therapy of tongue carcinoma and find the better way of antigen load.MethodsThe antigen peptides of Tca8113 cells were obtained by acid eluted technique and repetitive freeze thaw method.Separating T cell and inducing dendritic cells were obtained from human peripheral blood monocyte.Divided into three groups:Weak acid elution method antigen group,anti-freezethaw method antigen group,and the control group(without tumor antigen).T cells and DCs were mixed to culture by different effector-target ratio.Using MTT assay measured the quantities of absorbance and calculated stimulation index.Dendrtic cells pulsed with antigen were mixed with T cells by different effector-target ratio.MTT assay was used to measure the quantities of absorbance and calculate killing rate.Results DCs vaccine was constructed successfully.DCs vaccine can induce T lymphocytes to kill Tca8113 cells and display the dose-effect relationship.There was significant difference among the three groups.The acid eluted and repetitive freeze thaw groups were better than the control group.The acid eluted group was better than repetitive freeze thaw group.ConclusionDCs vaccine can induce T lymphocytes to kill Tca8113 cells.The antigen peptides obtained by acid eluted technique is better than repetitive freeze thaw method in immunotherapy of tongue cancer.
dendritic cell; tongue cancer; immunotherapy
R 739.8
A
10.3969/j.issn.1000-1182.2010.02.020
1000-1182(2010)02-0195-04
2009-04-02;
2009-07-27
陕西省科技攻关资助项目[2006k09-G3(5)和2009k17-03];西安市科技计划资助项目[SF09030(4)]
郅克谦(1968—),男,新疆人,副教授,博士
郅克谦,Tel:029-81015479

