氨基硅烷化超顺磁纳米颗粒的制备及其在小鼠体内的分布
超顺磁纳米颗粒(SPION)作为磁共振(MR)对比剂已应用于临床。由于磁性纳米粒子具有高比表面积、高比表面能以及粒子各向异性的偶极距作用,从而很容易聚集。磁性粒子如Fe、Fe3 O4很容易被氧化成γ-Fe2O3,从而导致粒子发生聚集和沉淀,不能形成稳定的分散体系,使其在生物医学中的应用受到了限制。通过对磁性纳米粒子的表面修饰可以降低其表面能,提高粒子的抗氧化能力,得到分散性好的纳米复合粒子;同时适当的表面修饰可以调节磁性纳米粒子与其他材料的相容性和反应特性。N-(2氨基)-3氨基丙基硅氧烷[N-(2-aminoethyl)-3-aminop ropyltrimethoxysilance,AEAPS]具有SiO2和氨基的双重功能。SiO2具有以下优异的性能:可以屏蔽磁性粒子之间的偶极相互作用,阻止粒子团聚[1];具有良好的生物相容性、亲水性以及非常好的稳定性[2]。氨基化的界面可以共价连接生物大分子,在生物医学和生物工程等领域有着广泛的应用前景。
1 材料和方法
1.1 仪器和试剂
1.1.1 仪器 H itachi-600透射电镜,安捷伦6890N气相色谱仪,TAS-990原子吸收分光光度计,KDC-160HR高速冷冻离心机,紫外分光光度计DU-65(Beckman),T6-1型电动搅拌机,H L-2恒流泵,AX 120型电子分析天平(精确度为千分之一)。
1.1.2 试剂 三氯化铁(FeCl3·6H2 O)、氯化亚铁(FeCl2·4H2O)、碳酸钠、碳酸氢钠、亚铁氰化钾、盐酸、氨水、冰乙酸、甲醇、甲苯、硫酸、盐酸羟胺、邻二氮菲等化学试剂均为国产分析纯,葡聚糖 T-10 (相对分子质量10 000),BSA,AEAPS,0.22μm滤膜。
1.1.3 实验动物 远交系KM小鼠,体重(18±2)g,雌雄各半。
1.2 方法
1.2.1 葡聚糖包被SPION的制备 通过共沉淀法制备外包葡聚糖的四氧化三铁超顺磁纳米颗粒(Dextran-SPION)。反应原理:Fe2++2Fe3++8OH-= Fe3O4+4H2O。具体步骤:称取 FeCl3·6H2O 4.68g、FeCl2·4H 2O 1.72 g、葡聚糖T-10 5g,在通氮条件下溶于60m l三蒸水中,在60℃条件下1 000r/ min机械搅拌,恒流泵以 1m l/min滴加 28%氨水60m l,反应1h后得到黑色胶状物。自然冷却至室温, 10 000r/min离心10min,弃去沉淀,收集上清液。将上清液用冰乙酸调pH至8.0,0.22μm滤膜过滤,分装后置于4℃备用。
1.2.2 AEAPS修饰Dex tran-SPION的制备 在Dextran-SPION表面修饰 AEAPS,使其氨基硅烷化[3]。配制AEAPS溶液,取3.5mmol/L AEAPS加入10m l甲苯/甲醇(甲苯∶甲醇=1∶1)溶液。向50m l Dextran-SPION溶液中加入 5m l AEAPS溶液,在60℃通氮条件下,1 000r/min机械搅拌反应4h,得到AEAPS/Dextran-SPION溶液。0.22μm滤膜过滤,分装后置于4℃备用。
1.3 样品性能检测
1.3.1 透射电镜观察AEAPS/Dextran-SPION的形态和直径 在铜网上制膜,将AEAPS/Dextran-SPION溶液滴于铜网上,自然沉淀5m in后,用滤纸吸走边缘多余液体,透射电镜观察AEAPS/Dextran-SPION的形态和直径。
1.3.2 AEAPS/Dex tran-SPION中AEAPS含量的测定 采用气相色谱-电子捕获检测器的方法检测AEAPS在AEAPS/Dextran-SPION中的含量,采用归一化法进行定量分析[4]。载气为纯度99.99%的高纯氮,流量2m l/m in,进样口温度200℃,检测器温度150℃。进样量10μl。计算公式:样品中AEAPS浓度=AEAPS标准品浓度×结合率;结合率=(AEAPS标准品峰面积-样品中未结合的AEAPS峰面积)/标准品峰面积。
1.3.3 AEAPS/Dextran-SPION和Dextran-SPION中铁离子和葡聚糖含量的测定 采用原子吸收分光光度计,选用铁元素空心阴极灯法测定铁的含量[5],以标准铁溶液每升0.05,0.1,0.2,0.4和0.6 g绘制标准曲线,从而得到回归方程;采用紫外分光光度计,用蒽酮-硫酸法[6]测定葡聚糖的含量,在625nm波长处测定吸光度,以葡聚糖溶液浓度每升0.08,0.16, 0.24,0.32,0.64 g绘制标准曲线,从而得到回归方程。
1.4 氨基硅烷化超顺磁性材料在小鼠体内的组织分布情况 将AEAPS/Dextran-SPION、Dextran-SPION用去离子水稀释至铁浓度为10m g/m l,给药量为0.2m l/只。取健康KM小鼠36只,雌雄各半,随机均分为9组,空白对照组为未给药KM小鼠。经尾静脉给药后,分别于0.5、1.0、2.0和4.0h用后拉错颈椎处死,摘取心、肝、脾、肺、肾脏,清除其上连带的脂肪组织和结缔组织后,用生理盐水洗净,滤纸吸干,以适量称取40.0mg。各脏器称量后转移到5m l的EP管中,向其中加入60%高氯酸1.0m l,在70℃水浴中加热消化1.0~1.5h直到固体全部消失;再向其中加入30%过氧化氢1.0m l脱色,振荡5min,静止,使其反应至少24h,直到溶液呈无色澄明。再进行原子吸收分光光度计测量。
2 结果
2.1 透射电镜 在210 000倍透射电镜下观察,可见AEAPS/Dextran-SPION核心为高密度的圆形颗粒,表面为分散均匀的AEAPS/Dextran覆盖层,以透射电镜标尺50nm,估算出AEAPS/Dex tran-SPION的核心粒径不超过25nm,整体粒径不超过30nm,平均粒径约为18nm(图1)。
2.2 AEAPS/Dextran-SPION中AEAPS的含量通过计算公式得到,AEAPS/Dextran-SPION中AEAPS的含量为0.319mm ol/L,结合率为91.15%。标准品出峰时间2.96m in,峰面积为3621.36(25μV× s);AEAPS/Dextran-SPION样品出现5个峰,出峰时间分别是3.00、3.22、3.37、3.54和3.90m in,峰面积分别为320.44、117.98、89.43、60.21、53.03(25μV× s),其中第一个峰为样品中未结合的AEAPS(表1,图2,3)。

图1 AEAPS/D-SPION颗粒
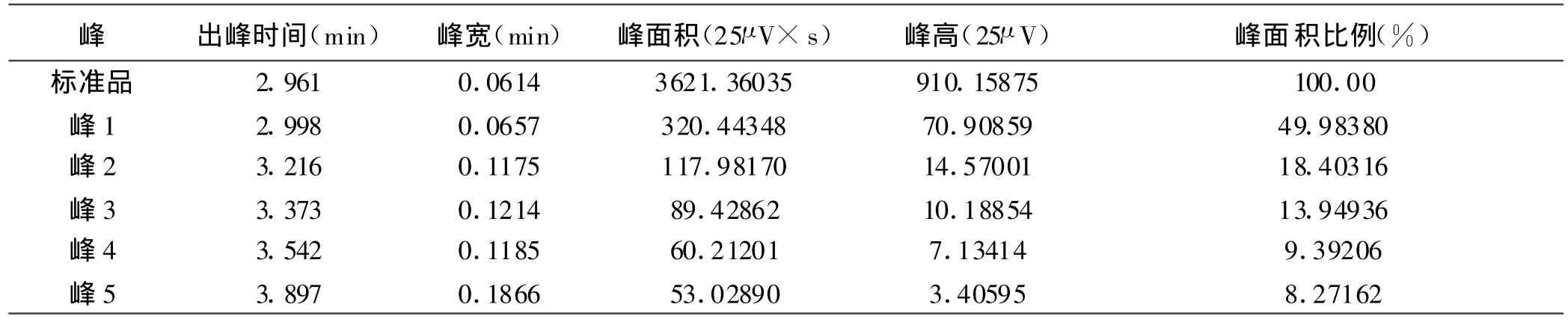
表1 气相色谱报告

图2 样品AEAPS/Dextran-SPION气相色谱图
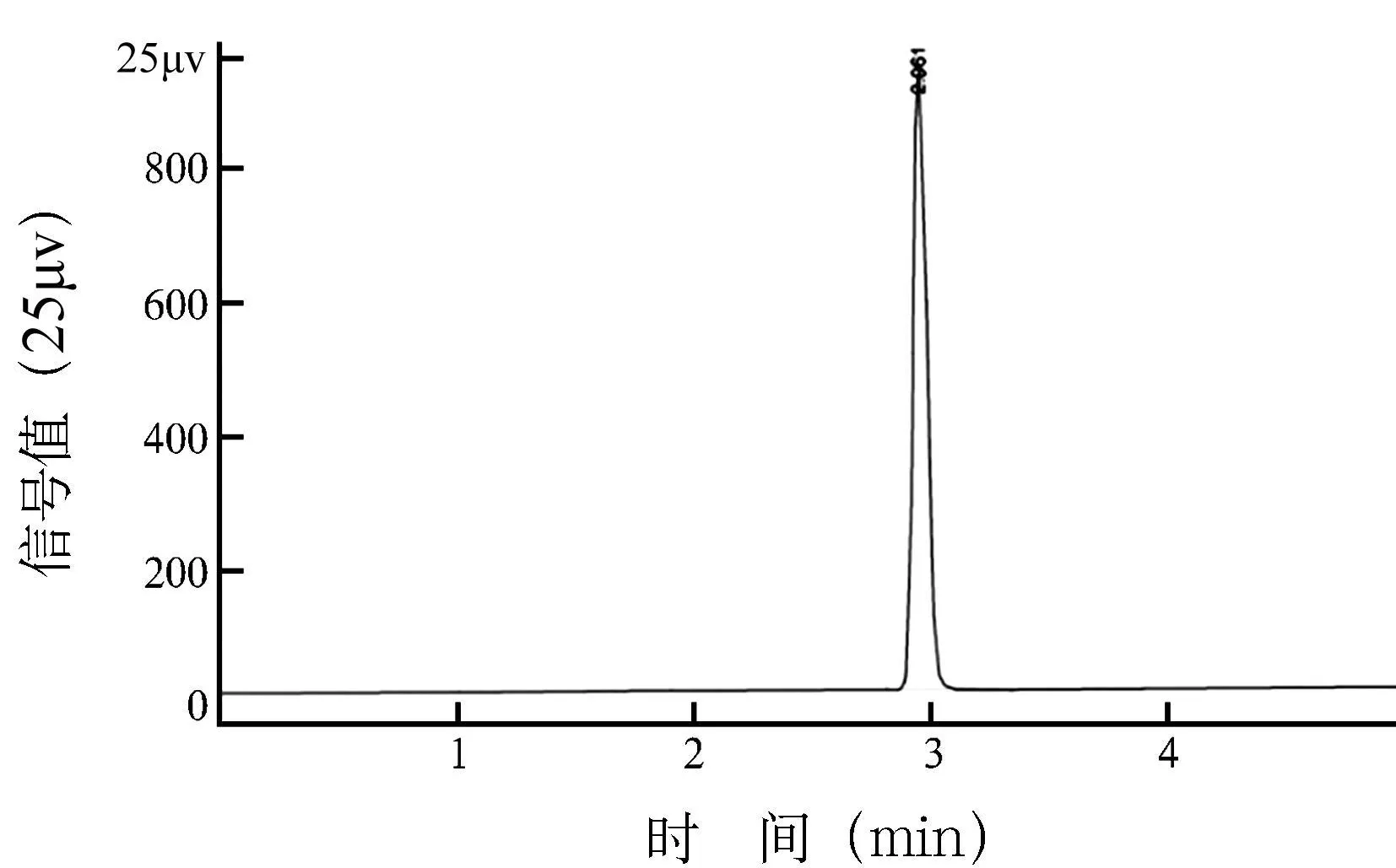
图3 标准品AEAPS气相色谱图
2.3 AEAPS/Dextran-SPION和/Dextran-SPION中铁离子和葡聚糖的含量 以标准铁溶液每升0.05, 0.1,0.2,0.4和0.6 g绘制标准曲线。以浓度C为横坐标,吸光度A为纵坐标,得到标准曲线回归方程:A =0.0017C-0.0036,r=0.99993。AEAPS/Dex tran-SPION中铁离子浓度为21.53mg/m l,Dextran-SPION中铁离子浓度为17.46 mg/m l;在625nm波长处测定吸光度,以葡聚糖溶液浓度每升 0.08,0.16, 0.24,0.32,0.64 g绘制标准曲线。C为横坐标,吸光度A为纵坐标,得到标准曲线回归方程:A=0.0126C +0.0533,r=0.99943。AEAPS/Dextran-SPION葡聚糖的浓度为19.37mg/m l,Dextran-SPION中葡聚糖的浓度为20.59 m g/m l。
2.4 氨基硅烷化超顺磁性材料在小鼠体内组织的分布 通过原子吸收分光光度计测定Fe在各个脏器中的分布(图4,5)。从图4中可见AEAPS/Dex tran-SPION主要被肝、脾所摄取,其次分布在肺和心脏,肾中含量最低。给药后0.5h,各个脏器Fe含量没有明显变化;给药后1h,脾中Fe含量最高,其次是肝、肺,而心脏和肾无明显变化;给药后2h,肝中Fe含量最高,其次是脾、肺、心脏,而肾没有明显变化;给药后4h,肺中Fe含量最高,其次是心脏,而肝和脾回复到给药前水平,肾无明显变化。

图4 AEAPS/Dextran-SPION在各个脏器的分布
从图5可见Dextran-SPION在各个脏器的分布,给药后0.5h,肝中Fe含量最高,其次是脾、肺,而心脏和肾无明显变化;给药后1h,各个脏器的Fe含量回复到给药前水平;给药后2h,心脏中Fe含量最高,其次是肺,而肝、脾、肾无明显变化;给药后4h,心脏中Fe含量最高,其次是脾、肝、肺,肾无明显变化。
与对照组相比,实验组小鼠各个脏器的色泽、形态无明显改变,说明其在试验过程中没有对各个脏器造成明显的损坏和毒性。
3 讨论
3.1 对超顺磁性氧化铁纳米粒子进行修饰从而减少细胞吞噬现象 动物体内的网状内皮系统具有十分丰富的巨噬细胞,这些巨噬细胞是细胞免疫系统的组成部分,当超顺磁性氧化铁纳米粒子通过静脉注射进入体内,与血浆蛋白结合,并在调理素作用下被网状内皮系统识别,巨噬细胞就会把超顺磁性氧化铁纳米粒子作为异物而摄取,从而使超顺磁性氧化铁集中在网状内皮细胞的组织和器官中。有研究者在非病毒转运体系的表面修饰亲水性的物质,如PEG[7]、PHPM A[8]、Pluronic[9],以及将转运体系的表面电性中和可大大减少转运体与血浆蛋白的相互作用,减少巨噬细胞的吞噬,延长循环时间。本试验中AEAPS可使SPION表面氨基硅烷化。氨基硅烷化的优点:首先硅烷化的SPION具有生物相容性,且避免了铁元素的金属毒性;其次是硅烷化层能够减弱磁性颗粒间的磁偶相互作用,使得修饰后的磁性颗粒能够稳定地分散于水溶液中,从而逃避网状内皮系统的吞噬;最为重要的是SPION提供了一个非常容易功能化的表面,从而使其表面可以共价连接各种生物分子,如肿瘤标志物抗体[3]、用于基因治疗的DNA[10]和抗肿瘤药物[11],从而起到靶向的作用。
3.2 AEAPS/Dextran-SPION在小鼠体内组织的分布 自然状态下经尾静脉注射AEAPS/Dextran-SPION后,肝在2h含Fe量最高;脾在1h含Fe量最高;肺和心脏在4h含Fe量最高;肾在注射前后含Fe量无明显变化。注射Dextran-SPION后,肝在0.5h含Fe量最高;脾、肺和心脏在4h含Fe量最高;肾在注射前后含Fe量无明显变化。肝是网状内皮系统的重要器官,AEAPS/Dextran-SPION要经过2h才被肝摄取,而Dex tran-SPION只需0.5h就被肝摄取,从而证实Dextran-SPION经AEAPS修饰后比Dextran-SPION更容易逃避网状内皮系统的吞噬,增加了氨基硅烷化磁性材料在血液中的循环时间。本研究为进一步探讨AEAPS/Dextran-SPION在肿瘤早期诊断中的应用提供了实验依据,可将AEAPS/Dex tran-SPION偶联肿瘤标志物的特异性抗体形成免疫磁性材料,可特异性的靶向早期或转移的微小肿瘤病灶,通过MR检测达到早期诊断原位或转移肿瘤的目的。
[1] Tartaj P,Serna CJ.Synthesis o fmonodisperse superparamagnetic Fe/silica nanosphericalcomposites.J Am Chem Soc,2003,125(51):15754.
[2] Yang HH,Zhang SQ,Chen XL,et al.Magnetite-containing spherical silica nanoparticles for biocatalysis and bioseparations,Analy tical Chem istry,2004,76(5):1316.
[3] Sheng Liang,Yongxian W ang,Junfeng Yu,et al.Surface modified superparamagnetic iron oxide nanoparticles:As a new carrier for bio-magnetically targeted therapy.JM ater Sci,2007,18(12):2297.
[4] 李发美.分析化学.第5版.北京:人民卫生出版社,2003, 275.
[5] 李发美.分析化学.第5版.北京:人民卫生出版社,2003, 392.
[6] 穆卫东,王虹,杨晓明,等.鱼腥草等七种中草药中铁元素的测定分析.广东微量元素科学,2006(12):47.
[7] Vinogardov SV,Bronich TK,Kabanov AV.Nanosized cationic hydroge ls for d rug delivery:Preparation,properties and interactions w ith cells.Adv Drug Deliv Rev, 2002,54(1):135.
[8] Toncheva V,W olfert M A,Dash PR,et al.Novel vectors for gene delivery formed by self-assembly of DNA with poly(L-lysine)grafted with hyd rophilic po lymers.Biochim Biophys Acta,1998,1380(3):354.
[9] Jain TK,Richey J,Strand M,etal.Magnetic nanoparticles with dual functional p roperties:Drug delivery and magnetic resonance imaging.Biomaterials,2008,29(29):4012.
[10]Liu CH,You Z,Liu CM,eta l.Diffusion-weighted magnetic resonance imaging reversal by gene knockdown of matrix metalloproteinase-9 activities in live animal brains.JNeurosci,2009,29(11):3508.
[11]Tapan K J,John R,M ichelle S,etal.Magnetic nanoparticles with dual functional p roperties:Drug delivery and magnetic resonance imaging.Biomaterials,2008,29(29):4012.

