野生西瓜抗枯萎病鉴定研究
覃斯华 ,黄金艳 ,洪日新 ,付岗 ,韩金星 ,李文信
(1.广西农科院园艺研究所,广西南宁,530007;2.广西农科院植物保护研究所;3.广西大学农学院)
西瓜枯萎病,俗称死秧、死藤,是由镰刀菌寄生引起的土传病害,苗期至收获期均可发生,是瓜类蔬菜的重要病害之一,全国各地均有发生,特别是重茬地区,发病情况尤为普遍和严重。目前栽培品种中高抗枯萎病的西瓜材料缺乏,枯萎病主要靠嫁接换根预防,野生西瓜就是高抗枯萎病的嫁接砧木之一。本试验主要对从国内外收集到的野生西瓜材料进行抗枯萎病鉴定,并对西瓜幼苗受到枯萎病病菌侵染后,SOD、POD、CAT酶活性的变化情况进行分析测定。以期为深入研究西瓜枯萎病的发病规律、有效防治方法及抗性育种提供理论依据。
1 材料与方法
1.1 试验材料
供试西瓜材料均由广西农业科学院园艺研究所提供,野生材料分别为1号野生、2号野生、3号野生、4号野生、5号野生,以黑公子(栽培二倍体)、广西三号(栽培三倍体)、广西409(栽培四倍体)为对照。
1.2 菌种培养
西瓜枯萎病菌由郑州果树研究所、广西农科院植物保护研究所提供。枯萎病菌种在广西农科院植物保护研究所微生物研究室内进行培养。首先将活化的枯萎病菌种,接种到PDA培养基上,在28℃的恒温箱中培养10 d,然后加无菌水,经4层纱布过滤后配成1×105个/mL的孢子悬浮液,备用。
1.3 试验方法
西瓜在9月20日进行育苗,9月30日移栽至泡沫箱,试验设3次重复,每重复10株,8个材料,共240株,并对每组材料设一对照,试验小区随机排列。
试验采用浸根法,将株高和长势一致的西瓜幼苗轻轻拔出,用清水洗净根部后在孢子悬浮液中浸5 min后取出,重新种入灭菌砂土盘中。从接种之日起,每天观察幼苗的发病情况,共调查25 d,统计总发病株数,计算发病率。 分别在处理后的第 0、2、4、6、8 天,取幼苗根系和生长点下第2片展开叶,测定各项指标,每处理分别取5株,对其枯萎病抗性生理进行研究。
1.4 抗性分级标准
抗性分级标准按照Elmstron和Hopkins的标准进行分级[3]。
1.5 SOD、POD、CAT活性的测定
①POD活性测定方法 POD活性采用愈创木酚法测定,按不同部位分别称取根0.2 g、叶0.3 g,切碎放入研钵中,加1.5 mL pH值6.0的磷酸缓冲液,冰浴中研磨,4℃下以10 000 r/min离心15 min,取上清液待用。在光径为1 cm的玻璃比色杯内,先加入pH值6.0磷酸缓冲液2 mL,0.05 mol/L愈创木酚1 mL,再加入10 μL酶液,最后加入l mL的2%H2O2迅速颠倒混匀,立即把比色杯插入比色架上。在470 nm波长下每隔30 s测定A470吸光值。每个样品重复3次。酶活力计算:以时间为横坐标,A470值(重复测定的平均值)为纵坐标,对所得数据进行作图,求出图中所作直线(回归方程)的斜率,即△A470/min,该斜率代表酶反应的初速度,求出样品中过氧化物酶活性,以△A470·min-1·g-1表示。

表1 抗性分级标准说明
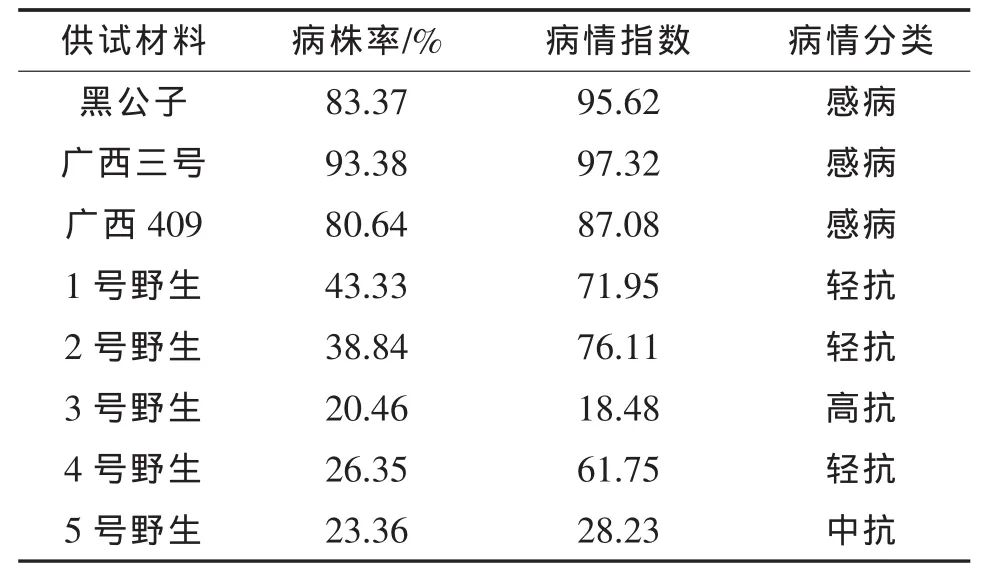
表2 植株病情分类结果
②SOD酶活性测定方法 SOD酶活性测定参照邹琦主编的《植物生理学试验指导》的方法,即按试验要求分别称取根0.2 g、叶0.3 g,加2 mL预冷提取介质冰浴中研磨成匀浆,加入介质冲洗研钵,并使终体积为10 mL。取5 mL于4℃10 000 r/min离心15 min,取上清液为酶提取液。一个酶活单位定义为将NBT还原抑制到对照一半(50%)时所需的酶量。
SOD 活性=(A0-As)×VT/[A0×0.5×FW×V1];其中:A0-照光对照管的光吸收值;As-样品管的光吸收值;VT-样液总体积 (mL);V1-测定时样品用量(mL);FW-样品鲜质量(g)。
③CAT酶活性测定方法 过氧化氢酶(CAT)活性按郝再彬方法测定,各处理分别取鲜叶和根系0.8 g,加入预冷的8 mL 50 mmol/L pH值7.8的磷酸缓冲液(内含1%聚乙烯聚吡咯烷酮PVPP)和少量石英砂,在冰浴上研磨成匀浆,匀浆在4℃12 000 r/min的冰冻离心机上离心15 min,上清液为粗酶提取液,然后取反应液3 mL(2 mL 100 mmol/L pH值7.8磷酸缓冲液,1 mL 0.08%双氧水)加入粗酶液0.1 mL,迅速摇匀后倒入石英比色皿中,以100 mmol/L pH值7.8磷酸缓冲液为空白,于波长240 nm处测定吸光值,每隔15 s读一次数,共3 min。以每1 min内A240减少0.1的酶量为一个酶活单位,用U·g-1·min-1FW表示CAT活性。
CAT 活性=△A240×酶提取液总量/(0.1×反应吸取的酶液量×样品鲜质量×反应时间)。
2 结果与分析
2.1 植株病情分类
从表2可看出,野生材料的枯萎病抗性表现均强于栽培材料,其中3号野生高抗枯萎病,5号野生中抗枯萎病,1号野生、2号野生、4号野生轻抗枯萎病,对照(黑公子、广西三号、广西409)为感病材料。
2.2 抗病材料与感病材料苗体内POD酶活性的动态变化
由图1可以看出,西瓜材料间POD活性的差异在正常生长状态下,野生材料叶片中POD活性高于栽培材料,但野生材料间叶片中POD活性差异不明显。根系中POD活性材料间差异明显。
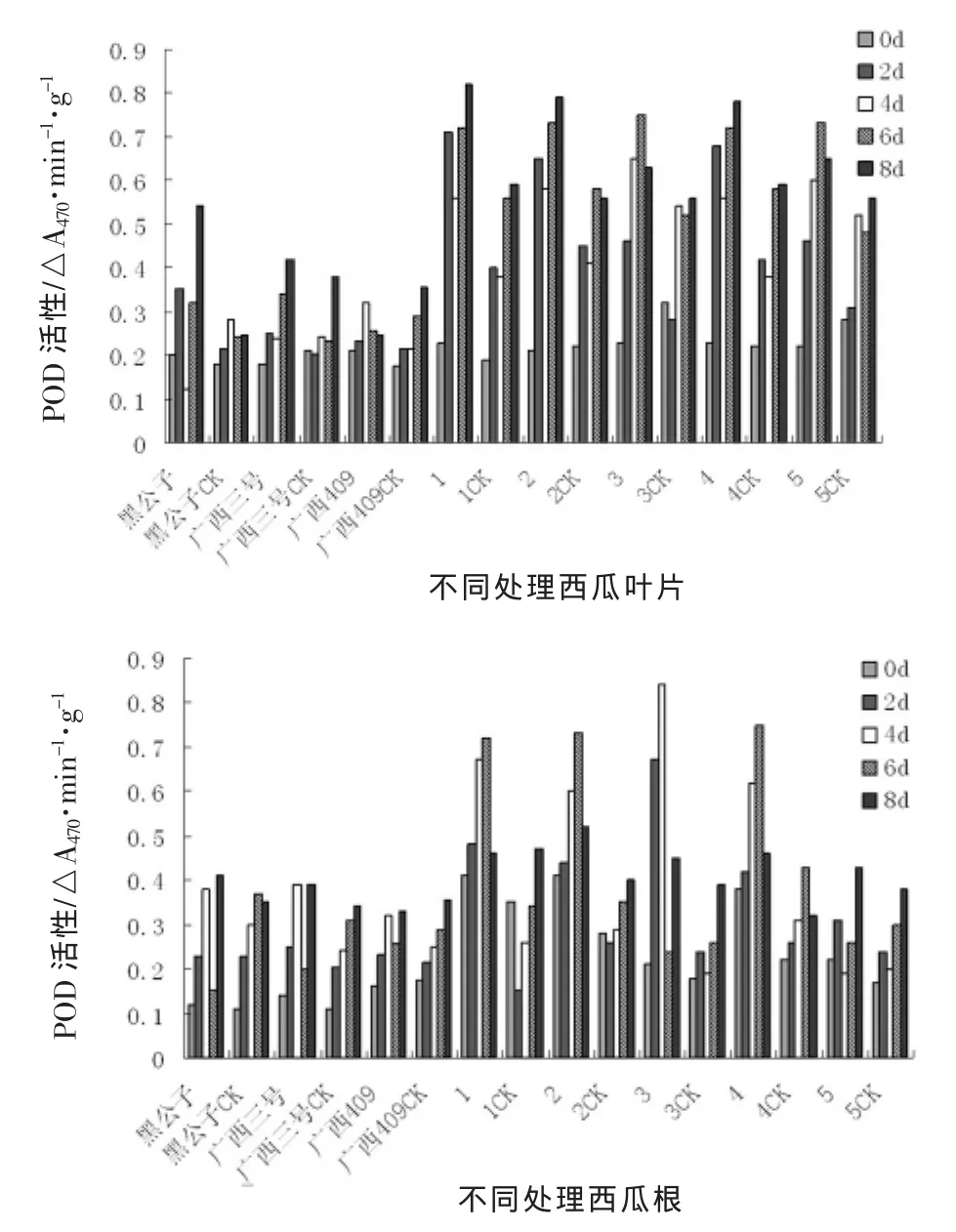
图1 接种枯萎病后西瓜苗体内POD活性变化动态
枯萎病病菌侵染后,西瓜幼苗叶片和根系组织中POD活性明显升高,但表现出不同的动态。抗病材料叶片组织中POD活性从接种后第2天就显著高于对照,而感病材料则表现出不明显变化,到接种后第4天之后,才明显高于对照,但其峰值明显低于抗性材料。根系组织中POD活性在接种后第2天就有明显变化。而黑公子,广西三号,广西409三个材料处理与对照之间差异不显著,POD活性变化不明显,野生材料POD含量呈现先升后降的趋势,但以高抗材料3号野生西瓜表现最为明显。
抗病材料与感病材料苗体内POD酶活性的变化存在明显差异,但5号野生表现不同于其他野生材料,这可能与其受到枯萎病病菌侵染后,本身自我调节能力强弱有关。
2.3 抗病材料与感病材料苗体内SOD酶活性的动态变化
由图2可以看出,所有处理的西瓜材料苗体内SOD酶活性变化比较复杂,叶片内SOD酶活性的变化整体上呈现先升后降的趋势,在苗体接种2 d后,SOD酶活性达到最高值,随着时间的推移,SOD酶活性呈下降趋势,但抗性材料的SOD酶活性下降缓慢,并且保持一定水平,而感病材料的SOD酶活性下降迅速,这表明感病材料在受到枯萎病病菌侵染后,活性细胞的氧化机制已被破坏,而抗性材料的自我修复调节能力高于感病材料,故表现比较好。
根系SOD酶活性的变化与叶片SOD酶活性变化相似,抗性材料的变化趋势相似,且在受到枯萎病病菌侵染后,SOD酶活性迅速升高,随着时间的推移,SOD酶活性下降明显,所有材料的处理与对照差异均不显著,这也说明在受到枯萎病病菌侵染后根系的氧化机制已被破坏,自我修复能力弱。
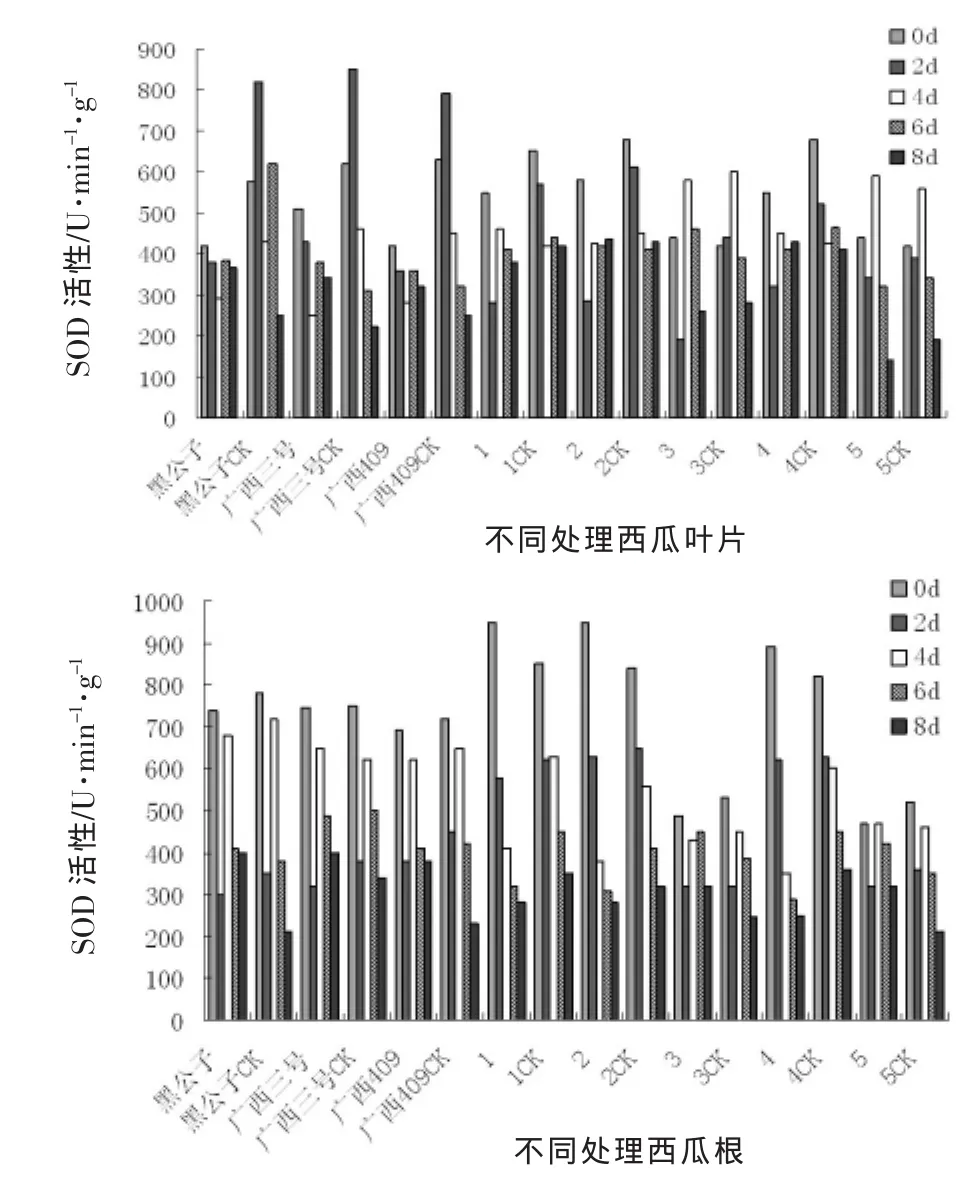
图2 接种枯萎病后西瓜苗体内SOD活性变化动态
2.4 抗病和感病西瓜材料苗体内CAT酶活性的动态变化
由图3可以看出,不论在西瓜材料的叶片还是在根系组织中,所有处理西瓜材料的苗体内CAT酶活性差异不显著,感病材料与对照材料相比较,CAT酶活性变化略高,但均呈现出由高到低下降的变化趋势。
在受到枯萎病病菌侵染后,西瓜材料苗体叶片内CAT酶活性立即升到最大,野生抗性材料高于感病材料。在接种后第2天,抗病材料叶片内CAT酶活性变化基本保持不变,并且随着侵染时间的推移,下降趋势缓慢,而感病材料则表现为迅速下降,但表现不稳定,在接种后第8天,西瓜感病材料苗体内CAT酶活性达到最小值,以广西三号表现最突出。
在受到枯萎病病菌侵染后,西瓜材料苗体根系组织内CAT酶活性和叶片的相似,但是各个处理的CAT酶活性均小于叶片,且野生材料表现好于栽培材料,这也与前面进行的抗性鉴定试验结果相吻合。

图3接种枯萎病后西瓜苗体内CAT活性变化动态
3 小结与讨论
西瓜在逆境胁迫的条件下,体内会产生大量的超氧阴离子自由基、活性氧等,造成细胞膜的伤害,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等属于细胞膜保护酶,在清除活性氧中有重要功能。
POD参与木质素和植保素的合成,在植物抵抗病原物的侵入中起作用。有关过氧化物酶与植物抗病性的关系研究比较多,大多数研究结果表明,在植物与病原物互作中,不同类型的材料POD活性变化均表现出一定的差异,通常抗病材料的POD活性水平比感病材料POD活性水平高。本研究发现,在西瓜枯萎病的侵染病程中,野生材料叶片组织中POD活性从接种后第2天就显著高于对照,而感病材料则表现不显著,其峰值明显低于野生抗病材料。根系组织中POD活性在接种后第2天就有明显变化。这一试验结果说明POD在西瓜对枯萎病的抵抗中具有重要作用。在受枯萎病菌侵染后,抗病材料立即高效表达与POD相关的基因,合成POD及相关的酶系,因此POD的活性高峰到来得早,且峰值高、持续时间长,在宏观上表现为抗病。
超氧化物歧化酶(SOD)是需氧生物中普遍存在的一种含金属酶。它与过氧化氢酶、过氧化物酶等酶协同作用防御活性氧或其他过氧化物自由基对细胞膜系统的伤害;超氧化物歧化酶可以催化氧自由基的歧化反应,生成过氧化氢,过氧化氢又可以被过氧化氢酶转化成无害的分子氧和水。从结果中可以看出,在抗、感病材料中酶活性的变化及酶活性数量的增减,SOD酶和CAT酶并不相同,这说明植物体内活性氧的产生和消除是受SOD酶和CAT酶在内的多种酶的控制,而且不同酶间相互协调对植物的抗性反应起着十分重要的作用。
综合各种酶的变化规律,可以看出,在接种2 d后,POD酶、SOD酶和CAT酶活性变化,中抗材料在受到枯萎病病菌侵染后,比感病材料表现稳定。轻抗材料介于二者之间,相对于中抗材料,它的酶活性变化幅度要大,相对于感病材料,它恢复正常的时间要短。这也可能是由于抗病材料能尽快地接受病菌侵染信号并迅速传递、及时启动防卫反应的结果。
野生抗性材料在受到病原菌的侵染后,SOD酶和CAT酶活性的大小,均能在短时间内(接菌后2 d左右)基本恢复到原来的正常状态,而感病材料则发生恢复慢,甚至难以恢复到原来的正常状态,这说明材料是否抗病,POD、SOD和CAT酶活性的大小固然可以作为参考,但更为重要的是应看寄主在受到病原菌侵染后,POD、SOD和CAT酶活性能否通过自我调节而恢复到正常状态能力的大小,有关其自我调节、维持动态平衡的抗性机制有待作进一步的探讨。
[1]王金胜.农业生物化学技术[M].太原:山西科学技术出版社,1997.
[2]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[3]Elmstron G W,Hopkins D L.Resistance of water melon cultivars toFusarium wilt[J].Plant disease,1981(65):825-827.

