HGF抑制急性心肌梗死后心肌氧化损伤的实验研究
袁侨英,司良毅,李学军
(第三军医大学西南医院老年科,重庆400038)
1 材料与方法
1.1 实验仪器与材料 犬由重庆医科大学动物中心提供。大量质粒抽提试剂盒购于 TaKaRa公司(Japan)。HGF ELISA检测试剂盒购于中杉金桥公司。SOD及铜锌-超氧化物歧化酶(CuZn-SOD)活性测定试剂盒、H2O2测定试剂盒购于南京建成生物工程研究所。FA 1104电子天平(精确到0.000 1 g)购于上海精密科学仪器公司。
1.2 HGF裸质粒扩增及抽提 pcDNA3.0-HGF质粒含人全长肝细胞生长因子蛋白表达基因序列,将HGF质粒用氯化钙进行化学转化,细菌转化后挑单一菌落接种于含氨苄青霉素的5 m L LB液体培养基中,温和振荡摇菌(37℃、150 r/m in)12 h。收集菌液按照试剂盒说明书抽提质粒,酶切电泳鉴定证实为所需质粒无误后行菌种的大量培养扩增。大量抽提质粒,纯化去除污染和毒素;酶切鉴定证实为HGF质粒后溶解在生理盐水中备用,浓度为1.0 mg/m L。
1.3 动物模型的建立 实验动物经3%的戊巴比妥钠(30 mg/kg)腹腔麻醉后,取右侧卧位于手术台上,常规消毒铺单,行气管插管术,连接小动物呼吸机正压通气辅助呼吸,潮气量25~30m L/100 g体质量,呼吸频率 16~ 20次/min,吸呼比 1∶1。取胸骨正中切口开胸暴露心脏,剪开心包悬吊做心包吊床,在左室前下壁分离左冠状动脉前降支第一对角支,用4-0无创缝合丝线结扎冠脉第一对角支以下0.5 cm处,造成左室前壁和心尖部缺血,结扎后观察室壁颜色和ECG,若结扎区室壁变白,心电图ST段弓背抬高即判定为结扎成功。假手术组动物只穿线不结扎。
1.4 HGF基因注射过程 在建立犬AM I动物模型后,随机分为3组(n=5),分别为假手术组(S组)、M I组(M 组)、M I+HGF治疗组(HGF组)。HGF组在M I区域(左室前下壁及心尖)分5点进行心肌内注射 HGF基因,每点注射200μL(共1 000μg基因);待心跳稳定后,逐层缝合心包、胸壁,排气关胸。4周后摘取心脏,送液氮保存。
1.5 心肌形态观察 解剖心脏,肉眼大体观察有无心肌撕裂、穿孔、血肿等,HE染色光镜下观察心肌病理形态及微细结构的改变。
1.6 心脏质量指数测定 洗净心脏,沿室间沟切开左室(包括室间隔),右室,吸干水分,用FA 1104电子天平测量各部分质量。公式:左室心脏质量指数(LVWI)=左室心脏质量/体质量,右室心脏质量指数(RVW I)=右室心脏质量/体质量。计算左、右室心脏质量指数。
1.7 心肌SOD、CuZn-SOD活性及血清H2O2含量测定 用黄嘌呤氧化酶法测定血清、心肌SOD及 CuZn-SOD活性;H2O2与钼酸作用生成络合物,以比色法测定血清H2O2含量。1.8 统计学方法 数值采用±s表示。采用 SAS6.12统计软件分析,两组间行t检验,多组间用方差分析作q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 质粒抽提结果 经细菌培养扩增,抽提的 HGF质粒DNA经ApaⅠ酶切、电泳,得其酶切鉴定图谱。经ApaⅠ酶切后质粒DNA线性化,显示一条带,其大小为7.6 kb(对照为M arker),均符合pcDNA 3.0-HGF的长度,纯化去除污染和毒素。
2.2 巨体病理观察 术后4周LAD结扎部位以下,M I模型犬均见沿左室前降支走行的左室心肌呈灰白色,形状不规则;除S组外,其他各组动物均可见手术部位心包粘连。M I模型犬均形成透壁性心肌梗死,累及左室游离壁大部分,梗死区心肌为灰白色菲薄瘢痕组织代替,质硬。S组心脏形态正常。
2.3 心肌HE染色光镜下观察 (1)M组:梗死区心肌细胞和间质组织均发生凝固性坏死,伴有较广泛肌溶解及心肌细胞空泡变性,坏死心肌细胞被嗜伊红浓染的纤维组织替代,交界区心肌呈现液化性肌溶解表现,心肌细胞坏死、消失;另有部分心肌细胞增生肥大,伴有大量炎症性细胞浸润。(2)S组:心肌纤维结构清楚,排列整齐,无心肌细胞和间质组织坏死,无炎性细胞浸润和大小血管增生。(3)HGF组:所有标本均可见明显梗死区,交界区见心肌细胞肥大增生,纤维增生较明显、排列紊乱,心肌间质内有较多淋巴细胞浸润,非梗死区心肌细胞代偿性肥大。
2.4 HGF对心室重塑的影响 M组与S组相比,LVW I、RVW I升高(P<0.01),与 M 组相比,HGF组 LVW I、RVW I降低(P<0.01)。见表1。
表1 HGF对左室重塑的影响(±s,n=5)

表1 HGF对左室重塑的影响(±s,n=5)
与S组比较,*:P<0.01;与M 组比较,▲:P<0.05。
指标 S组 M组 HGF组LVW(g) 70.20±6.7 84.80±8.6* 77.50±11.2▲RVW(g) 12.20±1.9 15.20±1.8* 14.20±1.7▲LVW I(g/kg) 4.92±0.62 7.72±1.18* 6.51±1.08▲RVW I(g/kg) 0.82±0.04 1.35±0.15* 1.28±0.18▲BW(kg) 14.70±3.2 11.50±2.9 11.90±3.3
表2 HGF对血清和心肌 SOD、CuZn-SOD活性及血清H2O2含量的影响(±s)
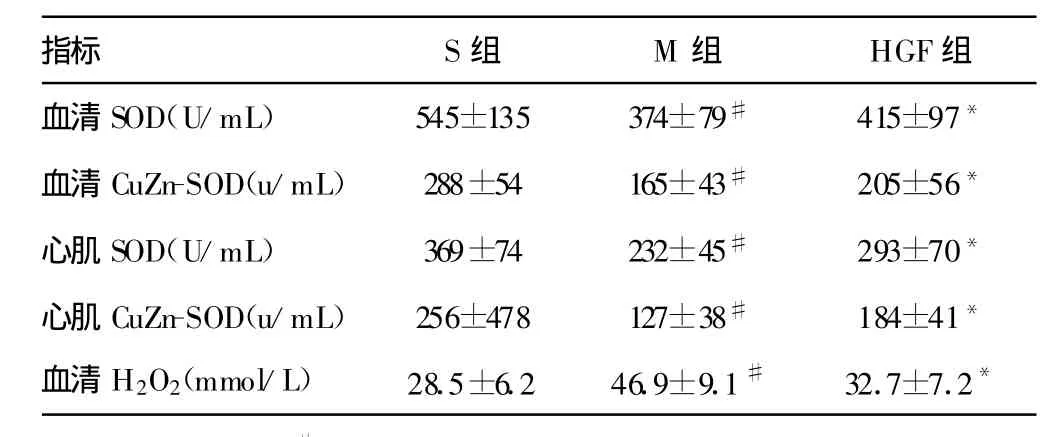
表2 HGF对血清和心肌 SOD、CuZn-SOD活性及血清H2O2含量的影响(±s)
与S组比较,#:P<0.01;与M 组比较,*:P<0.01。
指标 S组 M组 HGF组血清SOD(U/m L) 545±135 374±79# 415±97*血清CuZn-SOD(u/m L) 288±54 165±43# 205±56*心肌SOD(U/m L) 369±74 232±45# 293±70*心肌CuZn-SOD(u/m L) 256±478 127±38# 184±41*血清H2O2(mmol/L) 28.5±6.2 46.9±9.1# 32.7±7.2*
2.5 HGF对血清和心肌SOD、CuZn-SOD活性及血清H2O2含量的影响 M组心肌、血清SOD及CuZn-SOD活性降低(P<0.01),血清 H2O2含量升高(P<0.01);HGF组较 M 组心肌、血清SOD及CuZn-SOD活性升高(P<0.01),H2O2含量下降(P<0.01)。见表2。
3 讨 论
氧自由基可以攻击生物膜,引发脂质过氧化,损伤内皮细胞,参与动脉粥样硬化、缺血性心肌疾病的整个病理生理病程。O2-自由基的金属酶有保护细胞膜及脏器不受自由基损伤的生理功能,保护细胞,对抗氧自由基的毒性、调节H2O2浓度。研究表明,SOD也具有抗炎活性,能够改善心肌能量代谢,保护左室功能,可改善缺血时左室收缩及舒张功能。SOD活性降低是自由基损伤血管内皮细胞、心肌细胞的重要因素。
心肌缺血时自由基生成增加,动物实验表明急性心肌缺血后15m in氧自由基即明显增加,引发心肌产生补体与炎性反应损伤心肌[4-5],使心肌舒缩功能下降,参与心力衰竭的形成、发展。近年研究发现,HGF是一种多功能因子,对多种组织器官的生长发育有重要的生理调节功能,可以通过抗细胞凋亡,促进组织细胞的发生、生存和再生,刺激新生血管生成,抗纤维化,减轻心肌缺血再灌注损伤等多种功能,发挥多种有益的心血管保护作用,对心肌缺血有治疗作用[6-7]。
直接注射HGF蛋白能减少梗死面积和改善心脏功能,而阻断内源性HGF表达,导致梗死面积扩大,表明HGF对缺血性M I的治疗效果是通过保护心肌细胞和促进血管的形成实现的。本实验发现,HGF质粒能够在缺血心肌中很好的表达,HGF改善心室重塑和心功能的同时,血清H2O2含量降低,心肌及血清SOD活性升高,提示HGF改善心功能的机制还可能与其增强SOD活性、抑制氧化损伤相关。
总之,HGF提高血液及心肌局部SOD、CuZn-SOD活性,使O2-和 H2O2生成减少,抑制AM I后心肌氧化损伤,改善心室重塑和心功能。
[1]Lucchesi BR.M yocardial reperfusion injury ro le o f free radica ls and mediators o f in flammation.Heart physio logy and pathophysiology[M].4th ed.San Diago:Academ ic Press,2001:1181.
[2]Huang N.ESR measurement of oxygen free radical genedogion in ischem ic reperfused myocardium and scavenging effectof some drugs,and Japan-China Bilateral ESR symposium(abstracts)[M].Japan,Kyoto,1989:107.
[3]Ross R.The pathogenesis of atherosclerosisan update[J].N Eng JMed,1986,314:488.
[4]Ahmet I,Saw a Y,Yamaguchi T,et al.Gene transfer of hepatocyte factor imp roves angiogenesis and function of chronicischem ic myocardium in canine heart[J].Ann Thorac Surg,2003,5(4):283.
[5]Cartw right JE,T se WK,W hitley GS,et al.Hepatocy te grow th factor induced human trophoblast motility involves phosphatidy linosital-3-kinase,mitogen activated protein kinase,and induciblenit ricoxide synthase[J].Experimental Cell Res,2002,279:219.
[6]Nakamura T,M izuno S,Matsumoto Ket al.Myocardial protection from ischem ia reperfusion injury by endogenous and exogenous HGF[J].JClin Invest,2000,106:1511.
[7]Azuma J,Taniyama Y,Takeya Y,et al.Angiogenic and antifibrotic actions o f hepatocy te grow th factor im prove cardiac dysfunction in porcine ischem ic cardiomyopathy[J].Gene Ther,2006,13:1206.

