延胡索总生物碱的提取纯化工艺研究
王绪颖, 贾晓斌, 陈 彦
(1.江苏省中医药研究院中药新型给药系统重点实验室,国家中医药管理局中药口服释药系统重点研究室,江苏南京210028;2.江苏大学药学院,江苏镇江212013)
延胡索为罂粟科植物延胡索(Corydalis yanhusuo W.T.Wang)的干燥块茎,主产地浙江,为著名的浙八味之一,具有活血化瘀、理气止痛功效。现代药理研究表明延胡索中主要有效组分延胡索总生物碱具有镇痛、抗溃疡、抑制胃酸分泌、解痉及增加冠脉血流量,抗心律失常等作用[1],总生物碱中延胡索乙素的镇痛作用最强[2]。文献中提取纯化延胡索总生物碱,通常以延胡索乙素或总生物碱为指标[3-6],而同时以延胡索乙素和延胡索总生物碱为指标的则未见报道。
本实验以延胡索乙素和总生物碱的含量为指标,以正交试验优选延胡索总生物碱的乙醇回流提取方法,以延胡索乙素和延胡索总生物碱的比吸附量和比洗脱量为指标筛选出最佳纯化树脂,并考察其纯化延胡索乙醇提取液的工艺条件及参数,为延胡索总生物碱的工业化生产提供切实的理论依据和条件。
1 仪器与材料
Agilent 1100高效液相色谱仪;十万分之一电子天平(METTLER TOLEOR公司);UV-2802型紫外可见分光光度计(上海尤尼克仪器有限公司);DZF-6051真空干燥箱(上海精宏实验设备有限公司);DK-S26型恒温水浴锅(上海精宏实验设备有限公司)。
树脂购自上海摩速科学器材有限公司;延胡索乙素对照品(批号:0726-200208,供含量测定用,由中国药品生物制品检定所提供);醋延胡索(批号:080201,南京药业股份有限公司中药饮片厂),经江苏大学药学院欧阳臻教授鉴定为罂粟科延胡索(Corydalis yanhusuo W.T.Wang)的醋制品;甲醇、磷酸为色谱纯,水为超纯水,其余试剂均为分析纯。
2 方法与结果
2.1 延胡索乙素含量测定
2.1.1 色谱条件与系统适用性实验 色谱柱Agilent HC-C18(150 mm × 4.6 mm,5 μm);流动相MeOH-0.1%H3PO4(三乙胺调节 pH=6)57 ∶43;流量:1.0 mL/min;检测波长:280 nm。理论板数以延胡索乙素计不低于5 000,延胡索乙素色谱峰与相邻未知色谱峰的分离度>1.5,色谱图见图1。
2.1.2 标准曲线的绘制 精密称取延胡索乙素对照品3.42 mg至10 mL量瓶中,用流动相溶解并稀释至刻度,摇匀,即得每1 mL含延胡索乙素0.342 mg的对照品贮备液;分别精密吸取贮备液0.1、0.2、0.4、0.8、1.0 mL 至 5 mL 量瓶,用流动相稀释至刻度,摇匀;分别精密吸取上述对照品溶液20 μL进样,测得峰面积积分值。以对照品溶液的进样量为横坐标,峰面积积分值为纵坐标,绘制标准曲线,得回归方程 Y=45.674X+27.791,r=0.999 9,结果表明,延胡索乙素进样量在0.136 8~1.368 μg与峰面积有良好的线性关系。
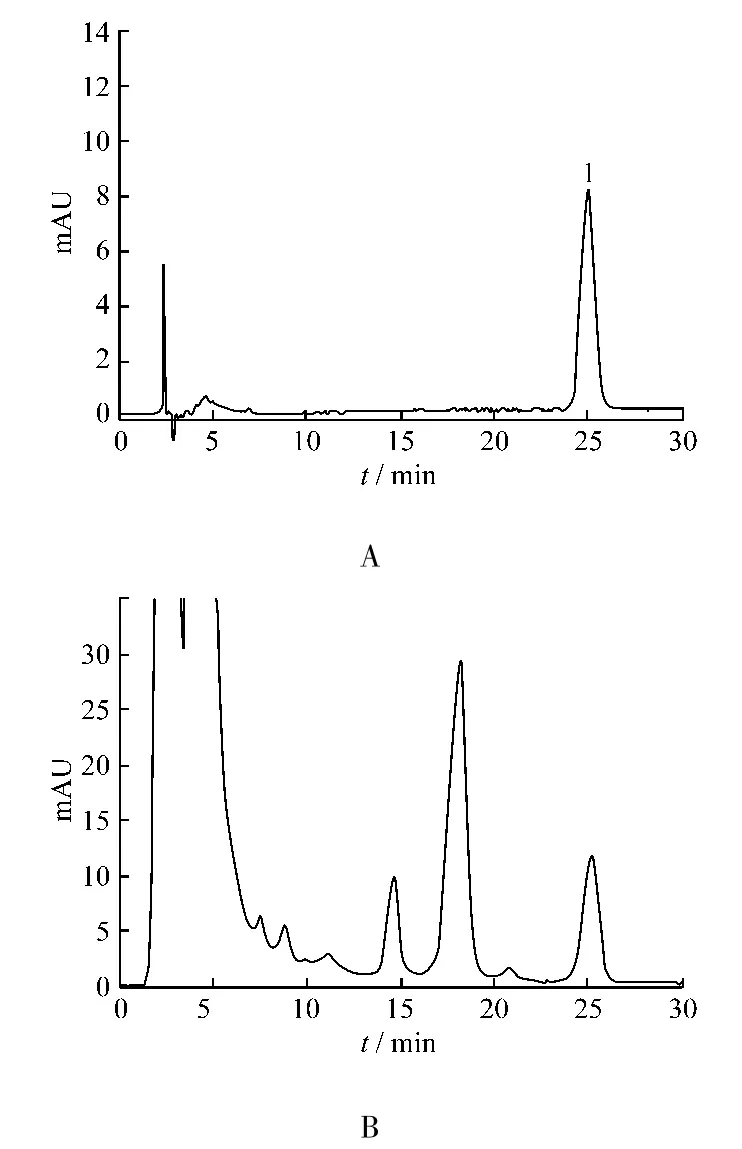
图1 延胡索乙素对照品(A)与样品(B)HPLC色谱图,1为延胡索乙素
2.1.3 样品的含量测定 吸取适量提取液或树脂冲出液水浴挥干,用甲醇定容至5 mL,用0.45 μm的微孔滤膜滤过,取续滤液,精密吸取20 μL进样,计算其含量。
2.2 延胡索总生物碱含量测定
2.2.1 对照品溶液制备 精密称取延胡索乙素对照品2.22 mg至10 mL量瓶中,用pH4.5的乙酸-醋酸钠缓冲液溶解并稀释至刻度,摇匀,即得每1 mL含延胡索乙素0.222 mg的对照品溶液。
2.2.2 显色方法及检测波长的确定[7]精密吸取对照品溶液0.3 mL,至预先精密加入氯仿10 mL的分液漏斗中,再加0.7 mL pH4.5的醋酸-醋酸钠缓冲液,精密加入4 mL溴甲酚绿溶液,振摇3 min,静置40 min,分取氯仿层,用UV-2802型紫外可见分光光度计进行全波长扫描,在414 nm处有最大吸收峰,故选择检测波长为414 nm。
2.2.3 标准曲线的绘制 精密吸取对照品溶液0.0、0.1、0.2、0.3、0.4、0.5 mL,置预先精密加入氯仿10 mL的分液漏斗中,再分别加1.0、0.9、0.8、0.7、0.6、0.5 mL pH4.5 的醋酸-醋酸钠缓冲液,精密加入4 mL溴甲酚绿溶液,振摇3 min,静置40 min,分取氯仿层,在414 nm波长处测定吸光度,以对照品溶液的体积为横坐标,吸光度为纵坐标,绘制标准曲线,得回归方程为Y=60.798X-0.003 4,r=0.999 3,表明对照品浓度在0.002 22~0.011 1 mg/mL与吸光度之间呈良好的线性关系。
2.2.4 样品的含量测定 取适量提取液或树脂冲出液水浴挥干,用pH4.5的醋酸-醋酸钠缓冲液定容至5 mL量瓶中,精密吸取1mL,按标准曲线项下同法操作,测定吸光度,计算其含量。
2.3 正交试验优选延胡索的乙醇提取工艺
延胡索具有镇痛止痛等功效,其主要药效物质基础生物碱类组分易溶于乙醇和酸水中,经过醋制后生物碱成盐又能溶于水中,所以提取溶剂选择含水乙醇。设计正交试验进一步考察乙醇回流提取工艺,根据延胡索总生物碱的性质,以水、30%乙醇、50%乙醇、70%乙醇、90%乙醇为提取溶剂,进行平行性试验,分别测定提取液中延胡索乙素和总生物碱的含量(mg/g生药),试验结果延胡素乙素含量分别为:0.115、0.232、0.419、0.308、0.197 mg/g生药,总生物碱含量分别为:1.924、3.437、7.654、4.502、2.585 mg/g生药,所以选择30%、50%、70%乙醇作为正交试验因素乙醇浓度的三个水平。对影响乙醇回流提取的主要影响因素:乙醇浓度、溶剂用量、回流提取时间和提取次数按四因素三水平表L9(34)进行正交试验,各因素水平见表1,按正交试验表安排试验,平行2次,试验结果见表2、表4,并对延胡索乙素和总生物碱的含量进行方差分析,结果见表3、表5。

表1 正交试验因素水平
2.3.1 正交试验样品制备 分别精密称取9份延胡索药材,每份100 g,按正交试验表各行各列条件制备样品提取液,按含量测定项下制备样品溶液。
2.3.2 正交试验结果 以延胡索乙素含量为考察指标,由表2直观分析表明影响延胡索乙素含量的主要因素为A,次要因素为D、C、B,方差分析表明A、D因素对延胡索乙素的含量有显著意义(P<0.01),B、C因素无显著意义,最佳组合为A2B3C3D3。以延胡索总生物碱含量为考察指标,表4直观分析表明影响延胡索总生物碱含量的主要因素为A,次要因素为D、C、B,方差分析表明A因素对延胡索总生物碱的含量有显著意义(P<0.01),B、C、D因素无显著意义,最佳组合为A2B2C2D3。
不同考察指标下A、D的最佳条件为A2D3,B、C有差别,方差分析表明B、C无显著意义,综合生产实际,选择B2C2,确定工艺条件为A2B2C2D3。

表2 正交试验结果1(延胡索乙素含量指标n=2)
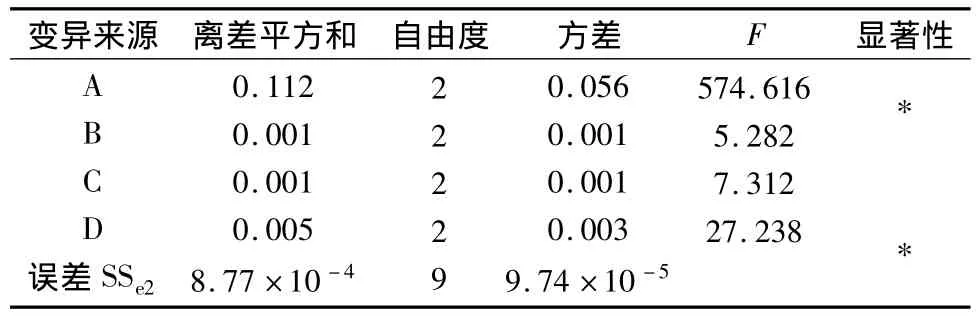
表3 延胡索乙素含量方差分析

表4 正交试验结果2(延胡索总生物碱含量指标n=2)
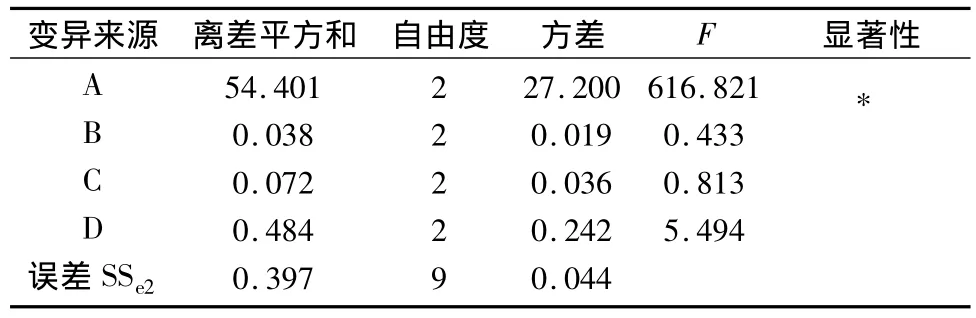
表5 延胡索总生物碱含量方差分析
2.3.3 验证试验 为进一步考察优选工艺的可靠性及稳定性,取3份药材,每份1 000 g,用6倍量50%乙醇,加热回流提取3次,每次2 h,然后分别测定各样品中延胡索乙素和总生物碱含量,结果见表6。
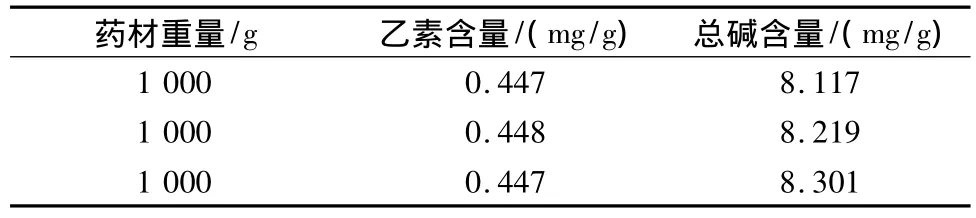
表6 验证试验结果
2.4 延胡索总生物碱纯化工艺研究
延胡索生药经正交试验优化的最佳工艺提取后总生物碱的转移率达85.6%,但得到的浸膏不容易干燥成粉,可能含较多水溶性多糖、果胶、黏液质及醇溶性油脂等,不利于制剂成型以及质量控制。本实验以延胡索总生物碱和延胡索乙素含量为指标,用大孔吸附树脂法对延胡索乙醇提取物进一步纯化,筛选出延胡索生物碱的大孔树脂分离富集工艺条件,为下一步制剂成型奠定技术基础。
2.4.1 样品制备 延胡索用6倍量50%乙醇,回流提取3次,每次2 h,合并滤液浓缩至1 g/mL,测得延胡索乙素含量为0.447 mg/g,延胡索总生物碱含量为8.212 mg/g。
2.4.2 树脂预处理 先用2 mol/L NaOH浸泡5 h,用蒸馏水洗至中性。再用3 mol/L盐酸浸泡8 h,用蒸馏水洗至中性。最后用95%乙醇浸泡24 h,充分溶胀,用95%乙醇洗至流出液加5倍水无白色浑浊,再用蒸馏水反复清洗至无醇气味,用蒸馏水浸泡后待用。
2.4.3 树脂型号确定 采用动态吸附法,比较四种树脂对延胡索乙素和总生物碱的比吸附量、比洗脱量,优选出最佳树脂。
称取处理好的 AB-8、D101、HPD600 和 X-5 四种型号的湿树脂各5.00 g,湿法装柱,上样53.00 mL,平行上样3份,调节流速为0.5 mL/min,过柱流出液重吸附2次,静置4 h,用蒸馏水洗至流出液无色,以70%乙醇洗脱10倍柱体积,分别用HPLC法和UV法测定流出液中延胡索乙素和总生物碱的含量,并分别计算比吸附量、比洗脱量,结果见表7、表8。
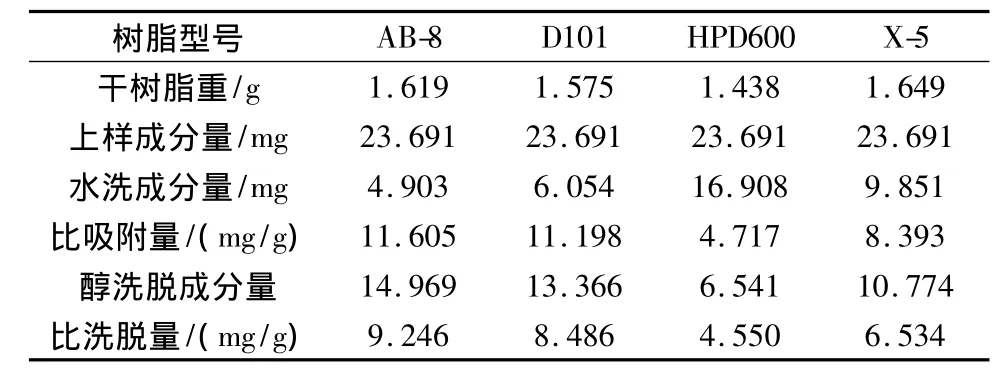
表7 4种型号大孔吸附树脂对延胡索乙素的动态吸附性能比较(n=3)
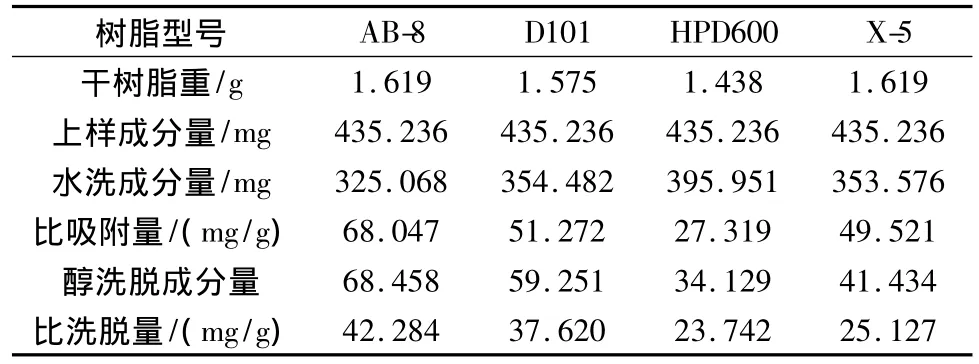
表8 4种型号大孔吸附树脂对延胡索总生物碱的动态吸附性能比较(n=3)
由表7可知,树脂AB-8对延胡索乙素的比吸附量为11.605 mg/g,10 BV70%乙醇比洗脱量为9.246 mg/g,均为4种树脂中最大,折合生药量每克干树脂吸附25.962 g生药。由表8可知,树脂AB-8对延胡索总生物碱的比吸附量为68.047 mg/g,10BV70%乙醇比洗脱量为42.284 mg/g,均为4种树脂中最大,折合生药量每克干树脂吸附8.286 g生药。
不同考察指标下均筛选出AB-8为最佳树脂,但不同考察指标下树脂对生药的比吸附量不同,其中延胡索乙素折合生药的树脂比吸附量远大于延胡索总生物碱折合生药的树脂比吸附量,为尽量保留有效组分,选择以延胡索总生物碱为指标下的饱和吸附量作为生药的最佳吸附量,即8.286 g/g。
2.4.4 水洗体积确定 按延胡索总生物碱的饱和吸附量上样,精密吸取样品液(1 g/mL)8.29 mL加至已处理好的装有5 g湿AB-8大孔吸附树脂柱,调节流速为0.5 mL/min,过柱流出液重吸附2次,静置4 h,用蒸馏水洗脱,每1 BV收集在一起,分别用Molish反应检测,第6 BVMolish反应阴性,证明不吸附的杂质已基本洗脱完全,确定上柱后水洗体积为6 BV。
2.4.5 洗脱溶剂浓度确定 按延胡索总生物碱的饱和吸附量上样,精密吸取样品液(1 g/mL)8.29 mL加至已处理好的装有5 g湿AB-8大孔吸附树脂柱,调节流速为0.5 mL/min,过柱流出液重吸附2次,静置4 h,用蒸馏水洗脱至流出液无色,依次用40%乙醇、50%乙醇、60%乙醇、70%乙醇、80%乙醇、90%乙醇各10 BV洗脱,洗脱液流速为1.0 mL/min,测定洗脱液中延胡索乙素和总生物碱的量并分别计算洗脱百分率,结果见表9。

表9 洗脱溶剂浓度的确定
由表9可知,随着乙醇体积分数的增加,AB-8树脂对延胡索乙素和延胡索总生物碱的累积洗脱率逐渐增大,但90%乙醇洗脱的量增加的很少,综合生产实际选择80%乙醇作为洗脱溶剂。
2.4.6 洗脱溶剂体积确定 按延胡索总生物碱的饱和吸附量上样,精密吸取样品液(1 g/mL)8.29 mL加至已处理好的装有5 g湿AB-8大孔吸附树脂柱,调节流速为0.5 mL/min,过柱流出液重吸附2次,静置4 h,用蒸馏水洗脱6倍柱体积,用80%乙醇洗脱,按 1 BV、2 BV、3 BV、4 BV、5 BV、6 BV、7 BV、8 BV、9 BV、10 BV、11 BV、12 BV、13 BV、14 BV、15 BV、16 BV进行收集,绘制洗脱曲线。分别测定延胡索乙素和总生物碱的含量,并分别以延胡索乙素和总生物碱的比洗脱量为纵坐标(mg/g),洗脱柱体积(BV)为横坐标绘制延胡索乙素和总生物碱的洗脱曲线,见图2。
由图2可知,第11 BV80%的乙醇已经基本洗脱不到延胡索乙素和总生物碱,所以选择10 BV作为洗脱溶剂的最佳洗脱体积。
2.4.7 验证试验 为进一步考察优选工艺的可靠性及稳定性,吸取82.86 mL样品液,按上述确定的最佳工艺条件,加至已处理好的装有50 g湿AB-8大孔吸附树脂柱,调节流速为0.5 mL/min,过柱流出液重吸附2次,静置2 h,用蒸馏水洗脱6倍柱体积,用80%乙醇洗脱10 BV,收集乙醇洗脱液,回收乙醇,80℃真空干燥。测定延胡索乙素和延胡索总生物碱含量及各自占干膏的比例。结果见表10。
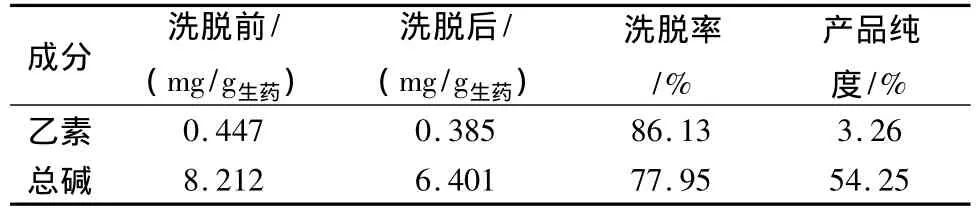
表10 验证试验结果
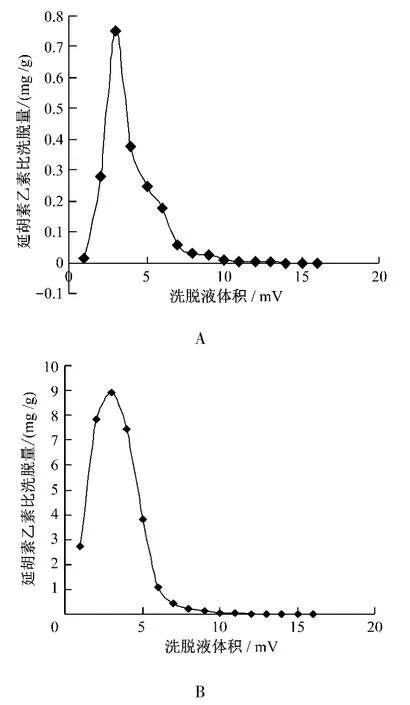
图2 80%乙醇洗脱曲线,A为延胡索乙素指标,B为延胡索总生物碱指标
3 结论与讨论
乙醇回流提取延胡索的最佳工艺条件是6倍量50%乙醇,加热回流提取3次,每次2 h;AB-8树脂纯化延胡索乙醇提取液的最佳工艺条件是每克干树脂吸附8.286 g生药,上柱后水洗6 BV,80%乙醇洗脱10 BV。该工艺经验证,总生物碱的提取转移率达85.6%,纯化转移率达77.95%,终产品总生物碱纯度为54.25%,该工艺稳定可靠,可较好的提取纯化延胡索中总生物碱。
在筛选上柱液最佳pH的试验中,发现将上柱液pH调为碱性时有沉淀析出,且碱性越强,产生沉淀越多,易堵塞树脂柱,不利于树脂柱的吸附。pH调为酸性时虽然比吸附量增大,但比洗脱量下降,而因为实验所用的延胡索为醋制,上柱原液pH为5.20,比吸附量和比洗脱量都较大,所以上柱液最佳pH确定为原液pH。
[1]黄泰康.常用中药成分与药理手册[M].北京:中国医药科技出版社,1994:874.
[2]马胜兴,陈可冀.延胡索研究概况[J].中西医结合杂志,1985,5(12):758.
[3]胡季强,王如伟,邱红英,等.大孔树脂分离纯化延胡索总生物碱的工艺研究[J].中国现代应用药学杂志,2009,26(4):271-273.
[4]卢耀文,杨中林.延胡索乙素提取工艺优选研究[J].中成药,2008,30(8):1247-附1.
[5]黄诺嘉.珍杉理胃片中延胡索生物碱提取工艺的研究[J].中成药,1999,21(12):622-623.
[6]刘俊红,魏峻峰,王洪志,等.大孔吸附树脂在延胡索生物碱提取分离中的应用[J]. 中草药,2002,33(1):73-83.
[7]周毅玲.酸性染料比色法测定延胡索总生物碱的量[J].中草药,2008,39(8):1257-1258.

