铜离子选择电极络合滴定法分步滴定锌和镁
乐 薇,尹 权,2*
(1中南民族大学工商学院环境与生命科学系,武汉430065;2武汉大学分子与化学学院,武汉430072)
铜离子选择电极在EDTA络合滴定中的应用已有报道,如Cu2+、A l3+、M g2+、Fe2+、Co2+等金属离子含量的测定[1-5],但上述报道中除Cu2+可直接滴定外,多数离子测定或需经一定处理(如分离、采用多种滴定剂[2]),或利用返滴定[5]等方法.本文选择Zn2+、M g2+离子,在氨性缓冲介质中,以铜离子选择电极为指示电极,以Cu-EDTA为置换剂,通过控制体系中游离氨的浓度,当共存离子浓度大致相同时,其条件稳定常数相差105倍时,可采用电位滴定法对M g2+、Zn2+进行连续滴定.此法仅需EDTA一种滴定剂,且通过加入Cu-EDTA增大滴定突跃范围,可提高滴定准确度.______________
1 实验部分
1.1 仪器
PCu-1Q 9型铜离子选择电极(上海罗素科技有限公司),217型饱和甘汞电极(上海雷磁仪器厂),PHS-25型数字酸度/离子计(上海理达仪器厂)
1.2 试剂
Zn2+标准溶液:0.039 96m o l/L,用纯金属锌片(质量分数x≥99.9%)溶于盐酸配制而成;M g2+标准溶液0.039 97 m o l/L;ED TA标准溶液0.020 68 m o l/L;1+3氨水;pH=10氨性缓冲液(1.5m o l/L NH3-0.38m o l/L NH 4C l);Cu-EDTA溶液0.05m o l/L(Cu与EDTA的物质量比为1∶1).以上试剂均为分析纯.
1.3 实验方法
准确移取10.00m L的0.200m o l/L Zn2+-0.200 m o l/L M g2+混合溶液,滴加氨水至溶液刚好有沉淀生成后加入pH=10的氨性缓冲液,再加入0.05m o l/L Cu-EDTA 3.0m L,加水至30m L,用EDTA 滴定,以饱和甘汞电极为参比电极,铜离子选择电极为指示电极,记录电位值的变化,待电位值突跃后再向上述体系滴加少量氨水,使体系酸度维持在pH≈10.4,继续用EDTA 滴定,记录电位值的变化,然后以电位(E)为纵坐标,EDTA 体积(V)为横坐标,绘制滴定曲线.
2 结果与分析
2.1 置换剂的影响
经实验证明在滴定过程中铜离子选择电极对Zn2+的响应较大,但对M g2+响应较小,很难观察到化学计量点(sp)时的突跃,故考虑采用置换剂提高其滴定突跃范围.本实验对Cu-EDTA用量对滴定突跃的影响进行了研究,其结果见图1.
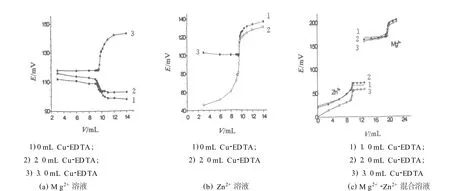
图1 Cu-EDTA用量对EDTA滴定离子溶液的滴定曲线的影响Fig.1 Effect o f Cu-EDTA on the titration cu rve fo r the ion so lu tionsw ith EDTA
可见,加入Cu-ED TA 后,M g2+、Zn2+的滴定突跃均增大因为当加入少量Cu-EDTA作为置换剂后,溶液中大量的M g2+、Zn2+能置换出Cu2+,而铜离子选择电极对Cu2+灵敏,故可增大突跃,其机理与间接指示剂相同.又因为锌离子与EDTA络合的稳定常数lgK=16.50远远大于镁离子与EDTA的络合稳定常数lgK=8.7,故对二者的影响各异.
对于M g2+溶液(见图1a),未加Cu-EDTA 时,在sp前后,电位值呈缓慢下降趋势;当其用量为2.0m L时,下降趋势减弱;而当其用量增至3.0m L时,在sp前,此时电位值无明显变化,当到达sp时,电位值发生突跃,滴定终点易于观察;继续增大其用量,滴定突跃及滴定曲线与3.0m L用量的结果相似(未作图).对于Zn2+溶液(见图1b),加入Cu-EDTA 后,滴定突跃范围增大,当其用量提高至2.0m L后,突跃范围不再变化(未作图).对于M g2+、Zn2+混合溶液,Cu-EDTA 的影响与单一离子相比不同.未加Cu-EDTA 时,Zn2+、M g2+的突跃不明显;加入Cu-EDTA 后,其用量对Zn2+的影响大于对M g2+的影响(见图1c),经研究发现,Cu-EDTA 用量增至3.0m L以后,Zn2+、M g2+的突跃范围增加不明显.因此,在后续实验中,Cu-EDTA的用量选择3.0m L(即Cu-EDTA的浓度为0.005 m o l/L).
2.2 氨用量的影响
在络合滴定中,体系的酸度影响很大.M g2+在pH>10的情况下才能准确滴定[6],因此一般选择的缓冲体系是氨性缓冲液.但氨水用量增加虽可增大体系pH,但同时也会增大Zn2+的副反应.因此,氨用量控制不当,则达不到M g2+、Zn2+分步滴定的目的.所以,本实验控制溶液中游离氨的浓度先滴定Zn2+,再增加氨水用量提高体系pH滴定M g2+.至此达到连续滴定Zn2+、M g2+的效果.
由此也可知,滴定中Zn2+、M g2+离子浓度相差不宜太大.其原因是两者浓度相差太大(如5倍以上),同一种EDTA滴定剂的用量不同,滴定最终体积不同,致使所需加入氨性缓冲液和氨水的量不同,对滴定带来不便.
2.2.1 氨的用量对ED TA滴定Zn2+的影响
Zn2+溶液的配制是以适量HC l溶解Zn片得到,故先滴加少量氨水使体系刚好有沉淀产生,此时剩余的盐酸已被中和,体系pH≈6,再加入不同体积的氨性缓冲液,考察其用量对EDTA滴定Zn2+的影响,结果见表1.

表1 氨性缓冲液的用量对EDTA滴定Zn2+的影响Tab.1 Effectof amm on ia buffer so lu tion to titration of Zn2+
可知,当加入的氨性缓冲液为1.5m L时,效果最好;当缓冲液的用量小于1.5m L时,由于Zn(OH)2的生成,故有沉淀产生,不能进行滴定;当缓冲液的用量大于1.5m L时,溶液澄清,但氨的浓度增大,则pH值增大,使体系的酸效应系数αY(H)减小,同时导致Zn2+的副反应系数αZn(NH3)增大.由下列关系式可计算出游离氨的最适浓度约为0.01m o l/L.
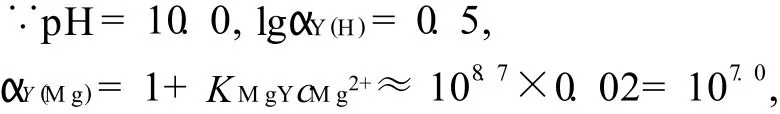
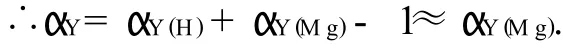
由于Zn2+能准确滴定的界限为即
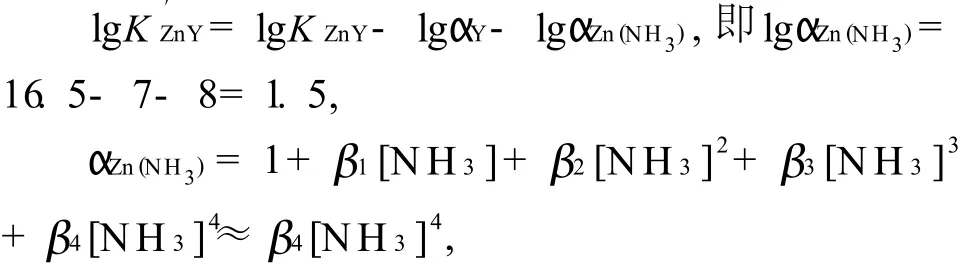
根据氨性溶液中氨的浓度和Zn2+络合耗去的氨的浓度可确定实验中氨性缓冲液选用1.50m L比较合适,理论计算与实验结果一致.
2.2.2 氨用量对EDTA 滴定M g2+、Zn2+混合体系的影响
先在混合体系中滴加氨水至刚好有沉淀生成,再加入pH=10的氨性缓冲液和Cu-ED TA 后滴定Zn2+,待出现第一个滴定突跃后加入不同体积的氨水或氨性缓冲溶液调节体系酸度,对实验数据进行一阶微商处理,得到ΔE/ΔV-V图(图2),并将各体系的pH 与(ΔE/ΔV)max的关系列于表2 中.
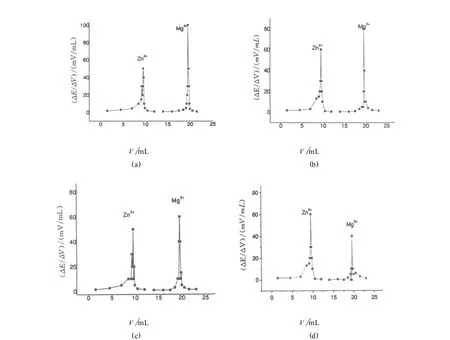
图2 EDTA 滴定M g2+、Zn2+混合离子溶液的ΔE/ΔV-V图Fig.2 ΔE/ΔV-V curve fo r the titration o fm ixed ion so lu tionw ith EDTA
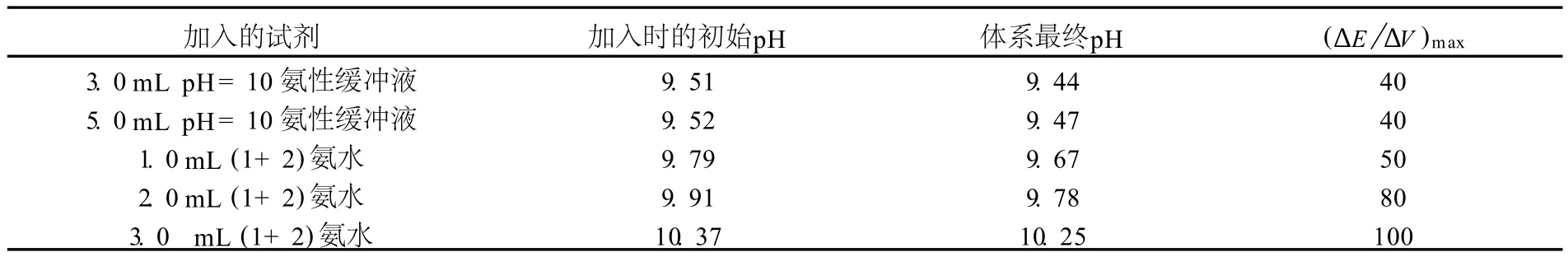
表2 滴定M g2+时体系pH 与(ΔE/ΔV)max的关系Tab.2 Relationsh ip betw een pH and(ΔE/ΔV)maxo fM g2+titration
可见,增加氨的用量,pH 增高,ΔE/ΔV增大,有利于M g2+滴定终点的观察.当(1+2)氨水的用量大于3.0m L时,体系pH 略增大,但ΔE/ΔV-V提高不明显.故(1+2)氨水的用量为3.0m L(或滴加氨水至体系pH≈10.4).
2.3 干扰试验
在选定实验条件下,对常见重金属离子如Fe3+、Pb2+、Hg2+、Cu2+、A l3+等的干扰情况进行了研究,实验结果表明,H g2+干扰严重,Cu2+、Fe3+、A l3+、Pb2+的干扰较重,少量的Fe3+及A l3+可加入适量的三乙醇胺消除其干扰.
2.4 模拟样品分析
以基准试剂配制Zn、M g的混合溶液,按试验方法测定,分别求出Zn、M g元素的质量,并与标准值相比较,如表3所示.可见,此法测定Zn、M g的结果较好.

表3 模拟试样分析结果Tab.3 Resu lts fo r Sim u lation Sam p les(n=5)
3 结论
已报道的用铜离子选择电极络合滴定金属离子(如Cu2+、A l3+、Fe3+、Co2+等)大多以通过控制酸度直接滴定,或经处理后采用间接方法进行滴定,而本实验则通过控制副反应系数αZn(NH3)而达到直接分别滴定的目的.本法可适用于含Zn2+、M g2+浓度相差不太大的试样分析,如有其它重金属存在,应先进行分离或加入适当的掩蔽剂消除干扰.
[1] 王孝熔,陈 静,李艳萍.离子选择性电极法测定酸性镀锌液中的铜[J].电镀与精饰品,2003,25(2):30-32.
[2] 陈兆鹏,张正奇,朱元保,等,铜离子选择电极在连续测定人发中微量铜(Ⅱ)、锌(Ⅱ)的应用[J].化学传感器,1992,12(2):61-63.
[3] 王 磊.铜电极电位滴定法测定氢氧化镁[J].无机盐工业,2004,36(5):58-59.
[4] 张 云,孙 健,于雪涛,等,非平衡态-恒电位配位滴定法同时测定铁和铝[J].分析化学,2005,33(12):1 764-1 766.
[5] 李习纯,络合电位滴定法连续测定矿石中铜、钴和镍[J].冶金分析,1994,14(2):41-42.
[6] 武汉大学.无机及分析化学[M].2版.武汉:武汉大学出版社,2003,407.

