银杏叶提取物类脂质体的体外释放度和体内药效学的研究
张炜煜, 金 叶, 滕利荣*, 范 里
(1.长春中医药大学,吉林长春130117;2.吉林大学,吉林长春130000)
银杏叶提取物(Ginkgo biloba Extract,GbE)是从银杏科银杏属植物银杏的干燥叶中提取纯化而成的一种淡黄色粉状物质,具有改善心脑血管循环、保护肝脏、改善记忆、抗炎、抗过敏、提高机体免疫功能等作用,由于其疗效显著、副作用低,现已成为欧美及世界各地治疗老年疾病的畅销产品[1]。类脂质体具有类似脂质体封闭的双层结构,且不易泄漏[2];粒径较小的的类脂质体(<150nm),不容易被巨噬细胞吞噬,可以延长在体内的循环时间,具有优良的组织通透性,尤其可在有渗漏性血管组织(肿瘤、炎症区或梗死区等)聚集;类脂质体不易被肾排泄,粒径大的类脂质体也可在肝、脾浓集,而有被动靶向作用[3]。为此,本试验采用高脂血症模型,以血液生化指标和血液流变学为考察指标,研究银杏叶提取物类脂质体在体内的药效学,并研究其体外释放度。
1 仪器与试药
1.1 仪器
Waters 600高效液相色谱仪(Waters2487双通道检测器,JS23030色谱工作站)(美国沃特斯公司),高效液相输液泵(LC-10ATVP)(日本岛津公司),高效液相检测器(SPD-10AVP)(日本岛津公司),N2000色谱工作站(浙江大学智达信息工程有限公司),BS224S电子天平(北京赛多利斯仪器系统有限公司),BT-300型血液流变仪(北京博莱特通科技有限公司),GF-D800型全自动生化分析仪(武汉海诺医疗器械有限公司),5810R型冷冻离心机(德国eppendorf公司)。
1.2 试药
银杏叶提取物类脂质体(自制);乙腈为色谱纯,甲醇、盐酸、磷酸均为分析纯,槲皮素对照品(批号:110861-200406,购于中国药品生物制品检定所),山柰素对照品(批号:110861-200406,购于中国药品生物制品检定所),异鼠李素对照品(批号:110860-200406,购于中国药品生物制品检定所),银杏叶片(总黄酮醇苷9.6 mg/片、萜类内酯2.4 mg/片)(批号080801,石家庄以岭药业有限公司)。
2 方法与结果
2.1 GbEN冻干粉的制备方法
本文采用改良薄膜分散-匀化法进行制备GbEN混悬液,取吐温80、司盘80、胆固醇,加入二氯甲烷-甲醇(1∶3)的混合溶剂,使溶解,37℃旋转蒸发形成薄膜。将干燥的薄膜溶于60 mL乙醚中,加入10 mL药物的溶液和PBS溶液中,超声10 min,将超声后的溶液中再加入20 mL PBS溶液,水合10 min,置于30℃恒温水浴振荡器中振荡过夜,制成类脂质体混悬液;将类脂质体混悬液通过高压均质机,制备GbE类脂质体混悬液,加入处方量的冻干保护剂,于-80℃冰箱预冻24 h,冷冻干燥,即得。
2.2 体外释放度的测定
2.2.1 黄酮醇苷扫描波长的选择
配制槲皮素、山柰素、异鼠李素混合对照品溶液,按紫外分光光度法(《中国药典》2005年版附录[4])以甲醇为空白,在200~400 nm波长范围内进行扫描。由扫描结果可知黄酮醇苷在360 nm处有最大吸收,故选择360 nm为测定波长。
2.2.2 色谱条件
色谱柱:Agilent HC-C18柱(250 mm ×4.6 mm,5 μm),流动相:乙腈 -0.4%磷酸溶液 =28∶72,流速:1 mL/min,检测波长:360 nm,柱温:40℃,进样量:20 μL。
2.2.3 供试品溶液的制备
取冻干后粉末,精密称定,加15 mL甲醇洗游离药物,于6 000 r/min离心10 min,取上清液滤过,精密量取续滤液,加甲醇-25%盐酸(4∶1)的混合溶液10 mL,置水浴中加热回流30 min,迅速冷却至室温,转移至25 mL量瓶中,用甲醇稀释至刻度,摇匀,滤过,取续滤液,作为供试品溶液。
2.2.4 对照品溶液的制备
分别精密称取105℃干燥至恒重的槲皮素5.025 mg,山柰素 2.515 mg,异鼠李素 0.64 mg,加甲醇制成每1 mL含分别含槲皮素0.100 5 mg、山柰素0.050 3 mg、异鼠李素0.012 8 mg的混合溶液,作为对照品溶液。
2.2.5 标准曲线的建立
精密量取对照品溶液 0.2、0.4、0.6、0.8、1、1.5、2 mL,分别置于10 mL量瓶中,加甲醇稀释至刻度,摇匀;各精密量取20 μL进样,分别以槲皮素、山柰素、异鼠李素的峰面积Y为纵坐标,对照品浓度X(μg/mL)为横坐标,绘制标准曲线。得槲皮素回归方程为 Y=35 419X-9 073.2,r=0.999 9,在 2.01 μg/mL~20.1 μg/mL范围内呈良好的线性关系。得山柰素回归方程为 Y=34 672X-2 204.1,r=0.999 9,在1.006 ~10.06 μg/mL 范围内呈良好的线性关系。得异鼠李素回归方程为Y=38 896X-404.38,r=0.999 9,在0.256 ~2.56 μg/mL 范围内呈良好的线性关系。
2.2.6 精密度试验
2.2.6.1 日内与日间精密度试验结果 日内精密度:按“2.2.4”项下配制低(分别含槲皮素2.01 μg/mL,山柰素1.006 μg/mL,异鼠李素0.256 μg/mL)、中(分别含槲皮素 4.02 μg/mL,山柰素 2.012 μg/mL,异鼠李素 0.512 μg/mL)、高(分别含槲皮素6.03 μg/mL,山柰素 3.018 μg/mL,异鼠李素 0.768 μg/mL)三种不同浓度的黄酮醇苷混合对照品溶液,连续进样6次,记录峰面积,低浓度槲皮素峰面积积分平均值为64 433.199,RSD=1.2%;中浓度槲皮素峰面积积分平均值为134 352.906,RSD=1.1%;高浓度槲皮素峰面积积分平均值为202 337.203,RSD=1.3%;低浓度山柰素峰面积积分平均值为33 323.617,RSD=1.7%;中浓度山柰素峰面积积分平均值为68 032.297,RSD=1.2%;高浓度山柰素峰面积积分平均值为101 777.898,RSD=1.6%;低浓度异鼠李素峰面积积分平均值为9 774.567,RSD=1.8%;中浓度异鼠李素峰面积积分平均值为19 149.201,RSD=1.8%;高浓度异鼠李素峰面积积分平均值为29 303.000,RSD=1.7%;日内精密度良好。
日间精密度:按“2.2.4”项下配制低、中、高3种不同浓度的黄酮醇苷混合对照品溶液,每天进样1次,连续6 d,记录峰面积,以峰面积计算日间精密度。低浓度槲皮素峰面积积分平均值为64 279.133,RSD=1.2%;中浓度槲皮素峰面积积分平均值129 907.839,RSD=1.0%;高浓度槲皮素峰面积积分平均值为200 965.186,RSD=1.3%;低浓度山柰素峰面积积分平均值为33 194.238,RSD=1.6%;中浓度山柰素峰面积积分平均值为67 127.425,RSD=1.3%;高浓度山柰素峰面积积分平均值为101 828.553,RSD=1.9%;低浓度异鼠李素峰面积积分平均值为9 816.127,RSD=1.7%;中浓度异鼠李素峰面积积分平均值19 257.391,RSD=1.6%;高浓度异鼠李素峰面积积分平均值为28 814.725,RSD=1.6%。日间精密度良好。
2.2.6.2 中间精密度考察结果 在不同时间,不同分析人员在Waters 600和岛津高效液相色谱仪检测黄酮醇苷对照品溶液,记录峰面积。槲皮素、山柰素、异鼠李素峰面积的RSD值分别为0.6%、0.4%、0.6%,n=9。
2.2.7 稳定性试验
取同一批供试品溶液,在室温下放置0,2,4,6,12,24 h后分别精密吸取20 μL进样,测定槲皮素、山柰素、异鼠李素的峰面积,考察其稳定性。槲皮素、山柰素、异鼠李素在24 h内峰面积的RSD值分别为0.5%,0.5%,0.2%。结果表明槲皮素、山柰素、异鼠李素至少在24 h内稳定。
2.2.8 加样回收率试验
称取同一批号已知含量的类脂质体冻干粉末0.2 g,自“2.2.3”项下“加甲醇-25%盐酸……摇匀”法操作,分别加入槲皮素、山柰素、异鼠李素对照品溶液浓度分别为4.020、2.012、0.512 μg/mL 的混合溶液0.5、1、1.5 mL,按“2.2.2”项色谱条件下,依法测定,记录峰面积。按公式R%=(A-B)/C×100%(A:加入对照品后测得总量,B:样品中所含被测组分量,C:加入对照品量)计算回收率。槲皮素的低、中、高3种浓度的回收率分别为99.80%、99.93%、100.08%;山柰素的低、中、高3种浓度的回收率分别为99.40%、100.20%、99.83%;异鼠李素的低、中、高3种浓度的回收率分别为100.78%、100.78%、99.48%。
2.2.9 释药特性研究
采用透析法,分别考察温度为(37±1)℃,转速为75 r/min时,在3种不同释放介质磷酸盐缓冲液(pH=6.8)、醋酸缓冲液(pH=4.0)、HCl溶液(9→1 000)中黄酮醇苷的释放情况。精密称取类脂质体冻干粉末,放入含有10 mL释放介质的透析袋中(分子量8 000-10 000),将透析袋放入90 mL的释放介质中,分别在 10 min、20 min、30 min、1 h、2 h、3 h、6 h、12 h、24 h、48 h 取 5 mL 外液(同时补充等温新鲜介质5 mL)。外液蒸干,加甲醇-25%盐酸(4∶1)的混合溶液20 mL,置水浴中加热回流30 min,将回流液蒸干,加甲醇溶解,置于5 mL量瓶中,用甲醇稀释至刻度,摇匀,滤过,取续滤液,HPLC测定槲皮素、山柰素、异鼠李素的峰面积,分别带入槲皮素、山柰素、异鼠李素标准曲线,计算槲皮素、山柰素、异鼠李素的含量,按下式换算成总黄酮醇苷的含量。
总黄酮醇苷含量=(槲皮素含量+山柰素含量+异鼠李素含量)×2.51
计算释放的游离药物总量,计算各时间点类脂质体的释放度。结果见图1。
由图1可看出,GbEN在PBS(pH6.8)中的释放度较好,在12 h内累计释放率达到80%以上,在HCl(9→1 000)和醋酸缓冲液(pH4.0)中释放48 h其累计释放率在20%左右。
2.3 GbEN与银杏叶片主要药效试验比较研究
2.3.1 GbEN对实验性高脂血症大鼠的作用[5]

图1 GbEN在PBS(pH6.8)、HCl(9→1 000)、醋酸缓冲液(pH 4.0)中的累计释放率
从72只Wistar雄性大鼠中按体重随机选取12只大鼠作为空白对照组,其余60只大鼠用于造高脂血症模型。造模28 d后,全部大鼠尾静脉采血,测血脂,并按血脂水平将高脂组大鼠随机分为五组,分别为空白对照组、模型对照组 、GbEN高剂量组、GbEN中剂量组、GbEN小剂量组、银杏叶片组;随机分组后,每天上午8:00~9:00,GbEN高、中、低剂量组和银杏叶片组分别按上述剂量灌胃给予GbEN和银杏叶片混悬液,空白对照组及模型对照组给予同体积蒸馏水,每日给药1次,连续7 d。于每天18:00~19:00,除空白对照组大鼠外,其余大鼠给予高脂饲料,每只鼠平均20 g,白天补充足量的普通饲料,正常给水。空白对照组每日给予普通饲料,连续28 d。第7天给药后1 h,大鼠以乌拉坦1 g/kg腹腔注射麻醉,腹主动脉采血,血液用肝素抗凝,并充分混匀,不得凝血。高脂饲料的配方:1%胆固醇、0.2%6-甲基-2-硫代四氧嘧啶、0.5%胆酸钠、2%猪油、5%黄豆、0.5%蛋清、0.5%鱼粉、2%蛋黄粉、88.3%基础饲料。
2.3.1.1 血液生化指标的测定 取血2 mL,并分离血浆,用生化分析仪检测血浆中的总胆固醇(TG)、总甘油三酯(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)后,通过TC及 HDL-C计算动脉硬化指数 AI(AI=(TCHDL-C)/HDL-C)。
2.3.1.2 对大鼠血浆TG的影响 见表1。
从表1可以看出,与空白组比较,模型组在给予高脂饲料后可见血浆TG含量明显升高,具有显著性差异(P<0.001),表明大鼠高脂血症造模成功。与模型组相比,GbEN各剂量组在给药7 d后可明显降低血浆中TG含量(P<0.001)。
2.3.1.3 对大鼠血浆TC的影响 见表2。
从表2可以看出,与空白组比较,模型组在给予高脂饲料后可见血浆TC含量极显著升高(P<0.001),表明大鼠高脂血症造模成功。与模型组相比,GbEN各剂量组在给药7 d后可极显著降低血浆中TG含量(P<0.001)。
表1 对大鼠血浆TG的影响结果(±s,n=12)
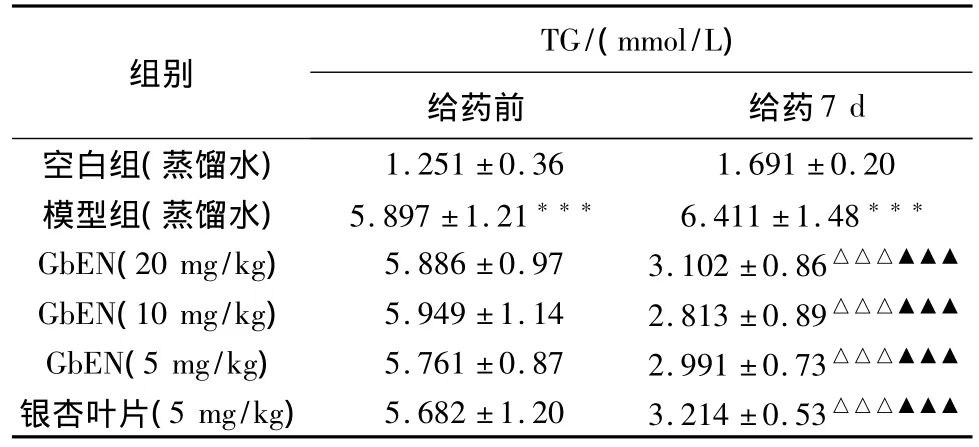
表1 对大鼠血浆TG的影响结果(±s,n=12)
注:与空白组比较,*P <0.05,**P <0.01,***P <0.001;给药前与给药后比较,▲P<0.05,▲▲P <0.01,▲▲▲P <0.001;与模型组比较,△P<0.05,△△P<0.01,△△△P<0.001(下同)。
组别TG/(mmol/L)给药前 给药7 d空白组(蒸馏水)1.251±0.36 1.691±0.20模型组(蒸馏水) 5.897±1.21*** 6.411±1.48***GbEN(20 mg/kg) 5.886±0.97 3.102±0.86△△△▲▲▲GbEN(10 mg/kg) 5.949±1.14 2.813±0.89△△△▲▲▲GbEN(5 mg/kg) 5.761±0.87 2.991±0.73△△△▲▲▲银杏叶片(5 mg/kg) 5.682±1.20 3.214±0.53△△△▲▲▲
表2 对大鼠血浆TC的影响结果(±s,n=12)

表2 对大鼠血浆TC的影响结果(±s,n=12)
组别TC/(mmol/L)给药前 给药7 d空白组(蒸馏水)0.695±0.24 0.719±0.11模型组(蒸馏水) 2.945±0.59*** 3.158±0.48***GbEN(20 mg/kg) 2.518±1.02 0.505±0.07△△△▲▲▲GbEN(10 mg/kg) 2.196±0.73 0.531±0.10△△△▲▲▲GbEN(5 mg/kg) 2.089±0.58 0.626±0.14△△△▲▲▲银杏叶片(5 mg/kg) 2.142±0.64 0.759±0.16△△△▲▲▲
2.3.1.4 对大鼠血浆HDL-C的影响 见表3。
从表3可以看出,与空白组比较,模型组在给予高脂饲料后可显著使血浆HDL-C含量降低(P<0.05)。与模型组相比,GbEN各剂量组在给药7 d后可显著升高血浆中HDL-C含量(P<0.01)。
表3 对大鼠血浆HDL-C的影响结果(±s,n=12)
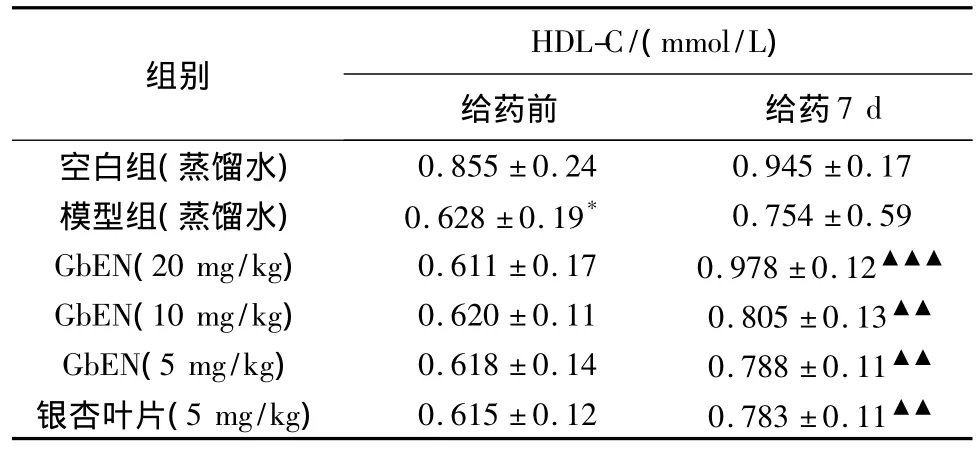
表3 对大鼠血浆HDL-C的影响结果(±s,n=12)
组别HDL-C/(mmol/L)给药前 给药7 d空白组(蒸馏水)0.855±0.24 0.945±0.17模型组(蒸馏水) 0.628±0.19* 0.754±0.59 GbEN(20 mg/kg) 0.611±0.17 0.978±0.12▲▲▲GbEN(10 mg/kg) 0.620±0.11 0.805±0.13▲▲GbEN(5 mg/kg) 0.618±0.14 0.788±0.11▲▲银杏叶片(5 mg/kg) 0.615±0.12 0.783±0.11▲▲
2.3.1.5 对大鼠血浆LDL-C的影响 见表4。
从表4可以看出,与空白组比较,模型组在给予高脂饲料后血浆HDL-C含量极显著升高(P<0.001)。与模型组相比,GbEN各剂量组在给药7 d后可极显著降低血清中LDL-C含量(P<0.001)。
2.3.1.6 对大鼠血浆AI的影响 见表5。
从表5可以看出,与空白组比较,模型组在给予高脂饲料后可见血浆 AI含量极显著升高(P<0.001)。与模型组相比,GbEN各剂量组在给药7 d后可极显著降低血浆中AI含量(P<0.001)。
表4 对大鼠血浆LDL-C的影响结果(±s,n=12)
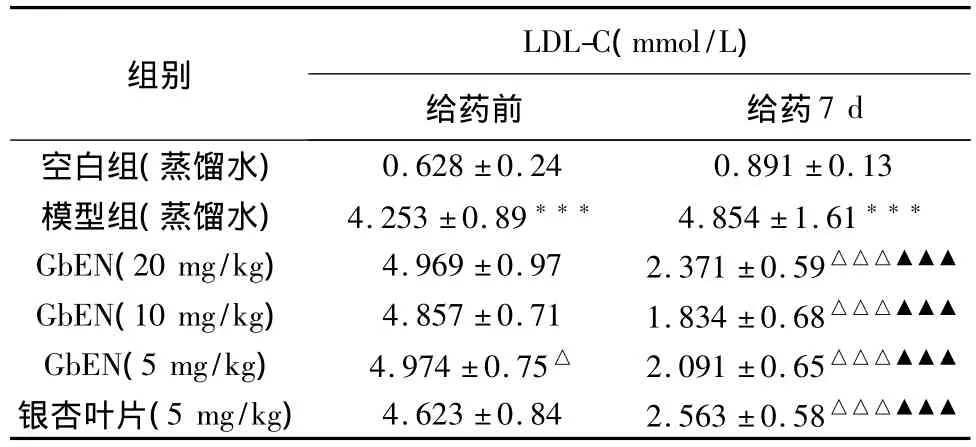
表4 对大鼠血浆LDL-C的影响结果(±s,n=12)
组别LDL-C(mmol/L)给药前 给药7 d空白组(蒸馏水)0.628±0.24 0.891±0.13模型组(蒸馏水) 4.253±0.89*** 4.854±1.61***GbEN(20 mg/kg) 4.969±0.97 2.371±0.59△△△▲▲▲GbEN(10 mg/kg) 4.857±0.71 1.834±0.68△△△▲▲▲GbEN(5 mg/kg) 4.974±0.75△ 2.091±0.65△△△▲▲▲银杏叶片(5 mg/kg) 4.623±0.84 2.563±0.58△△△▲▲▲
表5 对大鼠血浆AI的影响结果(±s,n=12)
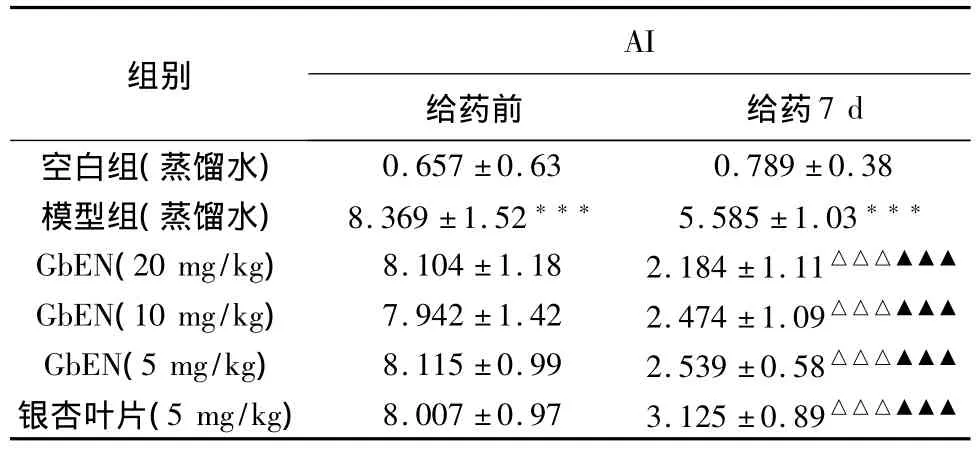
表5 对大鼠血浆AI的影响结果(±s,n=12)
组别AI给药前 给药7 d空白组(蒸馏水)0.657±0.63 0.789±0.38模型组(蒸馏水) 8.369±1.52*** 5.585±1.03***GbEN(20 mg/kg) 8.104±1.18 2.184±1.11△△△▲▲▲GbEN(10 mg/kg) 7.942±1.42 2.474±1.09△△△▲▲▲GbEN(5 mg/kg) 8.115±0.99 2.539±0.58△△△▲▲▲银杏叶片(5 mg/kg) 8.007±0.97 3.125±0.89△△△▲▲▲
2.3.1.7 对大鼠血浆LDL-C/HDL-C的影响 见表6。
从表6可以看出,与空白组比较,模型组在给予高脂饲料后可见血浆中LDL-C/HDL-C比值极显著升高(P<0.001)。与模型组相比,GbEN各剂量组在给药7 d后可极显著降低血浆中LDL-C/HDL-C比值(P<0.001)。
表6 对大鼠血清LDL-C/HDL-C比值的影响结果(±s,n=12)
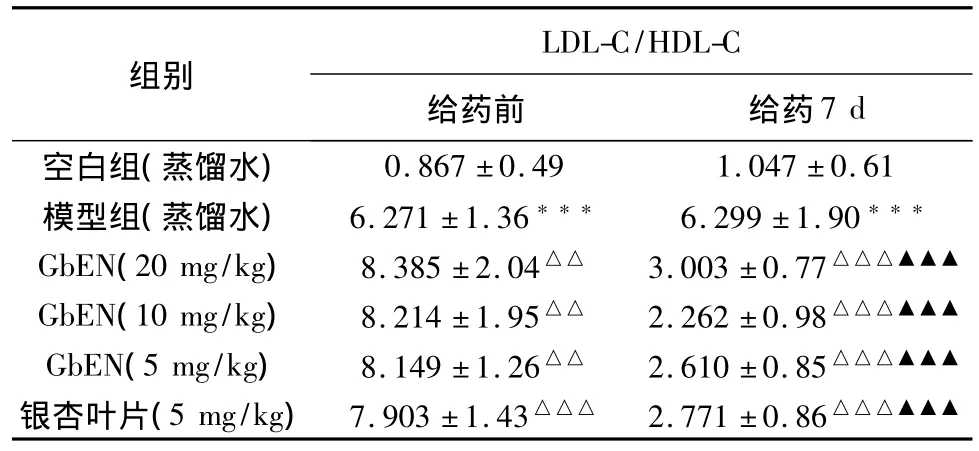
表6 对大鼠血清LDL-C/HDL-C比值的影响结果(±s,n=12)
组别LDL-C/HDL-C给药前 给药7 d空白组(蒸馏水)0.867±0.49 1.047±0.61模型组(蒸馏水) 6.271±1.36*** 6.299±1.90***GbEN(20 mg/kg) 8.385±2.04△△ 3.003±0.77△△△▲▲▲GbEN(10 mg/kg) 8.214±1.95△△ 2.262±0.98△△△▲▲▲GbEN(5 mg/kg) 8.149±1.26△△ 2.610±0.85△△△▲▲▲银杏叶片(5 mg/kg) 7.903±1.43△△△ 2.771±0.86△△△▲▲▲
2.3.2 GbEN对实验性高脂血症大鼠全血及血浆黏度的影响
见表7。
取72只Wistar♂性大鼠,分组及给药情况同上,血样采集同上。
取经1%肝素抗凝的全血5 mL,1 mL加入血液流变仪中测定不同切变率(3 s-1、30 s-1、100 s-1、180 s-1)下的黏度。其余4 mL,于2 000 r/min离心10 min,取上层血浆,测血浆黏度。从表13可以看出,与空白组比较,模型组的血浆黏度和全血在3 s-1、30 s-1、100 s-1、180 s-1切变下均极显著升高(P<0.001),表明大鼠高脂血症造模后血液黏滞性增高。与模型组比较,GbEN各剂量组在给药7 d后,可极显著降低 30 s-1、100 s-1、180 s-1切变黏度及降低血浆黏度(P<0.001)。
表7 对大鼠全血及血浆黏度的影响结果(±s,n=12)
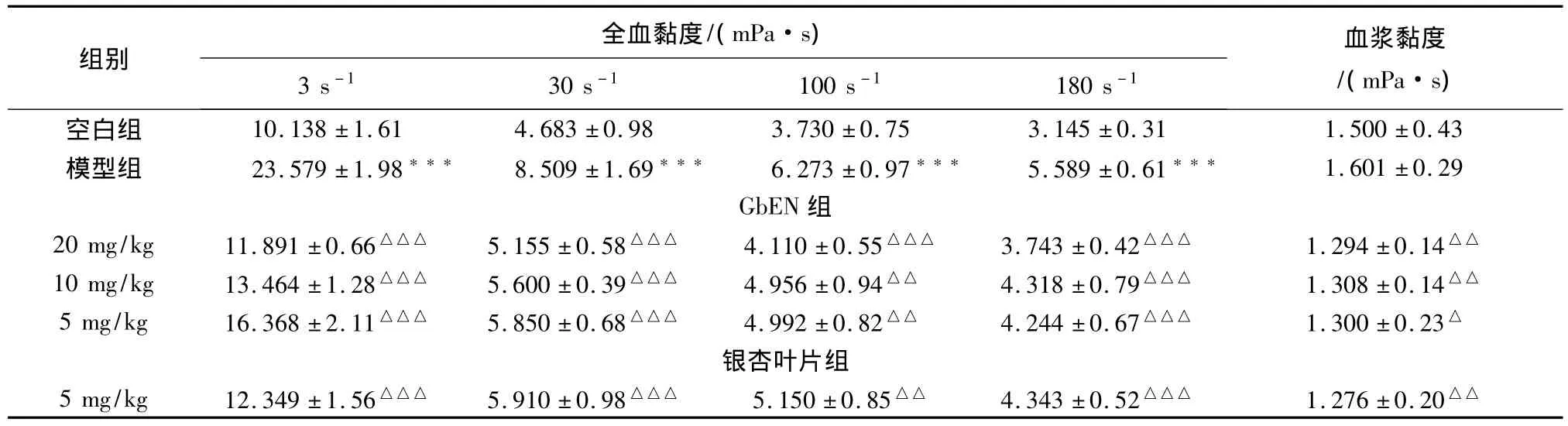
表7 对大鼠全血及血浆黏度的影响结果(±s,n=12)
组别 全血黏度/(mPa·s)3 s-1 30 s-1 100 s-1 180 s -1血浆黏度/(mPa·s)空白组 10.138±1.61 4.683±0.98 3.730±0.75 3.145±0.31 1.500±0.43模型组 23.579±1.98*** 8.509±1.69*** 6.273±0.97*** 5.589±0.61*** 1.601±0.29 GbEN组20 mg/kg 11.891±0.66△△△ 5.155±0.58△△△ 4.110±0.55△△△ 3.743±0.42△△△ 1.294±0.14△△10 mg/kg 13.464±1.28△△△ 5.600±0.39△△△ 4.956±0.94△△ 4.318±0.79△△△ 1.308±0.14△△5 mg/kg 16.368±2.11△△△ 5.850±0.68△△△ 4.992±0.82△△ 4.244±0.67△△△ 1.300±0.23△银杏叶片组5 mg/kg 12.349±1.56△△△ 5.910±0.98△△△ 5.150±0.85△△ 4.343±0.52△△△ 1.276±0.20△△
3 小结与讨论
3.1 目前常用的测定类脂质体释放度的方法有溶出度测定法及透析法。本试验曾经尝试用溶出度测定法,但此法需要类脂质体量大,且粒径小的类脂质体易混合于游离药物,测定不准确。故采用透析-HPLC法,利用透析膜根据分子量大小不同对不同分子截留的原理,能将分子量大的类脂质体及其载体完全截留,而小分子药物可以透过。此法操作简单,且重现性好。
3.2 本试验通过实验性高脂血症大鼠模型,考察了GbEN对血脂代谢及对全血黏度和血浆黏度的影响。证明GbEN和银杏叶片均可改善高脂血大鼠的血脂代谢紊乱,提高血浆HDL-C含量,降低TC、TG、LDL-C含量、AI及LDL-C/HDL-C的比值。并可以降低高脂血大鼠的全血及血浆黏度。
[1]谢 燕,张钧寿.银杏叶提取物制剂研究概况[J].中草药,2005,36(8):1267-1269.
[2]Uchegbu IF.Non-ionic surfactant based vesicles(niosomes)in drug delivery[J].Int J Pharm,1998,172(1):33-70.
[3]陆 彬.新型给药系统聚合物泡囊及其研究进展[J].中国药师,2009,12(4):439-441.
[4]中国药典[S].二部.2005:281-282.
[5]王忠超,睢大员.狗枣猕猴桃叶总黄酮对实验性高脂血症大鼠血脂代谢的影响[D].吉林:吉林大学,2008.

