制备型高效液相色谱法制备和厚朴酚与厚朴酚
刘 霞, 唐骁爽, 汪永强, 葛红丽, 吕海燕, 唐玉海,*
(1.西安交通大学理学院分析科学研究所,陕西西安710061;2.兰州大学第二医院,甘肃兰州730030;3.中科院成都生物所,四川成都610041)
厚朴为木兰科植物厚朴Magnolia officinalis Rehd.et Wils.或凹叶厚朴Magnolia officinalis Rehd.ed Wils.var.biloba Rehd.Et Wils.的干燥干皮,枝皮或根皮,主要化学成分为和厚朴酚与厚朴酚,约占原药材的5% ~12%。和厚朴酚与厚朴酚均具有抗菌、抗炎[1],抗氧化作用[2],此外,厚朴酚还具有抗抑郁作用[3],而和厚朴酚(0.1 ~10 μmg/kg)对大鼠皮质神经元具有营养作用,10 μmg/kg和厚朴酚的营养神经的活性与40 ng/mL碱性成纤维细胞生长因子(bFGF)的活性相似[4]。
二者系同分异构体,很难分离,本文采用溶剂提取法,利用硅胶柱色谱纯化技术分离得到了4-O-methylhonokiol与和厚朴酚、厚朴酚混合物,再采用制备型高效液相色谱法分离纯化和厚朴酚与厚朴酚混合物,运用分析型HPLC测定纯度,所得产品纯度均大于95%。此方法具有快速、高效、产品纯度高的特点,可大量制备和厚朴酚与厚朴酚,对于科学研究、临床前和临床试验具有非常重要的意义,也可制备和厚朴酚与厚朴酚对照品的方法。
1 实验部分
1.1 仪器与试药
制备型液相色谱仪;qingqq;旋转蒸发仪(巩义市英峪予华仪器厂);甲醇(色谱纯;Fisher Scientific);硅胶G(100~200目,青岛海洋化工有限公司);厚朴药材(陕西西安华阳生物科技有限公司);厚朴酚、和厚朴酚对照品(中国生物制品检验鉴定所)。
1.2 色谱条件
分析条件:Akasil-C18柱(4.6 mm ×250 mm,5 μm);流动相:甲醇-水-冰醋酸(80 ∶20 ∶0.10,V/V/V);流速:0.8 mL/min;检测波长:294 nm;进样量:20 μL。
制备条件:Wellchrom K-1800泵;LabAlliance Model 500可变波长检测器;自填 C18柱(50 mm ×300 mm,10 μm);流动相甲醇-水-冰醋酸(80 ∶20 ∶0.10,V/V/V);流速80 mL/min;检测波长294 nm;进样量5 mL(六通阀进样)。
1.3 厚朴中酚类化合物的提取
称取厚朴粗粉50 g,90%甲醇回流提取,减压浓缩,加入2%NaOH溶液,搅拌,静置,过滤,在滤液中加2.0 mol/L的盐酸调pH值至1~2,静置,过滤。用少量氯仿溶解过滤得的沉淀,过硅胶柱(柱层析用,100~200目,柱长约45 cm,内径2.5 cm),以每10 mL洗脱液分段接收。薄层色谱定性每段接受液,减压浓缩。得到淡黄色油状化合物以及和厚朴酚与厚朴酚的混合物。
1.4 样品制备色谱分离
加甲醇溶解和厚朴酚与厚朴酚混合物,采用制备型HPLC进行分离纯化,多次进样,根据色谱图手动收集各色谱峰组分,减压浓缩,析出结晶,真空干燥。图1为和厚朴酚与厚朴酚混合物的制备色谱图。
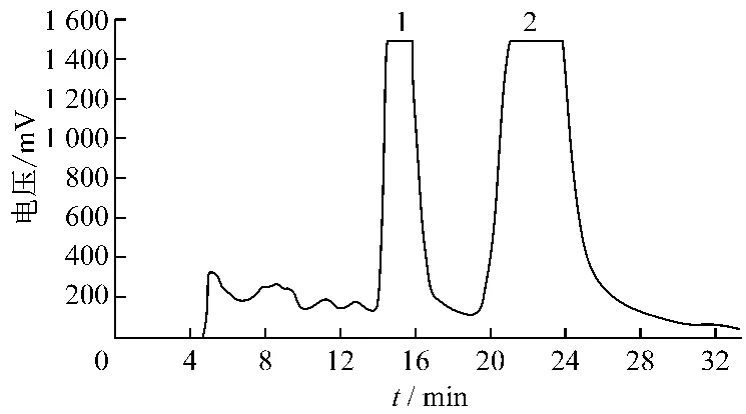
图1 样品的制备色谱图
2 结果与讨论
2.1 厚朴粗提物的硅胶柱色谱纯化
根据厚朴中酚类化合物具有弱酸性,采用碱溶解酸沉淀的方法纯化甲醇提取液,主要含有和厚朴酚、厚朴酚、以及一个未知物化合物,峰面积归一化法测得三者的含量百分比分别为25.33%、48.51%、15.88%(图2 A)。采用硅胶进一步分离纯化,得到淡黄色油状物,峰面积归一化法测得其纯度约为95%(图2 B),以及厚朴酚与和厚朴酚混合物,含量百分比分别为28.94%、63.82%,(图2 C)所示。
2.2 制备色谱条件的优化
2.2.1 制备色谱流速的选择
制备色谱条件由高效液相色谱分析条件扩展而来,当分析型与制备型液相色谱用填料相同,分析型液相色谱向制备型液相色谱转化时,采用放大公式(式中Xp为制备型色谱流速,Xa为分析型色谱流速,rp为制备型柱半径,为ra分析型柱半径,CL为制备型色谱柱与分析型色谱柱的长度之比)[5],制备色谱的理论流速为113 mL/min。当流速为113 mL/min时,和厚朴酚与厚朴酚很快的被洗脱出来,但是泵压很大,分辨率低,两者的分离效果均不佳,产品纯度低。在此基础上,优化最佳流速,选择流速为80 mL/min。
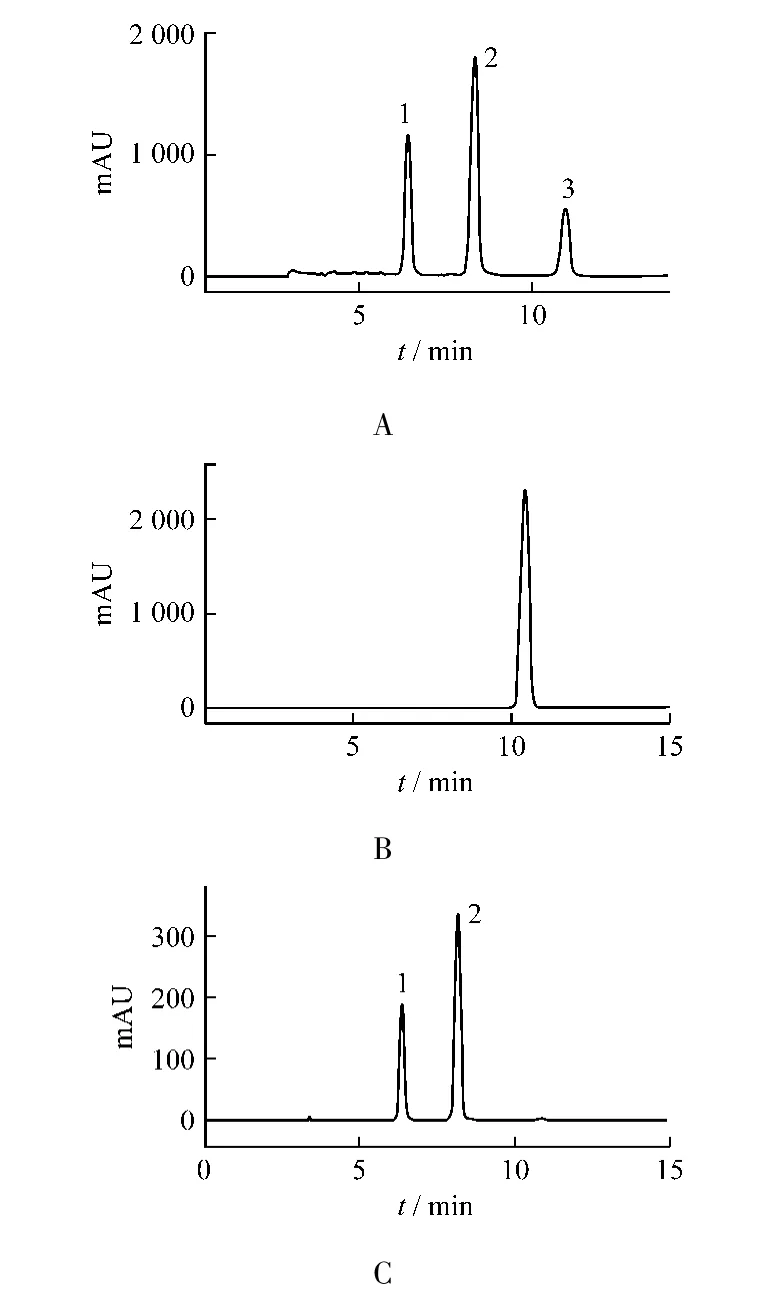
图2 A碱溶解酸沉淀后的粗提物色谱图 B未知化合物的纯度测定色谱图 C硅胶纯化后含和厚朴酚与厚朴酚的色谱图
2.2.2 最佳进样体积、进样量的优化
根据粗品溶解性能,实验选择甲醇为溶剂,确定制备样品质量浓度为10 mg/mL,观察进样体积对色谱分辨率影响,随着进样体积增大,色谱分辨率逐渐降低,色谱峰发生扩散,当进样体积大于8 mL时,色谱分辨率急剧下降,且出现严重的峰形不对称。当进样体积越大,馏分中和厚朴酚、厚朴酚的纯度降低。因此,选择进样体积为5 mL。在5 mL进样体积的情况下,随着进样量的增大,色谱峰变宽,组分峰重叠情况加剧,容量因子K′逐渐减小,分辨率降低,在柱中会有样品残留,影响下一次的分离。因此,选择最佳进样量为10 mg/mL。
2.3 产品的定性分析及纯度检测
2.3.1 硅胶分离得淡黄色油状化合物的结构鉴定
未知化合物:1H-NMR(400 MHz,CDCl3):δ ppm 3.35(2H,d,aryl-CH2-),3.44(2H,d,aryl-CH2-),3.90(3H,s,-OMe),5.05-5.20(4H,m,2 ×-C=CH2),5.94-6.07(2H,m,2× -CH=C),6.91(1H,d,Ar-H),6.98(1H,d,Ar-H),7.05-7.08(2H,m,ArH),7.24-7.31(2H,m,ArH).13C NMR(400MHz,CDCl3):δ ppm:34.2(C-7),39.3(C-7′),55.5(OMe),110.9(C-3′),115.4(C-4′),115.5(C-9),115.7(C-9′),127.8(C-1′),127.8(C-6),128.7(C-3),129.0(C-1),129.7(C-5),130.1(C-6′),130.4(C-2),132.11(C-5′),136.4(C-8),137.7(C-8′),151.8(C-2′),157.0(C-4). 参考文献[6],未知化合物为 4-O-methylhonokiol。
2.3.2 制备色谱所得化合物的定性
对照品定性,制备色谱所得的化合物为和厚朴酚与厚朴酚,产物经高效液相色谱检测,采用峰面积归一化法,和厚朴酚的纯度为99.04%,厚朴酚的纯度为98.80%。外标法定量,测得的产品质量分数分别为:和厚朴酚98.45%(图3A);厚朴酚98.01%(图3B)。测得所制备的和厚朴酚熔点为87~88℃,厚朴酚熔点为103~104℃。
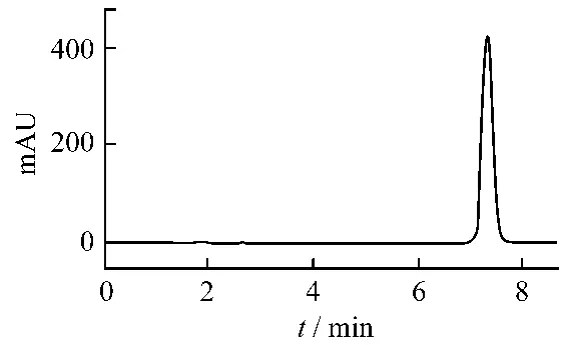
图3A 和厚朴酚的纯度色谱图
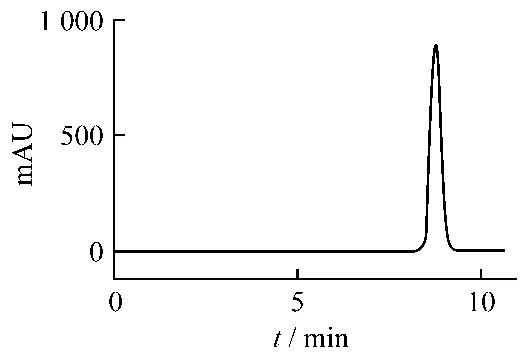
图3B 厚朴酚的纯度色谱图
2.3.3 结构鉴定
和厚朴酚:1H NMR(400MHz,CDCl3)δ ppm:3.33(2H,d,aryl-CH2-),3.44(2H,d,aryl-CH2-),5.04-5.22(4H,m,2 × -C=CH2),5.36(2H,brs,2 ×-OH),5.92-6.08(2H,m,2× -CH=C),6.88-7.25(6H,m,ArH).13C NMR(400MHz,CDCl3)δ ppm:35.1(C-7),39.4(C-7′),115.5(C-3),115.6(C-9′),116.5(C-5′),116.8(C-9),126.4(C-1′),127.7(C-1),128.5(C-6′),128.8(C-4),129.6(C-3′),130.2(C-2′),131.1(C-6),132.2(C-5),136.0(C-8′),137.8(C-8),150.7(C-2),153.90(C-4′).与文献[6]一致。
厚朴酚:1H NMR(400MHz,CDCl3)δ ppm:3.37(2H,d,aryl-CH2-),3.39(2H,d,aryl-CH2-),5.08-5.13(4H,m,2× -C=CH2),5.93-6.09(2H,m,2× -CH=C),6.92(2H,br s,2× -OH),6.94-7.26(6H,m,ArH).13C NMR(400MHz,CDCl3)δ ppm:39.3(C-7,7′),115.8(C-9,9′),116.8(C-3,3′),124.2(C-1,1′),129.8(C-4,4′),131.3(C-6,6′),133.3(C-5,5′),137.6(C-8,8′),150.8(C-2,2′).与文献[6]一致。
3 结论
随着和厚朴酚与厚朴酚药理作用研究的不断深入,此类化合物及其对照品在实验室的需求量也日益增加。本试验采用硅胶柱层析与制备型高效液相色谱法分离得到4-O-methylhonokiol、和厚朴酚、厚朴酚,制备色谱法分离和厚朴酚与厚朴酚不仅能够得到高纯度的化合物单体,而且产率高,操作方便,便于收集,纯度均大于98%,可作为对照品使用。该色谱分离方法为在天然产物中分离高纯度的化合物单体提供了参考。
致谢 感谢西安交大保赛技术总监常建华教授以及华阳生物科技有限公司在工作中的帮助与指导。
[1]Park J,Lee J,Jung E,et al.In vitro antibacterial and anti-inflammatory effects of honokiol and magnolol against Propionibacterium sp[J].Eur J Pharmacol,2004,496(1-3):189-195.
[2]黄德彬,余昭芬,胡泽华.和厚朴酚与厚朴酚在缓解大鼠吗啡戒断反应中对 β-内啡肽的影响[J].中草药,2004,35(2):182-184.
[3]Nakazawa T,Yasuda T,et al.Metabolites of orally administered Magnolia officinalis extract in rats and man and its antidepressantlike effects in mice[J].J Pharm Pharmacol,2003,55(11):1583-15911.
[4]Fukuyama Y,Nakade K,et al.Neurotrophic activity of honokiol on the cultures of fetal rat cortical neurons[J].Bioorg Med Chem Lett,2002,12(8):1163-11661.
[5]赵维民,张天佑,译.霍斯泰特曼K,马斯顿A.制备色谱技术[M].北京:科学出版社,2000:64,142.
[6]邓世明,程永现,周 俊.长缘厚朴中新苯醌及新木脂素类化合物[J].云南植物研究,2001,23(1):121-125.

