不同精粗比例TMR日粮对中产奶牛氮代谢的影响
孙亚波,边 革,刘庆全,刘胜华,刘玉英,孙宝成,高 月
(辽宁省畜牧科学研究院,辽阳 111000)
优质牧草是草食动物主要饲料来源,反刍动物其特有的瘤网胃系统为消化利用牧草粗饲料提供了有利条件。为了合理利用精粗饲料资源,最大限度地转化日粮的营养物质,在奶牛生产中,经常将精粗饲料进行一定的加工调制,制作成TMR日粮(total mixed rations),其特点是能够保证精粗饲料混合均匀、日粮营养平衡,既能避免挑食,又能提高饲料采食量。本研究将优质的苜蓿干草、羊草和玉米青贮与精料配制成不同精粗比例的TMR日粮,研究其对中产奶牛蛋白质消化代谢的影响,从而得出最大限度利用饲料蛋白质的适宜日粮精粗比例,这对于增加奶牛生产的综合经济效益,充分利用粗饲料资源具有非常重要的意义。
1 材料方法
1.1 试验动物及饲养管理 40头奶牛由辽宁顺兴奶牛场提供,平均年龄4.0岁,胎次4.7胎,体重754.5 kg,泌乳日期107.75 d,日均产奶量18.75 kg。试验奶牛采用拴系式饲养,自由采食和饮水,每天4:00、11:30、21:00三次饲喂和挤奶。
1.2 试验设计及日粮组成 将40头奶牛随机分成4组,其中Ⅰ组为对照组,Ⅱ组、Ⅲ组和Ⅳ组为试验组。在营养水平相同的条件下,设置各组日粮的精粗比例依次为 50%∶50%、40%∶60%、35%∶65%、30%∶70%,并根据需要加水11.5%制作成TMR日粮。其中精料由玉米、麸皮、豆粕、棉籽饼、食盐、磷酸氢钙、石粉和预混剂组成;粗饲料由苜蓿干草、羊草和玉米青贮组成,苜蓿干草和羊草由辽宁省畜牧草业工程技术中心提供。预试期15 d,正试期20 d。试验动物日粮组成和营养水平如表1。
1.3 样品采集及试验指标测定 在试验正试期第1、7、13天采粪样100 g于-20℃保存。第6、12、15天用装500 mL硫酸(10%)的容器收集全部尿液用4层纱布过滤后称重,并采尿样100 mL于-20℃保存。第4、9、18天采尾静脉血10~15 mL,用ANKETDL-60B型离心机以4 500 r/min的速度离心15 min,制备血清并于-20℃保存。饲料、粪样和尿液中氮含量的测定采用常规凯氏定氮法[1]。血清尿素氮(BUN)采用两点动力学法测定,由北京华英生物技术研究所协助完成。
1.4 数据处理 用SPSS 13.0统计软件进行单因子方差分析(ANOVA),差异显著则进行邓肯氏(或LDS)多重比较,并进行相关关系的统计分析。

表1 各组试验动物日粮组成及营养水平
2 结果与讨论
2.1 蛋白质消化代谢 如表2所示,从试验Ⅰ组到Ⅳ组,随着日粮粗饲料比例由50%增加到70%,粗饲料采食量呈极显著增加趋势(P<0.01),各组总氮采食量、粪氮、尿氮均差异不显著(P>0.05);试验Ⅱ组奶氮显著高于试验Ⅲ组(P<0.05),并极显著高于Ⅳ组(P<0.01);氮沉积量试验Ⅱ组最高,但各组间均差异不显著(P>0.05);氮表观消化率试验Ⅱ组显著高于Ⅰ组(P<0.05),其它各组间差异不显著(P>0.05)。氮表观代谢率以试验Ⅱ组最高;氮转化率试验Ⅱ组显著高于试验Ⅰ组和Ⅲ组(P<0.05),并极显著高于试验Ⅳ组(P<0.01);各组氮沉积率差异不显著(P>0.05),但仍以试验Ⅱ组最高。
2.2 粗饲料采食量与氮消化率的关系 在本研究中,当TMR日粮精粗比例为40%∶60%(即试验Ⅱ组)时,氮表观消化率明显高于其它3组,如图1所示,表明试验Ⅱ组奶牛蛋白质消化最彻底。蛋白质在反刍动物消化道内的消化过程包括物理、化学和微生物消化3部分。在瘤胃内,降解蛋白(RDP)首先被蛋白分解菌分解成氨、氨基酸和小肽,然后利用淀粉等快速降解碳水化合物(多指非结构性碳水化合物NSC)分解产生的能量与之合成微生物蛋白(MCP)[2],MCP 和过瘤胃蛋白(UDP)一同进入后段肠道继续消化,而MCP是反刍动物最理想的蛋白质来源,可被小肠最有效地消化吸收并转化为奶蛋白。因此,奶牛能否充分消化吸收日粮粗蛋白,主要在于其RDP部分是否完全被合成MCP,当日粮中结构性碳水化合物(SC)与NSC比例适当,其中能量与氮达到有效合成MCP的比例时,日粮蛋白质的消化率和利用率将最高。在本试验中,粗饲料比例增加,氮表观消化率总体呈增加趋势,其中试验Ⅱ组最高,表明此时粗饲料比例是最佳的。
2.3 总氮采食量与氮代谢的关系 当蛋白质在体内吸收后,要经血液运输到肝脏,经过分解代谢和合成代谢将饲料蛋白质转化成动物生长、繁殖和泌乳所需的体蛋白。在这个代谢过程中将有一部分氮源生成尿素氮(BUN)进入血液,其中部分BUN进入尿素再循环,另外部分经泌尿系统排出,经尿排出的尿素氮是被浪费的氮。理论上氮表观代谢率与BUN呈负相关,在本研究中试验Ⅱ组的氮表观代谢率最高,而此时BUN是最低的,即蛋白质分解由尿排出损失的也最少,统计分析发现,氮表观代谢率(y,%)与 BUN(x,mmol/L)存在极显著的相关关系:y=-5.28x+66.55,r2=0.65,P<0.01,如图 2 所示。
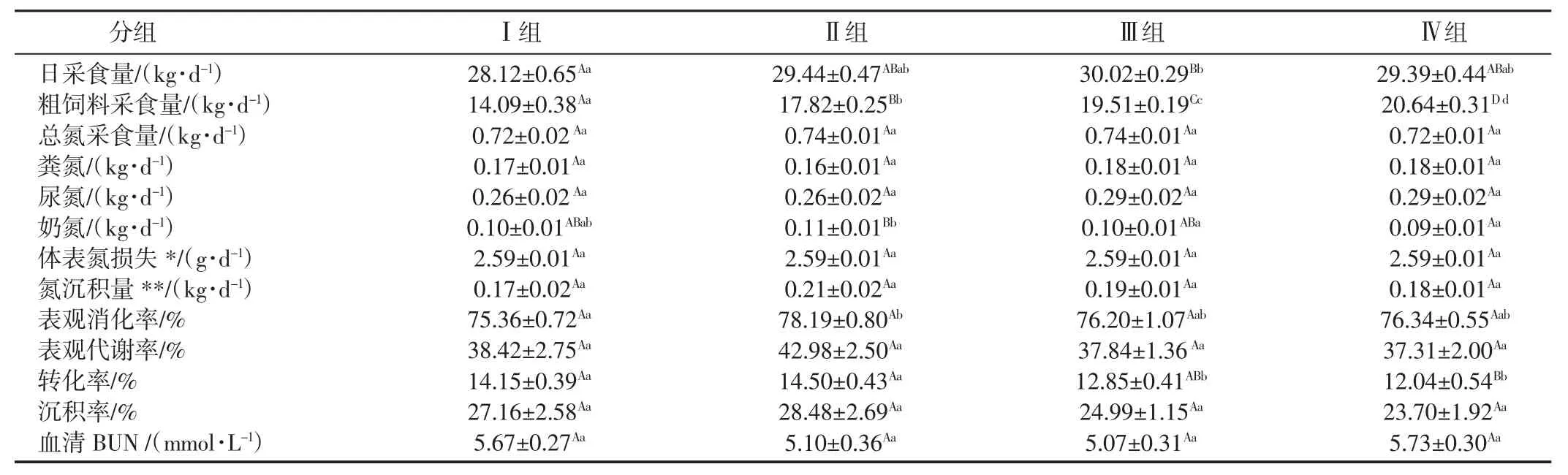
表2 氮消化代谢测定结果

图1 各试验组氮表观消化率对比
日粮粗蛋白在消化吸收后通过尿素再循环重新进入瘤胃,一部分合成MCP,另一部分合成了乳蛋白随乳汁排出,极少部分由体表损失掉,其它剩余部分沉积在动物体内用于生长、增重或孕育胎儿。在泌乳奶牛日粮粗蛋白为5%时,瘤胃再循环氮高达瘤胃总氮量的70%,即使日粮粗蛋白达到20%时,瘤胃再循环氮仍然占瘤胃总氮的11%。本研究中各组日粮粗蛋白水平均在15%左右,其再循环氮量相当可观,在研究氮沉积量时不应忽略。计入进入瘤胃的内源尿素氮时,其氮食入量和沉积量均会有所增加,根据 Whitelaw 等的研究,BUN(x,mg/100mL)与瘤胃氨氮浓度(y,mg/100 mL)存在线性相关[3-4],可估算出瘤胃氨氮浓度。Kennedy研究得出内源尿素氮进入瘤胃的量[y,mg/(h·W0.75)]与瘤胃氨氮(x1,mg/L)和日粮可消化有机物(x2,g/d)以及 BUN(x3,mg/L)存在显著线性回归关系[5],可以推出再循环尿素氮数量。计入再循环尿素氮量后,本研究氮的食入量和沉积量情况如表3。

图2 氮表观代谢率与血清尿素氮的相关关系

表3 计入尿素再循环氮后的氮沉积量
考虑再循环尿素氮后进行统计得出,氮沉积量(y,kg/d)与氮采食量(x,kg/d)之间存在极显著的回归关系:y=0.40x-0.06,r2=0.41,n=33,P<0.05,如图 3 所示。由回归公式分析,当沉积量为零时,氮采食量为150.0 g/d,即本试验中参试奶牛氮维持需要量,这个数值高于奶牛饲养标准(NY/T34—2004)中的数值。在奶牛饲养标准中,泌乳奶牛维持可消化蛋白需要量[6]为3.0W0.75,如果饲料粗蛋白消化率按75.0%计算,则泌乳奶牛维持的粗蛋白需要量约为4W0.75,合92.13 g/d的氮。本试验的奶牛是产后2~3个月的怀孕母牛,其蛋白质沉积的相当一部分用于胚胎生长和胎盘组织增重,因此测定值相对偏高。在回归公式中,当x为零时,氮沉积量为-0.06 kg/d,此数值理论上即为动物采食无氮日粮时的氮排泄量,即内源氮62.2 g/d,它包括来自唾液中的粘蛋白、消化道脱落的上皮细胞以及消化酶[2],这些氮源一部分可被瘤胃微生物利用,另一部分进入小肠。根据INRA(1989)的研究,进入小肠的内源氮(g/d)=5.3×非消化有机物(kg),NRC(2001)采用的公式是:内源氮(g/d)=1.9×DMI(kg/d),据NRC公式和本研究中TMR日粮采食量计算得到的内源氮56.49 g/d,可见由本研究的回归方程推算的结果与NRC(2001)推算的结果相近。
2.4 粗饲料采食量与氮转化率的关系 在奶牛生产中,调整日粮精粗比例的目的是最大限度地利用饲料营养物质转化成牛奶,饲料蛋白质转化成奶蛋白的效率反映了氮的利用效率。本研究中各组氮转化效率如图4所示,由图可知试验Ⅱ组氮转化效率最高,其次是试验Ⅰ组。
对比研究发现,日粮粗饲料比例的增加在一定限度内能提高氮转化效率,当粗饲料比例超过65%时,氮转化效率又出现下降。粗饲料碳水化合物在瘤胃中降解产生能量,瘤胃微生物利用这部分能量和饲料蛋白中快速降解氮合成MCP。本研究中当粗饲料比例进一步增加时氮转化效率降低,可能是由于此时瘤胃能氮不平衡。

图3 氮沉积量与氮采食量之间的回归关系

图4 各试验组氮转化率对比
对粗饲料采食量与氮转化效率统计分析发现,粗饲料采食量(x,kg/d)与氮转化效率(y,%)呈二次曲线相关:y=-0.063x2+1.76x+2.42,r2=0.62,n=40,P<0.05,如图 5 所示。这一结果与上面的分析相吻合,即粗饲料采食量达到19 kg/d(试验Ⅲ组)以上时,氮转化效率开始下降。因此在本试验条件下,TMR日粮的精粗比例调整到40%∶60%时氮利用效率最高。

图5 粗饲料采食量与氮转化效率的相关关系
3 结论
在本研究中,对于年产奶量约5 t的中产奶牛而言,将日粮精粗比例调整为40%∶60%并制作成TMR日粮,可以使饲料蛋白质表观消化率和代谢率最高,氮沉积量最大,由日粮氮转化为奶氮的效率最高。因此,在生产实践中根据奶牛的实际生产能力调整奶牛日粮精粗比例并加工调制成TMR日粮将获得较好的综合经济效益。
[1]张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2007:53-56.
[2]冯仰廉.反刍动物营养学[M].北京:科学出版社,2004:235-238.
[3]Whitelaw F G,Miline J S,Orskov E R,et al.Urea metabolism in sheep given by conventional feeds or nourished by intragastric infusion[J].Exp Phys,1990,75:239-245.
[4]Whitelaw F G,Miline J S,Chen X B.The effect of rumen microbial fermentation on urea and nitrogen metabolism of sheep nourished byintragastric infusion[J].Exp Phys,1991,76:91-101.
[5]Kennedy P M,Milligan L P.The effect of dietary soucrops and the concentration of plasma urea and rumen ammonia on the degradation of urea in the gastrointestinal tract of cattle[J].Br J Nutr,1980,43:125-140.
[6]冯仰廉,方有生,莫放,等.中华人民共和国农业行业标准:NY/T34-2004 奶牛饲养标准[S].北京:中国农业出版社,2004:3-4.
[7]杨红建,冯仰廉.不同有机物进食量和外流速度对瘤胃发酵及微生物蛋白合成效率的影响[J].饲料研究,1999,11:1-3.

