LHR、Caspase-3、和Bcl-2在围着床期小鼠输卵管上皮的表达*
石运芝,刘 迅,刘 敏,杨 东
( 1. 泰山医学院组织学与胚胎学教研室,山东 泰安 271000;2. 泰山医学院附属泰山医院妇科,山东 泰安 271000; 3.泰安市中医院制剂科,山东 泰安 271000;)
输卵管是输送配子、受精和早期胚胎发育的重要场所。深入研究围着床期(peri-implantation)输卵管特异分子的表达调控,是揭示输卵管与受精卵和早期胚胎的关系,以及阐明输卵管妊娠机制的基础。
细胞凋亡在女性生殖活动中所起的重要作用已得到公认,Xu JS等曾报道,人输卵管细胞可维持与其共培养的卵裂期鼠胚线粒体膜电位,抑制Caspase的活性,促进鼠胚发育[1]。黄体生成素受体(luteinizing hormone receptor,LHR)属于G蛋白耦联受体家族,通过与黄体生成素(luteinizing hormone,LH)结合,在整个生殖生理过程中起着十分重要的作用[2-4]。但是有关凋亡相关基因Caspase-3、Bcl-2和LHR在小鼠输卵管中的表达情况以及它们之间是否具有相关性等,国内外报道甚少,且研究结果也颇一致。
鉴于此,我们以正常成熟雌性昆明小鼠为研究对象,通过免疫组织化学技术研究了围着床期输卵管上皮中LHR、Caspase-3和Bcl-2的分布和变化规律,并对其可能的生物学作用和调节机制加以探讨,以期为生殖调控的理论体系提供新的资料。
1 材料和方法
1.1 标本制备
健康成熟雌性昆明小鼠28只,体重25~30 g,随机分为4组:第1组为动情期组,第2组为妊娠第1 d组,第3组为妊娠第4 d组,第4组为妊娠第6 d组,每组7只。正常有生育能力的成熟雄鼠10只。实验动物由山东省实验动物研究所提供。动情周期的划分以阴道细胞涂片确定:动情期细胞全部是无核角化上皮细胞,无白细胞。妊娠确定:于傍晚将雌性小鼠与雄性小鼠2∶1合笼,次日晨查见阴栓者定为妊娠第1 d。
1.2 SABC法免疫组织化学染色
将各组小鼠脱颈处死,立即剖腹,解剖镜下分离出输卵管,PBS冲洗后,投入4%中性甲醛溶液中固定,常规石蜡连续切片,切片厚度为6 μm。切片经脱蜡入水,3%H2O2室温作用10 min,蒸馏水洗;微波抗原修复2次;5%BSA封闭液,室温20 min;分别滴加兔抗小鼠LHR(1∶200)、兔抗小鼠Caspase-3(1∶200)和兔抗小鼠Bcl-2(1∶200),37 ℃孵育2 h;生物素化羊抗兔IgG,37 ℃温浴30 min;SABC复合物,37 ℃温浴30 min;DAB显色,苏木精复染,脱水、透明、封片。每一组均设阴性对照,以PBS代替一抗。一抗和SABC免疫组织化学试剂盒,均购于武汉博士德生物工程公司。
1.3 结果判定及分析
每个标本随机选取6张切片,光学显微镜下,每张切片随机观察3个视野,阳性部位呈棕黄色,根据着色深浅,将着色强度分为强阳性(+++)、阳性(++)、弱阳性(+)和阴性(-)。并将图像输入Image Pro Plus图像分析系统(泰山医学院基础研究所),分别测得各实验组输卵管上皮中阳性细胞的平均光密度(OD值),并绘出直条图,组间比较采用t检验。
2 结 果
2.1 输卵管上皮中LHR免疫组化染色结果及图像分析
各组LHR阳性着色主要见于输卵管上皮细胞游离缘,高倍镜下可见着色部位主要位于细胞表面的纤毛或微绒毛,部分上皮细胞内亦有阳性着色。在孕1 d,输卵管的上皮细胞呈强阳性(+++)着色(图1)。于孕4 d,上皮着色稍减弱(++),但仍显著强于动情期和孕6 d组(图2、3、4)。
2.2 输卵管上皮中Caspase-3免疫组化染色结果及图像分析
光镜下观察,Caspase-3免疫阳性产物主要分布于输卵管上皮细胞的胞浆内。输卵管上皮细胞的着色在动情期组最强(+++)(图5),在孕早期各组的着色呈现逐渐减弱的趋势,孕4 d降至最低,至孕6 d着色又有所增强(图6、7、8)。
2.3 输卵管上皮中Bcl-2免疫组化染色结果及图像分析
Bcl-2阳性着色部位与Caspase-3相仿,主要分布于输卵管上皮细胞的胞浆内。而且Bcl-2的着色与LHR有相似的变化规律,即孕1 d组上皮着色最深(+++)(图9),孕4 d组上皮着色减弱(++),至孕6 d时着色(+)已低于动情期的水平(++)(图10、11)。

图1 孕1 d输卵管LHR阳性着色。标尺示100 μm
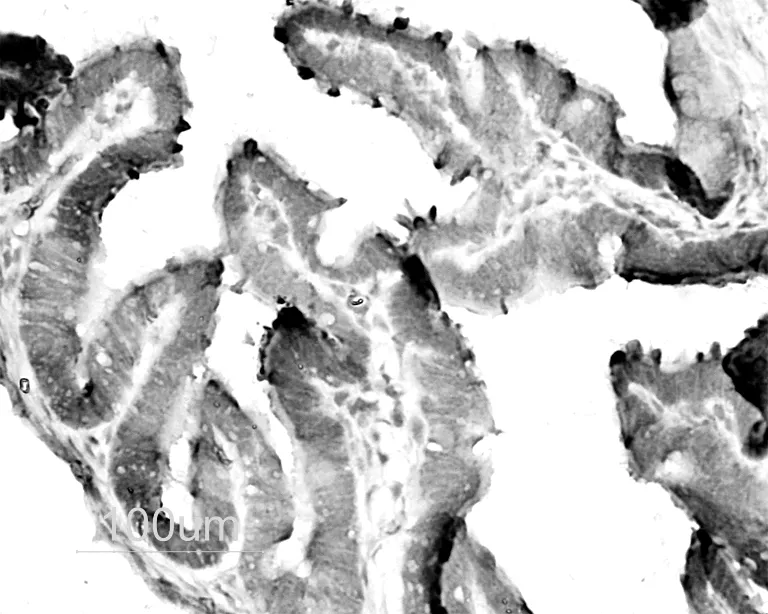
图2 孕4 d输卵管LHR阳性着色。标尺示100 μm
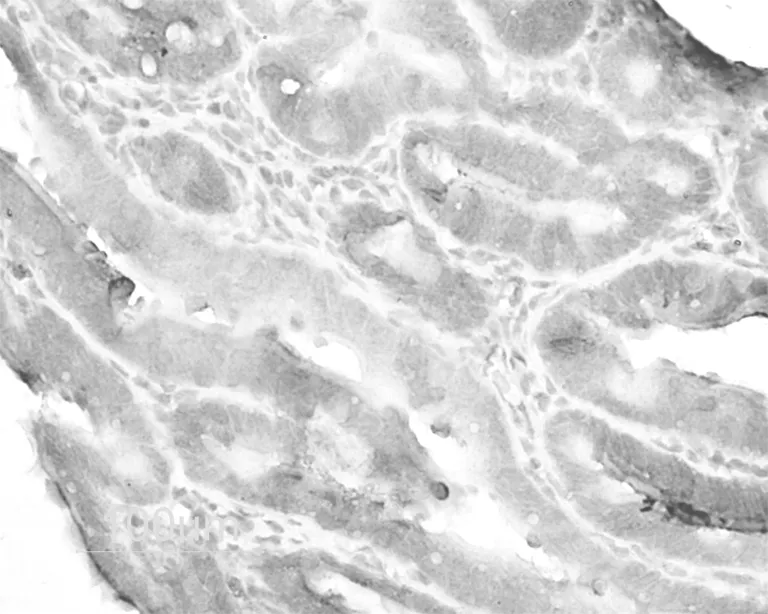
图3 孕6 d输卵管LHR阳性着色。 标尺示100 μm
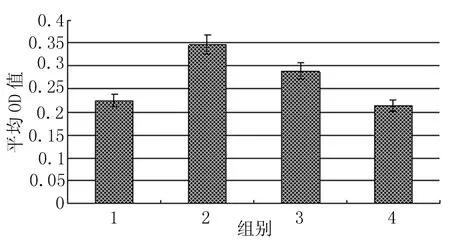
图4 各组小鼠输卵管上皮LHR水平的变化
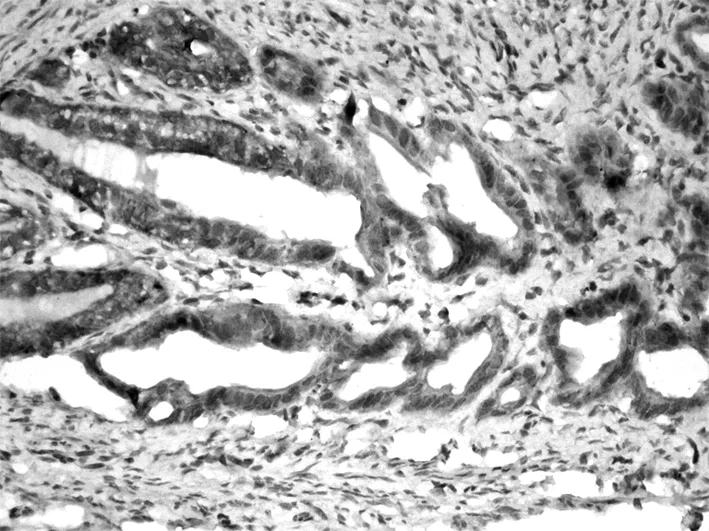
图5 动情期输卵管Caspase-3阳性着色。×200
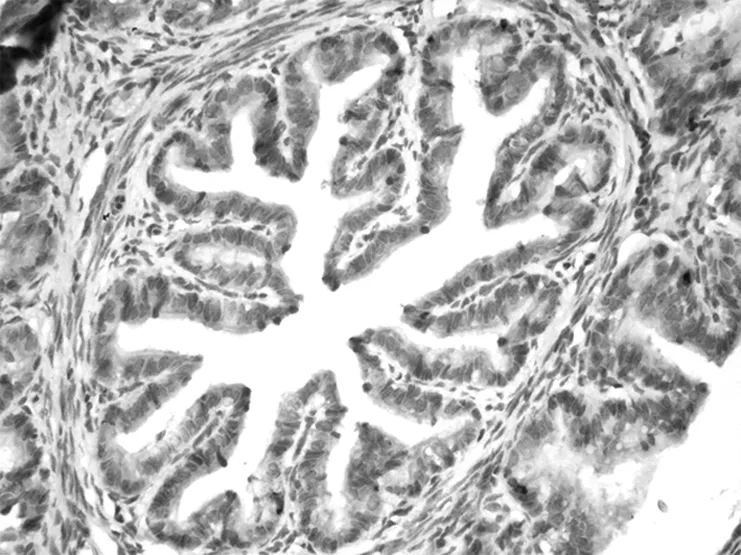
图6 孕4 d输卵管Caspase-3阳性着色。×200

图7 孕6 d输卵管Caspase-3阳性着色。×200
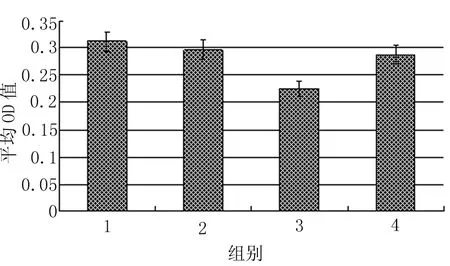
图8 各组小鼠输卵管上皮Caspase-3水平的变化

图9 孕1 d输卵管Bcl-2阳性着色。×200
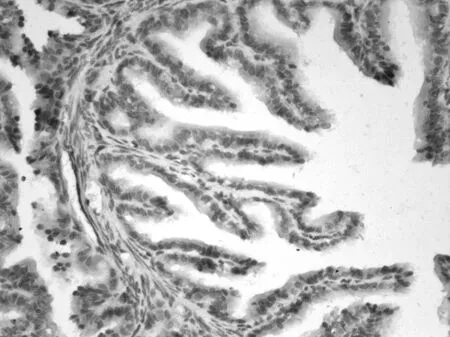
图10 孕6 d输卵管Bcl-2阳性着色。×200
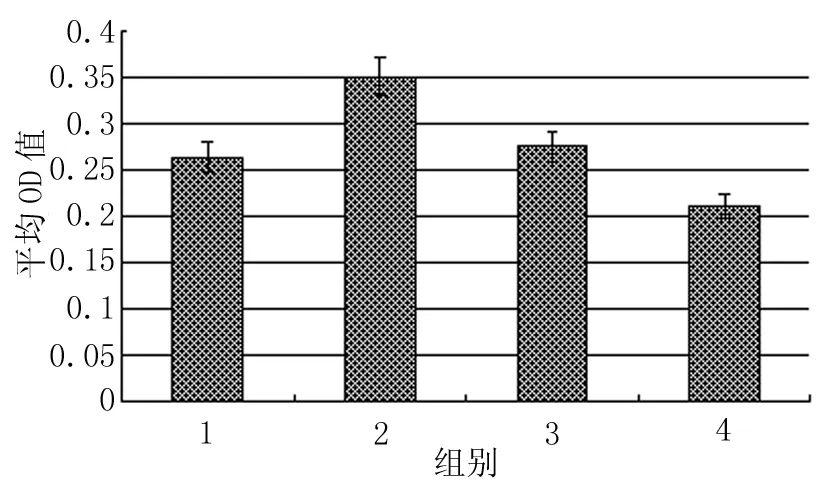
图11 各组小鼠输卵管上皮Bcl-2水平的变化
3 讨 论
小鼠输卵管分伞部、壶腹部、峡部和间质部。由于部位不同,黏膜皱襞高低、多少均不同。在输卵管峡部横断面上略呈十字样的狭小管腔,至壶腹部时,在横切面上管腔充满了纵横曲折的皱襞,输卵管伞端切面呈高度树枝状。我们根据皱襞形态,仅对输卵管壶腹部和峡部进行观测。壶腹部是精子和卵子受精的场所。峡部是精子获能、发生顶体反应和贮存的主要部位。另外,小鼠的排卵是自发排卵(spontaneous ovulation),排卵时间为动情开始后2~3 h,孕1 d时受精卵已形成并进入输卵管,大约孕4.5~6 d胚胎进入子宫腔并开始着床。
LHR属于G蛋白耦联受体(G protein-coupled receptor, GPCR)超家族中的糖蛋白受体亚家族成员,通过与LH结合而发挥作用,主要分布于性腺组织(睾丸Leydig细胞、卵巢颗粒细胞和黄体细胞)和非性腺组织(子宫、前列腺和乳腺)[5-7]。本实验表明,LHR主要分布于围着床期小鼠输卵管上皮细胞胞浆内,这与Zhang M等报道的LHR在输卵管上皮阴性表达不同[8]。Zhang M等在研究中应用的是C57BL/6雌鼠,取材时也未考虑动情周期,是否与实验材料和动情周期有关,有待证实。我们观察到,LHR在孕1 d和孕4 d组输卵管峡部和壶腹部的上皮细胞着色最强,明显高于动情期和孕6 d组的水平(P﹤0.05)。在动情期,排卵前出现LH峰,而此时输卵管上皮细胞LHR的表达未达峰值,提示LHR的表达不仅由LH本身所诱导,还受雌孕激素、hCG等其他因素的调节[9-11]。在输卵管壶腹部LHR的峰值于孕1 d时出现,而在输卵管峡部于孕4 d时出现,这可能与早期胚胎对输卵管上皮细胞的局部调节有关。
Caspase-3 是半胱氨酸蛋白酶(Caspase) 家族中的一个重要成员,作为细胞凋亡蛋白酶级联反应中一个主要效应因子,参与多种因素诱导的细胞凋亡。Xu JS等的研究发现,人输卵管细胞可维持与其共培养的卵裂期鼠胚线粒体膜电位,抑制Caspase的活性,促进鼠胚发育[1]。Bcl-2可对多种因素诱导的细胞凋亡起抑制作用,使细胞生存期延长。我们的研究表明,Caspase-3和Bcl-2主要存在于围着床期小鼠输卵管上皮细胞的胞浆内,且在输卵管峡部和壶腹部的上皮细胞中具有相同的变化规律,提示它们可能具有相似的调控机制。Caspase-3在动情期的水平最高,在孕早期呈现逐渐下降的趋势,孕4 d降至最低,至孕6 d又有所回升。Bcl-2于孕1 d达到峰值,且在孕1 d和孕4 d的水平明显高于动情期和孕6 d组。提示输卵管上皮细胞Caspase-3和Bcl-2的表达可能是按照配子和胚胎的需要来进行调节的,表现为动情期(排卵前后)输卵管上皮细胞Caspase-3的水平较高,从孕1 d开始,Bcl-2的表达上调,Caspase-3的表达下调,导致输卵管上皮细胞对凋亡的抵抗性增强,以促进输卵管上皮细胞的功能,满足受精和早期胚胎发育的需要;孕6 d时,胚胎已离开输卵管,此时Caspase-3的表达上调,Bcl-2的表达下调,输卵管上皮细胞的功能减弱。
研究结果还显示,LHR和Bcl-2具有相似的变化规律,即均在孕1 d和孕4 d高表达,而Caspase-3在孕1 d和孕4 d低表达。说明LHR、Caspase-3和Bcl-2的表达可能具有一定的相关性。已有研究证实,Bcl-2可通过抑制Caspase的激活底物如细胞色素C、凋亡诱导因子(AIF)等从线粒体释放到细胞质,而抑制细胞凋亡,这与本研究中Caspase-3和Bcl-2的反向表达同时出现是一致的。Tai P等研究发现,LH不仅可以促进出生后睾丸Leydig细胞的增殖,而且可以通过激活LHR,经ERK1/2 通路抑制Leydig细胞的凋亡[12~13]。由此我们推测,在孕1 d和孕4 d时,活化后的LHR可能以相似的机制导致了输卵管上皮细胞的增殖,同时抑制输卵管上皮细胞的凋亡,以增强输卵管上皮细胞的功能,促进受精和早期胚胎发育。
上述实验结果提示,LHR、Caspase-3和Bcl-2的表达与围着床期小鼠输卵管上皮细胞的功能密切相关,并且LHR、Caspase-3和Bcl-2的表达可能具有一定的相关性,可能是由于LHR的活化导致了输卵管上皮细胞的增殖,同时抑制输卵管上皮细胞凋亡的结果。对于LHR活化的原因,LHR调节输卵管上皮细胞增殖和凋亡的具体机制,以及这些分子与胚胎和其他调节因子的关系等,还有待进一步研究。
[1] Xu JS, Chan ST, Ho PC, Yeung WS, et al. Coculture of human oviductal cells maintains mitochondrial function and decreases caspase activity of cleavage-stage mouse embryos[J]. Fertil Steril, 2003, 80(1):178-183.
[2] Menon KM, Munshi UM, Clouser CL, et al. Regulati on of luteinizing hormone / human chorionic gonadotropin receptor expression: a perspective[J]. Biol Reprod, 2004, 70(4): 861-866.
[3] Puett D, Li Y, Angelova K, et al. Structure-function relationships of the luteinizing hormone receptor[J]. Ann N Y Acad Sci, 2005, 1061(2): 41-54.
[4] 石运芝, 魏丽华, 葛丽, 等. 围着床期小鼠卵巢黄体生成素受体和血管内皮生长因子表达的免疫组织化学研究[J]. 解剖学报, 2009, 40(4):664-667.
[5] Mukherjee D, Manna PR, Bhattacharya S. Functional relevance of luteinizing hormone receptor in mouse uterus[J]. Eur J Endocrinol,1994,131:103-108.
[6] Friedman S, Guevich M, Shemesh M. Bovine cyclic endometrium contains high-affinity luteinizing hormone/human chorionic gonadotropin receptor[J]. Biol Reprod, 1995, 52:1020-1026.
[7] Derecka K, Pietila EM, Rajaniemi HJ, et al. Cycle dependent LH/hCG receptor gene expression in porcine nongonadal reproductive tissues[J]. J Physiol Pharmacol,1995,46:77-85.
[8] Zhang M, Shi H, Segaloff DL, et al. Expression and localization of luteinizing hormone receptor in the female mouse reproductive tract[J]. Biol Reprod,2001 Jan,64(1):179-187.
[9] Dufau M L. Endocrine regulation and communicating function of the Leydig cell[J]. Annu Rev Physiol,1988, 50:483-508.
[10] Roy S K. Epidermal growth factor and transforming growth factor-β modulation of follicle-stimulating hormone induced deoxyribonucleic acid synthesis in hamster preantral and early antral follicles[J]. Biol Reprod, 1993, 48(3):552-557.
[11] Peng XR, Hsueh AJ, LaPolt PS, et al. Localization of luteinizing hormone r eceptor messenger ribonucleic acid expression in ovarian cell types during follicle development and ovulation[J]. Endocrinology, 1991, 129(6):3200-3207.
[12] Tai P, Shiraishi K, Ascoli M. Activation of the lutropin/choriogonadotropin receptor inhibits apoptosis of immature Leydig cells in primary culture[J]. Endocrinology, 2009, 150(8):3766-3773.
[13] Shiraishi K, Ascoli M. A co-culture system reveals the involvement of I ntercellular pathways as mediators of the lutropin receptor (LHR)-stimulated ERK1/2 phosphorylation in Leydig cells[J]. Exp Cell Res, 2008, 314(1):25-37.

