杜仲多糖对糖尿病小鼠降血糖作用及其机制研究*
刘国荣,邱立朋,周延萌,辛晓明*,髙允生
(1.苍山县人民医院药剂科,山东,临沂 277700;2.泰山医学院药学院,山东,泰安 271016)
杜仲多糖(Eucommia ulmoides Oliv Polysaccharides,EOP)是从杜仲科植物杜仲的干燥树皮中提取的水溶性糖性成分,是近年来发现的杜仲又一活性成分。笔者前期研究发现其有抗肿瘤[1]、免疫促进[2]、抗炎[3]、提高机体的耐缺氧能力[4]等作用。
本次实验通过建立糖尿病小鼠模型,验证EOP的降糖作用,并初步探讨其作用机制,为传统中药杜仲资源的开发利用提供理论依据。
1 材料与方法
1.1 动物
昆明种小鼠,18~24g,♂♀各半,由泰山医学院动物实验中心提供(动物合格证号:鲁动质字070103),实验前饲养3d。
1.2 主要仪器
Spectrumlab54紫外见分光光度计,上海棱光技术有限公司;电子分析天平FC104,奥豪斯(上海)公司;LXJ-IIB型低速大容量离心机,上海安亨科学仪器厂;活力型血糖检测仪(德国罗氏诊断公司);活力型血糖试纸(德国罗氏诊断公司)。
1.3 主要试剂
EOP提取物(水提醇沉法制备,含量:55.24%);消渴丸(广州中一药业有限公司,批号:国药准字Z44020045);四氧嘧啶(北京拜儿迪生物公司,批号: A-7413);其余试剂均为分析纯;NO试剂盒,NOS试剂盒,考马斯亮兰试剂盒,SOD试剂盒,MDA试剂盒,均购自南京建成生物工程研究所。
1.4 糖尿病小鼠模型的制备
将小鼠禁食12h(不禁水),然后按250mg·kg-1ip 2%的四氧嘧啶溶液[5]。 3d后,禁食12h,尾尖采血,测其血糖含量,以空腹血糖大于10.0mmol·L-1者为糖尿病小鼠,模型不成功者,再次ip四氧嘧啶案300mg·kg-1,三天后,测其血糖含量,以空腹血糖大于10.0mmol·L-1者为糖尿病小鼠[6],且出现糖尿病三多一少的症状,即多尿多饮多食体重减轻,得50只成功的糖尿病小鼠模型。
1.5 小鼠的分组及处理方法
将糖尿病小鼠按体重随机分为5组,每组10只,分别为糖尿病模型组、消渴丸阳性对照组、EOP低剂量组(100mg·kg-1)、EOP中剂量组(200 mg·kg-1)、EOP高剂量组(400 mg·kg-1)。另以10只同批次健康小鼠作空白对照组。
空白对照组和糖尿病模型组以生理盐水ig,阳性对照组以消渴丸ig,实验组以不同浓度的EOP溶液ig,容量均为(0.2ml·10g-1),连续10天。末次给药后禁食(不禁水)3h,尾尖取血,测其空腹血糖。
1.6 指标的检测
1.6.1小鼠一般情况观察
从实验开始每天观察小鼠的皮毛、反应、活动和大便等一般情况。
1.6.2脏器指数的计算
小鼠眼球取血后处死,解剖分别取胸腺和脾脏,称重,计算胸腺指数与脾脏指数。
胸腺指数=胸腺平均重量(mg)/小鼠平均体重(g)
脾脏指数=脾脏平均重量(mg)/小鼠平均体重(g)
1.6.3抗氧化和血管扩张活性因子主要生化指标的测定
按照各试剂盒说明书取5ul的血清测SOD,100ul的血清测MDA,10%肝组织匀浆上清测定NO和NOS。
1.7 统计学处理

2 结 果
2.1 各组小鼠一般情况比较
造模前小鼠和正常对照组皮毛柔软有光泽、反应灵敏、活动较多、大便成形。模型组小鼠出现三多一少等糖尿病症状,饮食、饮水和尿量增加,并出现皮毛无光泽、耸起、拱背、活动减少、反应迟钝、大便溏等症状。EOP治疗组大部分小鼠上述症状基本消失或减轻,反应较灵敏,活动增多。
2.2 EOP对小鼠血糖和脏器指数的影响
模型组小鼠的血糖d10出现增高趋势;与模型组比较,EOP低、中剂量组小鼠血糖明显降低(P<0.01,P<0.05),EOP高剂量能够明显升高糖尿病小鼠的胸腺指数和脾脏指数,见表1。
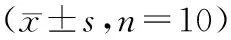
表1 杜仲多糖对小鼠血糖和脏器指数的影响
注:与模型组比较,*P<0.05,**P<0.01
2.3 抗氧化和血管扩张活性因子主要生化指标的测定
模型组较正常对照组MDA 含量明显升高,SOD含量明显降低, NO含量明显升高,NOS含量降低;EOP中、高剂量组能够显著降低小鼠血液中MDA 含量,升高SOD含量,EOP高剂量组能够降低NO含量,升高NOS含量,见表2。
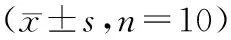
表2 杜仲多糖对小鼠生化指标的影响
注:与模型组比较,**P<0.01,*P<0.01
3 讨 论
本次实验两次注射四氧嘧啶,成模率较高。成模后的小鼠完全符合糖尿病三高一低症状,食量、尿量以及饮水量明显升高。
由表1看,模型组小鼠的血糖在实验过程中有增高趋势,与模型组比较,EOP低、中剂量组小鼠血糖明显降低,说明EOP有降低血糖的作用,尤其是低剂量降血糖作用显著。
胸腺和脾脏是机体的免疫器官,胸腺和脾脏重量与体重的比值(即胸腺指数、脾脏指数)是衡量胸腺和脾脏功能正常与否的一项重要指标[7]。从实验结果中可明显看出(表1)四氧嘧啶致糖尿病各组与正常组小鼠相比,小鼠的胸腺指数和脾脏指数均明显下降,表明糖尿病可显著抑制小鼠胸腺与脾脏的发育,对小鼠免疫功能损害严重。但是与糖尿病模型组相比,EOP则可提高小鼠胸腺指数与脾脏指数,表明EOP能提高小鼠非特异性免疫功能。
超氧化物歧化酶(SOD)对机体的氧化与抗氧化平衡起着至关重要的作用,能清除超氧阴离子(O2-),保护细胞免受损伤,因而SOD活性的高低与衰老、肿瘤、炎症、自身免疫病、血液病和肾脏病都有密切联系[8,9]。机体产生的氧自由基攻击生物膜中不饱和脂肪酸,引起脂质氧化作用,形成脂质过氧化物,如丙二醛(MDA)等,丙二醛的含量常常反映机体内脂质过氧化的程度,间接反映出细胞受伤程度。MDA的测定常与SOD的测定相互配合,SOD活性高低间接反映机体清除自由基的能力,而MDA的高低又反映了细胞受自由基攻击的程度[10]。
表2显示,糖尿病小鼠血清MDA含量明显升高,同时,SOD活性明显下降。通过ig不同剂量的EOP和消渴丸后,MDA含量有所下降,其中中剂量组和消渴丸阳性对照组下降最多;中剂量组和高剂量组SOD活性升高最为明显。
NO由L-精氨酸和分子氧为底物经NOS催化合成,是一种重要的免疫和炎性介质,具有舒张血管、松弛血管平滑肌和抑制内皮细胞增殖等多种生理功能,与糖尿病及并发症的发生发展有密切的关系[11]。
实验结果显示,糖尿病模型小鼠肝脏匀浆NO含量明显升高,NOS活性降低不很明显。经ig给药后,相对于模型组,阳性组和高剂量组肝匀浆NO含量均明显降低;EOP高剂量组小鼠肝匀浆NOS活性有所增加,但是略低于消渴丸阳性组NOS活性的增加值。
由以上分析可知,EOP能够降低糖尿病小鼠的血糖值,并且在一定程度上可升高糖尿病小鼠胸腺指数与脾脏指数,升高体内SOD与NOS的活性,降低MDA与NO的含量,因此其降血糖作用机理可能与其提高糖尿病小鼠的免疫力与体内抗氧化能力有关。
[1] 辛晓明,王大伟,赵娟等.杜仲多糖的抗肿瘤作用的实验研究[J].医药导报,2009,28(6):719-721.
[2] 辛晓明,王浩,冯蕾等.杜仲多糖对环磷酰胺致免疫低下小鼠的调节作用[J].中国中医药信息杂志,2007,14(10):28-29.
[3] Xin xiao-ming, Zhang qing-zhu, Wang hao.The extraction of eucommia ulmoides oliv polysaccharides and its protective effect on liver of Cyclophosphamidecy injured mice[J].中华中医药学刊,2007,25(9):1898-1899.
[4] 辛晓明,王远丽,王浩等.杜仲多糖的提取及其对小鼠耐缺氧能力的影响[J].医药导报,2009,28(2):160-162.
[5] 胡艳丽,陈文,安富贵.番茄纤维对糖尿病小鼠的降血糖作用研究[J].现代预防医学,2007,34(3):432-433.
[6] 郜红利,肖本见,梁文梅.山药多糖对糖尿病小鼠降血糖作用[J].中国卫生医学,2006,22(7):804-805.
[7] 吴建中,陈静.番石榴多糖对糖尿病小鼠的血糖及胸腺指数的影响[J].天然产物的研究与开发.2007,19(1):84-87.
[8] Hongbin Chen,Ruizhi Feng,Yi Guo et al.Hypoglycemic effects of aqueous extract of Rhizoma Polygonati Odorati in mice and rats[J].Journal of Ethnopharmacology,2001,74:225-229.
[9] Shrabana Chakrabaiti,Tuhin Kanti Bisxwas.Advanced studies on the hypoglycemic effect of Caesalpinia bonducella F.in type 2 diabetes in Long Evans rats[J].Journal of Ethnopharmacology,2003,84:41-46.
[10] 刘方,武子斌,牛淑敏,等.中药材抗氧化及自由基清除活性的研究[M].中国药学杂志,2001,36(7):442-445.
[11] Lgnarro LJ, Buga Gm,Wood Ks,et al.Endothelium-derived relaxing factor produced and released from artery and vein is nitric oxide[J].proc Natl acad Sci USA,1997,84:9265-9269.

