MMP-2、MMP-9和Col IV在乳腺导管癌中的表达及其相关性
苏书娟, 邢鲁奇, 陈登庭, 蔡向前, 孙硕彤
肿瘤的浸润转移是一个多步骤、多阶段的复杂过程,涉及到肿瘤细胞穿过细胞外基质屏障、血管基底膜及血管壁进入宿主微环境等多个环节。在这个过程中有一个重要而且贯穿始终的因素就是细胞外基质(extracellular matrix, ECM)和基膜(basement membrane, BM)的降解。IV型胶原(Collagen IV, Col IV)是细胞外基质的主要成分,构成基膜并调控细胞粘附,近年来发现其与恶性肿瘤的浸润扩散有关[1]。MMP-2、MMP-9可以特异性地降解基膜的主要功能成分Col IV和细胞外基质而与肿瘤浸润和转移关系密切。我们用免疫组化双染法分析MMP-2、MMP-9和Col IV在乳腺导管癌的表达及其相关性,并探讨其与临床病理参数之间的关系。
1 材料与方法
1.1 材料 选用河南科技大学第一附属医院病理科2008—2010年的乳腺癌蜡块60例,其中导管内癌18例,微浸润性导管癌12例,浸润性导管癌30例。所有患者均为女性,年龄30~81岁,中位年龄48岁。肿瘤直径≤2 cm 29例,>2 cm 31例。腋下有淋巴结转移23例,无淋巴结转移37例。雌激素受体(estrogen receptor,ER)阳性38例,阴性22例。孕激素受体(progesterone receptor,PR)阳性35例,阴性25例。上皮钙黏蛋白(epithelia cadherin,E-cad)阳性54例,阴性6例。C-erbB-2阳性47例,阴性13例。所有病例术前均未做过放疗、化疗、内分泌治疗等。另选10例正常乳腺组织作为对照组。
1.2 试剂 浓缩型鼠抗人MMP-2单克隆抗体、即用型鼠抗人MMP-9单克隆抗体、即用型鼠抗人Collagen IV单克隆抗体、Dou SP免疫组化双染试剂盒,均购于福州迈新生物工程有限公司。
1.3 免疫组化双染 为了控制MMP-2、MMP-9和Col IV双染结果的可靠性,采用福州迈新公司提供的双染阳性片做对照,用PBS代替一抗作为阴性对照。4 μm切片脱蜡、水化,蒸馏水浸泡(10 min),胃酶修复及内源性过氧化酶阻断,血清封闭,滴加MMP-2(工作浓度1∶30)、MMP-9 4℃过夜16 h,生物素标记的二抗(10 min),链霉菌抗生物素-碱性磷酸酶溶液(10 min),BCIP/NBT显色。滴加双染增强液(20 min),血清封闭,滴加Collagen IV室温下2 h,生物素标记的二抗(10 min),链霉菌抗生物素-过氧化酶溶液(10 min),AEC显色。苏木素复染,水性封片剂封片。
1.4 结果判定 MMP-2和MMP-9定位于胞浆,光学显微镜下细胞质中出现蓝黑色颗粒或者弥漫性棕褐色染色(BCIP/NBT/碱性磷酸酶显色系统)为阳性。采用阳性细胞百分比并结合显色强弱进行判断。计数100个细胞呈现的阳性细胞数,结合显色强弱分别为:阴性(-)不显色;弱阳性(+)25%;中度阳性(++)26%~50%;强阳性(+++)>50%。Col IV(AEC/过氧化酶显色系统)也定位于胞浆,阳性反应为胞浆出现弥漫红色(AEC/过氧化酶显色系统),用于标记基膜。Col IV阳性:肿瘤细胞与基质间有连续的红色染色带或者肿瘤细胞基膜染色带偶有断裂,但主要形式是连续的;Col IV阴性:大部分肿瘤细胞周边红色基膜染色带缺乏或者呈不连续的碎片状。
1.5 统计学处理 采用SPSS17.0统计学软件对结果进行列联表χ2检验及Spearman等级相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺导管癌中MMP-2 、MMP-9和Col IV的表达 MMP-2在乳腺导管内癌、微浸润性导管癌、浸润性导管癌的表达率分别为72.2%、75.0%、76.7%,明显高于正常乳腺组织(10%);MMP-9在乳腺导管内癌、微浸润性导管癌、浸润性导管癌的表达率分别为72.2%、83.3%、83.3%,也明显高于正常乳腺组织(10%);Col IV在乳腺导管癌和正常乳腺组织中的表达率分别是38.3%和100.0%。三者在正常组织和癌组织的表达差异均有统计学意义(P<0.05),见表1。
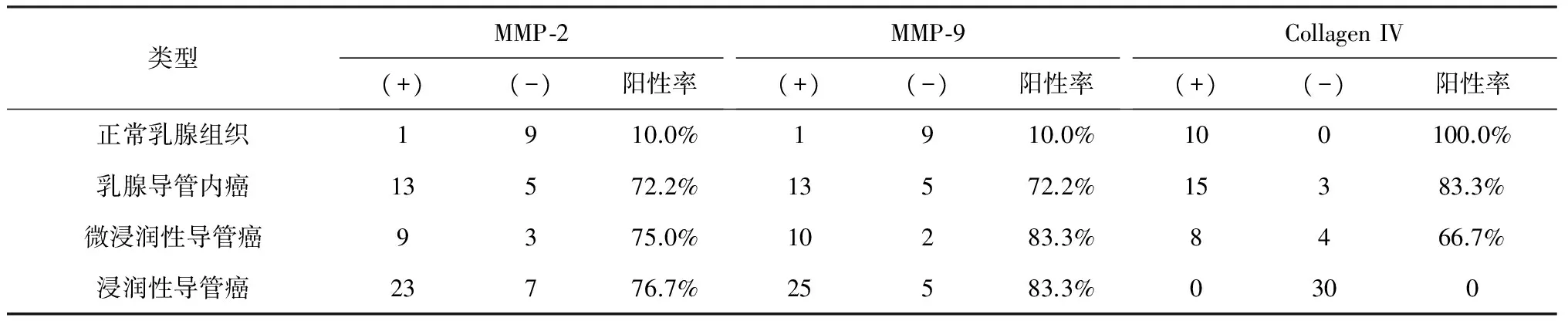
表1 MMP-2、MMP-9和Collagen IV在乳腺正常组织和乳腺导管癌中的表达
MMP-2和MMP-9在乳腺导管内癌和微浸润性导管癌中的表达有明显的靠边趋势,在同一个导管中,它们在导管中央的表达强度低于导管外周接近基膜处的表达强度,甚至有的导管内癌仅在接近基膜处有MMP-2、MMP-9的阳性表达。在微浸润导管癌中,MMP-2、MMP-9在刚突破或者将要突破基膜处表达增强,呈弥漫的巢状或者团状,如图1、2所示。另外,有些临近癌细胞的间质也有MMP-2、MMP-9的少量表达。
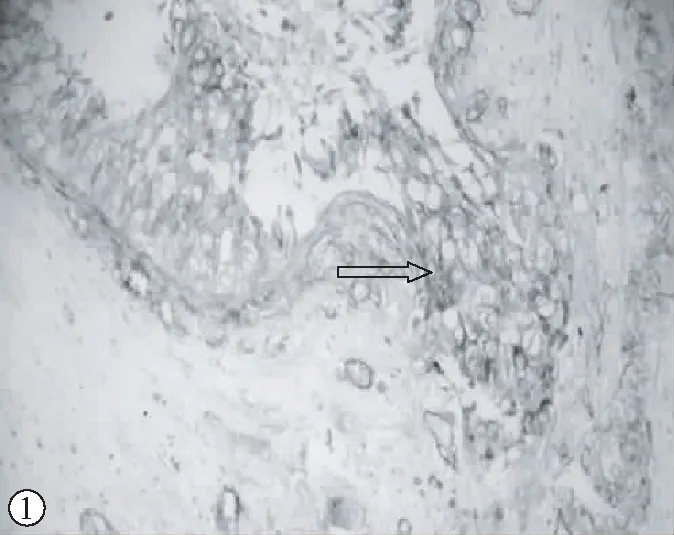
图1 MMP-2在乳腺导管癌中的表达,在导管外突处表达较强,此处Col IV消失(免疫组化双染×200)
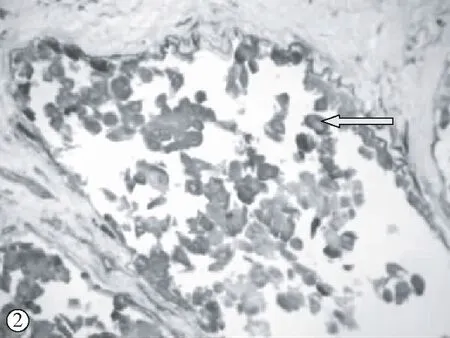
图2 MMP-9在乳腺导管内癌中的表达,在导管边缘靠近基膜处表达较强,周边的Col IV断续存在(免疫组化双染×400)
2.2 MMP-2、MMP-9的表达与临床病理参数间的关系 MMP-2、MMP-9在不同年龄组、PR、ER、E-cad分组间的表达差异均无统计学意义(均P>0.05);而在肿瘤直径>2 cm、有淋巴结转移及C-erbB-2阳性的乳腺导管癌组织中的表达显著高于相应对照组(均P<0.05),见表2。
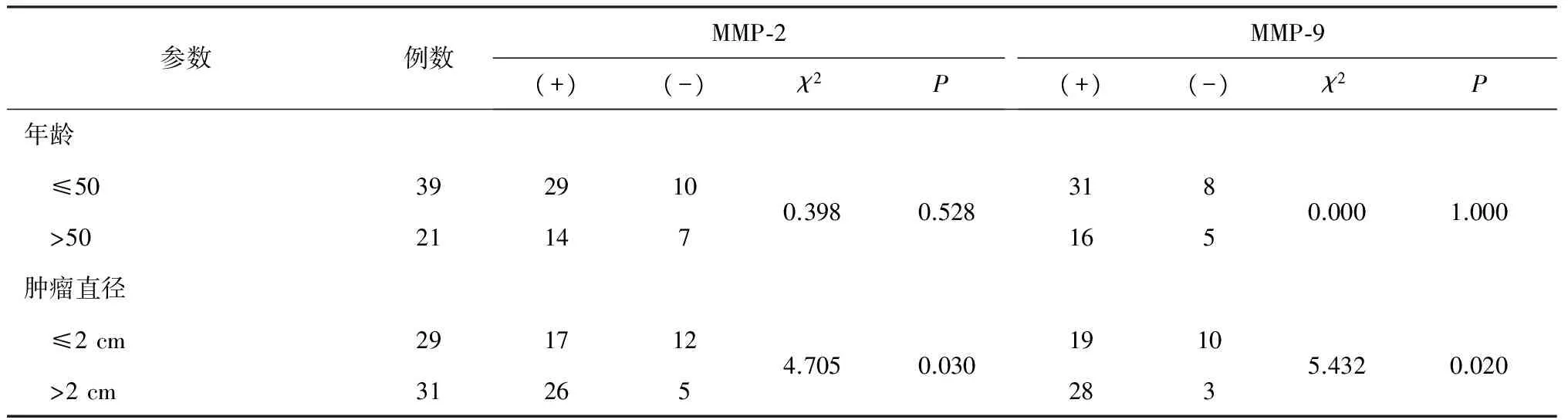
表2 MMP-2、MMP-9的表达与临床病理参数间的关系
续表
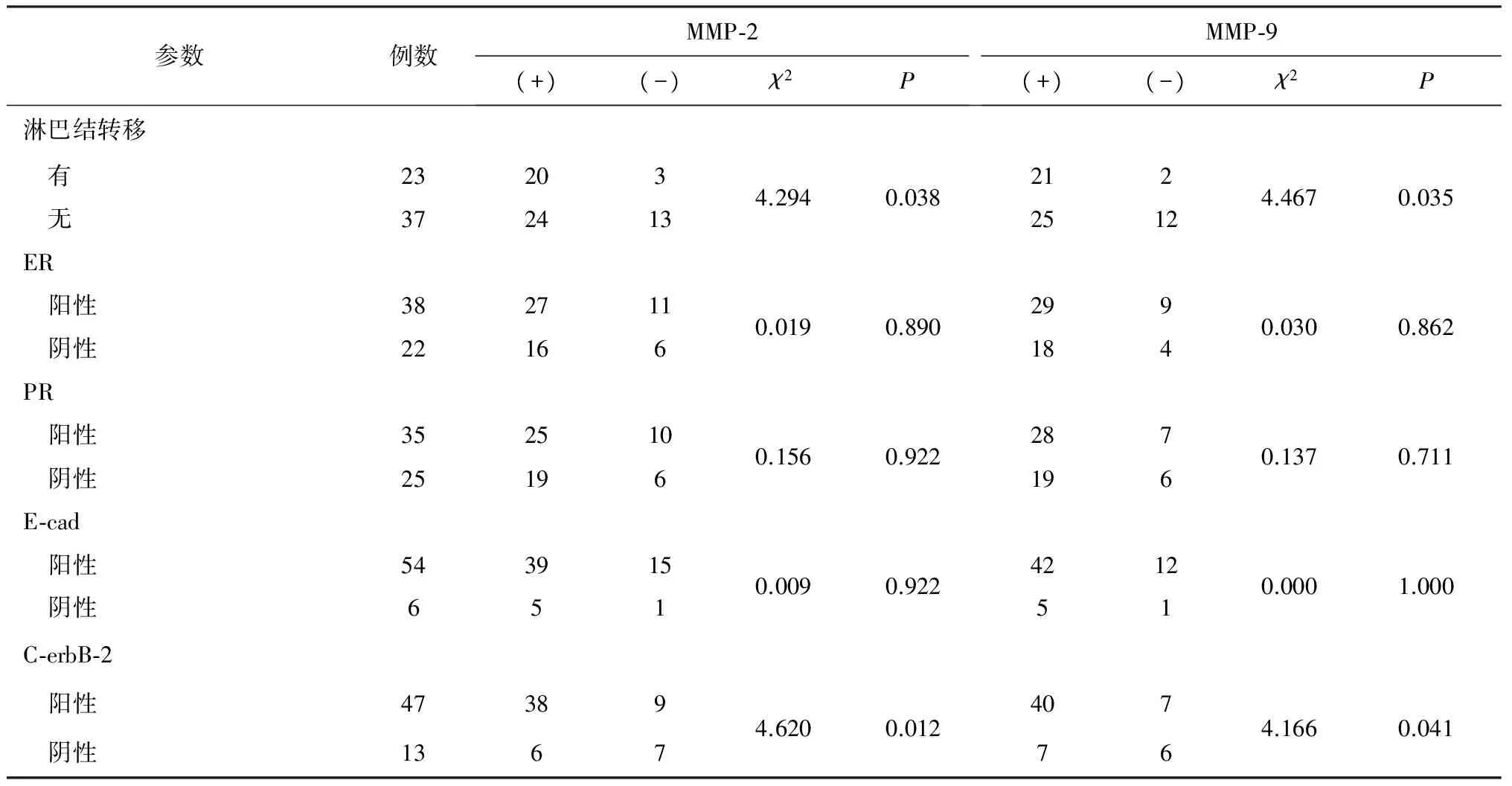
参数例数MMP⁃2(+)(-)χ2PMMP⁃9(+)(-)χ2P淋巴结转移 有23203 无3724134.2940.03821225124.4670.035ER 阳性382711 阴性221660.0190.8902991840.0300.862PR 阳性352510 阴性251960.1560.9222871960.1370.711E⁃cad 阳性543915 阴性6510.0090.9224212510.0001.000C⁃erbB⁃2 阳性47389 阴性13674.6200.012407764.1660.041
2.3 MMP-2、MMP-9的表达与Col IV表达的相关性分析 Col IV的表达与MMP-2表达间呈负相关(r=-0.506,P<0.05),与MMP-9的表达也呈负相关(r=-0.501,P<0.05),即随着MMP-2、MMP-9表达的增加,Col IV的表达降低,见表3。
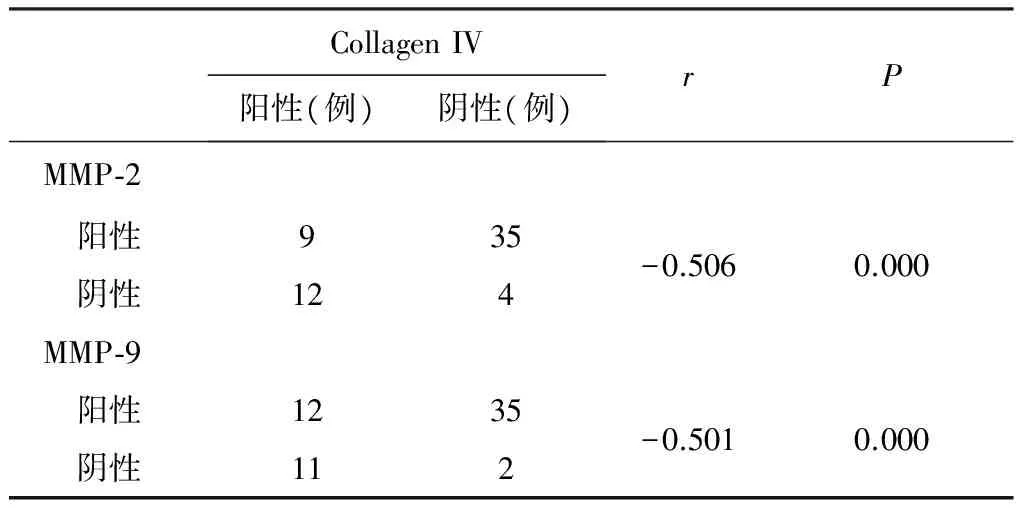
表3 MMP-2、MMP-9与Collagen IV的相关性分析
3 讨论
乳腺癌的浸润和转移是复杂的多步骤序贯过程,是众多因子相互协调及共同作用的结果[2]。肿瘤细胞与细胞外基质、基膜的相互作用是浸润转移的关键步骤,由肿瘤细胞和周围间质合成和分泌的MMPs,能够降解细胞外基质和基膜的大部分组分,导致肿瘤的组织结构发生变化,以利于其进一步侵袭和转移扩散。MMP-2、MMP-9可以通过降解基膜和细胞外基质并影响组织重塑促进肿瘤细胞的浸润、转移和血管形成[3]。
本研究结果表明,MMP-2、MMP-9在乳腺导管癌组织中的表达远高于乳腺正常组织,而Col IV的表达在乳腺导管癌组织中远低于乳腺正常组织,且Col IV在乳腺癌中的表达和MMP-2、MMP-9的表达呈负相关,说明在肿瘤浸润转移的过程中,伴随了MMP-2、MMP-9的增加和Col IV的不断降解。以Col IV为骨架的基膜是反映肿瘤早期浸润的一个指标,也是判断肿瘤浸润强度和腋窝淋巴结受累的一个较早的预示因子[4],因此联合检测MMP-2、MMP-9和Col IV的表达可能有助于判断乳腺癌的浸润转移倾向,为其诊断和预后提供某些可能的依据。在所有的浸润性导管癌中均未见连续的Col IV的表达,说明Col IV已被浸润癌中分泌的MMPs所降解。另外,MMP-2、MMP-9在乳腺导管内癌和微浸润导管癌中的表达,有明显的靠边趋势,在同一个导管中,它们在中央的表达强度低于导管周边靠近基膜处的表达强度或者仅在导管接近基膜处和将要突破基膜处有表达,说明这些靠近基膜边缘的肿瘤细胞可能已经具有一定的侵袭和转移潜能,能分泌较多的MMP-2、MMP-9等物质存在于肿瘤侵袭的前沿,并与基膜发生相互作用,它们的含量可能作为预后的指标。MMP-2、MMP-9在浸润性导管癌的癌细胞和癌旁的间质细胞均有表达,说明这些癌旁的间质细胞也具备分泌某些基质金属蛋白酶的能力,并且有可能也是潜在的促进癌细胞浸润和转移的生化基础。
Hanemaaijer等[5]发现在乳腺癌组织中MMP-2、MMP-9的活性较纤维腺瘤明显升高,MMP-2、MMP-9高表达的乳腺癌侵袭性和转移性较高,并与肿瘤的分化程度和组织学分级、TNM分期有关。我们的研究也发现MMP-2、MMP-9在肿瘤直径>2 cm和有淋巴结转移的乳腺导管癌组织中的表达高于肿瘤直径≤2 cm和无淋巴结转移的乳腺导管癌组织,这和Li等[6]报道的结果一致。乳腺癌细胞MMP-2、MMP-9高表达者,瘤体大,分化程度低,具有较高的腋窝淋巴结转移率,表明MMP-2、MMP-9可能在乳腺癌局部侵袭和远处转移中发挥重要作用,从而提示我们检测MMP-2、MMP-9的表达有助于判断乳腺癌的恶性程度和侵袭及转移潜能。另外,在乳腺癌细胞转染C-erbB-2基因能增加细胞的侵袭和转移能力,同时伴有基膜降解酶分泌的增加,包括MMP-2、MMP-9、CD44和整合素α2β3。本研究也证实了C-erbB-2的表达和MMP-2、MMP-9表达的关系,即MMP-2、MMP-9在C-erbB-2阳性组高表达,也从另一方面解释了C-erbB-2阳性的乳腺癌高侵袭、高转移的作用机制,提示我们测定乳腺癌患者MMP-2、MMP-9和C-erbB-2的表达水平能更好地反映乳腺癌组织的侵袭转移能力。
因此,我们认为在乳腺导管癌的局部侵袭和远
处转移过程中,MMP-2、MMP-9对Col IV的降解可能起重要作用。研究MMP-2、MMP-9和Col IV的异常表达可能有助于判断乳腺癌的恶性程度和浸润转移潜能,为乳腺癌的诊断和评估预后提供一些依据,或可为乳腺癌治疗找到新的靶点。
[1] Davidson B,Givant-Horwitz V, Lazarovici P,et al. Matrix metalloproteinases (MMP),EMMPRIN (extracellular matrix metalloproteinase inducer) and mitogen-activated protein kinases (MAPK): co-expression in metastatic serous ovarian carcinoma[J].Clin Exp Metastasis,2003,20(7):621-631.
[2] Van Trappen PO,Ryan A,Carroll M, et al. A model for co-expression pattern analysis of genes implicated in angiogenesis and tumour cell invasion in cervical cancer [J].Br J Cancer,2002,87(5):537-544.
[3] Bhuvarahamurthy V, Kristiansen GO, Johannsen M, et al. In situ gene expression and localization of metalloproteinases MMP1, MMP2, MMP3, MMP9, and their inhibitors TIMP1 and TIMP2 in human renal cell carcinoma [J].Oncol Rep,2006,15(5):1379-1384.
[4] 田斌,孙涛,牛虎,等.PTEN、PCNA、IV型胶原在乳腺癌中的表达及其临床意义[J].第四军医大学学报,2008,29(5):457-460.
[5] Hanemaaijer R,Verheijen JH, Maguire TM, et al. Increased gelatinase-A and gelatinase-B activities in malignant vs. benign breast tumors [J].Int J Cancer,2000,86(2):204-207.
[6] Li HC,Cao DC, Liu Y, et al. Prognostic value of matrix metalloproteinases (MMP-2 and MMP-9) in patients with lymph node-negative breast carcinoma[J].Breast Cancer Res Treat,2004,88(1):75-85.

