乳腺腺肌上皮瘤13例报告及文献复习
王环,毛玉萍,吴亮,苏志涛,陈祥义,黄卡特,董春鸽,陈国荣
(1.温州医学院附属第一医院 病理科,浙江 温州 325000;2.温州医学院附属第三医院 病理科,浙江温州 325206;3.温岭市第一人民医院 病理科,浙江 台州 317500)
乳腺腺肌上皮瘤(adenomyoepithelioma,AME)是一种双相性肿瘤,由腺上皮和肌上皮共同增生形成的。1970年首先由Hamperl[1]报道。大多数为良性,但局部切除后有复发倾向,少数情况下乳腺腺肌上皮瘤的腺上皮、肌上皮或两种成分均可转变为恶性,并发生转移。因其具有独特的形态学特点及生物学行为,有必要对其进一步深入认识。现将我们遇到的13例结合文献复习报告如下。
1 材料和方法
1.1 一般资料 收集温州医学院附属第一医院及外院经临床病理确诊的乳腺AME 13例。均为女性,年龄28~83岁,平均51岁。左乳7例,右乳6例。临床表现为乳房无痛性肿块,均位于乳腺外周。12例病程为1个月~1年;1例病程为10年,迅速增大1个月。
1.2 方法 所有标本均经10%福尔马林固定,石蜡包埋切片,常规HE染色。免疫组织化学采用EnVision两步法。选用的抗体有SMA、S-100、Desmin、P63、Calponin、SM-MHC、CK、EMA、Cam5.2、ER、PR、Ki-67。所有抗体及试剂盒均购自北京中杉生物技术有限公司。
2 结果
2.1 巨检 肿瘤与周围组织界限清楚,最大径1~6 cm,6例有包膜。12例为实性,1例为囊实性,囊内有草绿色胶冻样物。切面淡黄、灰白或灰褐色,质软或偏硬。
2.2 镜检 镜下见分布不均的腺管外周绕以明显增生的肌上皮。腺管呈圆形、椭圆形,多为小腺管,腺腔内可有嗜酸性分泌物。腺上皮呈立方形或低柱状,部分有顶浆分泌,胞质嗜酸,核圆形或卵圆形,位于基底,核仁细小或无,无明显异型,部分腺管上皮可增生呈乳头状。肌上皮排列呈巢状、片状、条索状或小梁状,多为透明肌上皮细胞,呈多边形,核圆形,可有小核仁,胞质透明,部分肌上皮细胞呈梭形,胞质微嗜酸,亦有部分肌上皮鳞化伴腺管囊性扩张(见图1)。本组AME中有1例为特殊类型的腺肌上皮瘤,肿瘤由数量不等杂乱无章的乳腺导管、小叶和成熟的脂肪及纤维组织混杂组成,良性增生的乳腺小叶间散布着大量的平滑肌和脂肪组织,乳腺小叶呈岛状漂浮在脂肪组织中(见图2)。

图1 肌上皮鳞化(HE,×40)
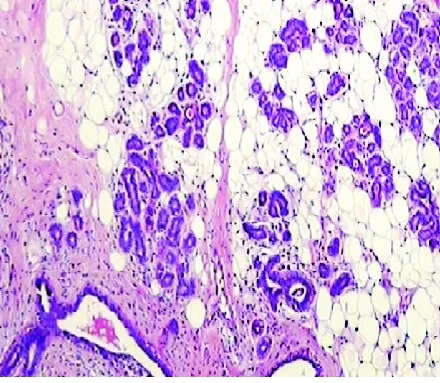
图2 肿瘤由数量不等的乳腺导管、小叶和成熟的脂肪及纤维组织混杂组成,乳腺小叶呈岛状漂浮在脂肪组织中(HE,×200)
2.3 免疫组化 13例腺上皮细胞对CK,EMA和Cam5.2呈阳性表达,肌上皮细胞对SMA,P63,Calponin,S-100及SM-MHC呈阳性反应。13例肿瘤细胞Ki-67阳性率大多≤5%,个别5%~10%提示增生活跃。其中1例腺上皮成分Cam5.2(-),ER小灶区(+),间质纤维组织及脂肪组织表达S-100蛋白(+),间质增生的梭形细胞Desmin,SMA和Calponin均(+),证实为平滑肌细胞并向横纹肌方向分化(见图3-5)。

图3 肌上皮胞核P63(+)(EnVision,×40)

图 4 腺管间的肌上皮 S-100(+)(EnVision,×400)

图5 肌上皮SM-MHC胞浆(+)(EnVision,×400)
3 讨论
3.1 AME临床病理特点及诊断 AME通常发生于成年女性,好发年龄22~87岁,平均58岁。临床表现主要为乳腺外周或乳晕下可触及肿块。肿块直径0.5~5 cm,平均1.5 cm[2]。影像学没有特殊表现。男性病例已有报道[3-6]。
组织学上AME由增生的腺上皮和肌上皮组成,以肌上皮增生为主。肌上皮细胞多为梭形,有时可呈透明细胞样,少数可出现鳞化(见图1)。1991年Tavassoli[7]根据肿瘤结构及肌上皮形态的不同,将该肿瘤分为3种类型:①梭形细胞型:以肌上皮细胞增生为主,细胞梭形、短梭形呈巢状或束状分布,增生的梭形细胞可压迫管腔(见图6)。②管状型:由腺上皮和肌上皮细胞围绕未稍导管呈聚集性增生,似管状及腺管状腺瘤。部分增生的小管延伸进入周围正常乳腺组织中,可引起灶性区边缘不规则(见图7),以致于手术切除不干净,成为术后复发的原因。③小叶型:增生的肌上皮细胞呈实性、巢状排列,胞质透明或嗜酸并围绕受压的上皮细胞。大多数肿瘤周围有完整或不完整较厚的纤维包膜(见图8),部分纤维组织向瘤内生长,将肿瘤分隔呈小叶状。良性AME核分裂像通常≤2个/10 HPF[8]。

图6 梭形细胞型AME:腺管闭塞,大量肌上皮细胞增生 (HE,×40)

图7 管状型AME:瘤细胞呈蘑菇状突向包膜,形成不规则的边缘(HE,×40)

图8 小叶型AME:肿瘤大部分区呈管状,周围有纤维包膜(HE,×40)
此外还有一种以肌上皮增生为主的特殊腺肌上皮瘤,有完整的包膜,但不是真正的包膜,系纤维假包膜。切面灰白,质地较软或较韧,无出血、坏死、钙化等改变。镜下由成熟的脂肪及平滑肌组织混杂组成,其间夹杂数量不等、杂乱的乳腺导管、小叶成分,乳腺导管上皮可近似正常乳腺结构,或为萎缩的乳腺小叶,亦可轻度增生,扩张形成小囊,囊内为潴留性分泌物(见图2)。这种特殊的腺肌上皮瘤,又称为肌样错构瘤,多见于绝经前妇女[9],免疫组化染色显示错构瘤的上皮成分呈不同程度雌激素受体阳性。该组AME中有这样1例,患者于绝经前(43岁)发病,免疫组化ER灶区(+)。因瘤体外有完整包膜,临床上易误诊为纤维腺瘤。
大多数腺肌上皮瘤为良性,但手术后常易复发。复发后瘤细胞常出现异型,核分裂像增多,并呈浸润性生长,此时应考虑为恶性腺肌上皮瘤或腺肌上皮癌。男性病例中还没有恶变报道[10]。本组AME中有1例可见部分瘤细胞生长活跃,有轻度异型性,在主瘤边缘出现小瘤巢及条索,并有间质和包膜外侵袭性生长趋势,易认为恶性,但瘤细胞未浸润至周围脂肪组织,且术后4年随访未见复发及转移的依据,仍属良性范畴。此外应明确,即使复发,若无浸润,亦不能作为恶性[11]。
免疫组化检测对诊断AME很有帮助,AME腺上皮表达CK和EMA,肌上皮细胞有上皮和平滑肌的双相表达。有文献将CD10、P63、SMA和S-100作为肌上皮细胞的特异性标记,用以明确肿瘤细胞的肌上皮成分[12]。肌上皮中SMA、MSA的表达依赖于其分化程度,其免疫表达与此吻合。目前认为SM-MHC(平滑肌肌球蛋白重链)可代替α-actin、SMA、MSA抗体,作为识别乳腺肌上皮细胞的首选抗体。
3.2 鉴别诊断 AME应与以下病变相鉴别:①肌上皮癌:起源于肌上皮,具有肌上皮的免疫表型,没有腺上皮及腺管样分化[13],而AME有腺腔存在,上皮标记阳性。②腺肌上皮腺病:肌上皮的增生在乳腺的良性增生性疾病,如腺病中增生显著,形成镜下病变而不形成明显的肿块时,称为腺肌上皮腺病。而AME形成境界明显的肿块。③纤维腺瘤:易与肌样错构瘤混淆,纤维腺瘤在青年人多见,周围包绕的脂肪包膜透亮晕较清楚,间质没有明显的脂肪及平滑肌组织,是增生的腺体和纤维组织;而错构瘤可见正常的小叶结构,有数量不等的脂肪组织,无纤维腺瘤的间质成分,并且错构瘤的腺管不受压。④浸润性乳腺癌:AME增生的细胞为肌上皮,常类似于乳腺癌的生长方式,较难与乳腺癌鉴别,尤其在冰冻切片时由于细胞肿胀、切片质量等问题,可能被误诊为乳腺癌。乳腺癌的病史短,肿物生长快,质硬,常伴有淋巴结转移;AME增生腺管具有腺上皮和肌上皮双层结构,而浸润性乳腺癌的肌上皮细胞消失。
3.3 治疗及预后 大多数乳腺AME是良性的,预后通常较好。当原发肿瘤未完全切除时,可局部复发,单次或多次复发主要与肿瘤未完全切除以及病变是否具有卫星结节有关,因此建议局部扩大切除。如果组织学检查提示切除不充分,或周围导管见到增生病灶,则可考虑再次切除活检,并依据病理结果作进一步判断,如证实有恶变,则应进行乳房切除及腋窝淋巴结清扫。
致谢:感谢纽约州立大学医学院石溪分校胡幼军教授,温州医学院附属第二医院病理科张海燕主任医师,瑞安市人民医院及乐清市人民医院提供部分病例。
[1] Hamperl H.The myothelia(myoepithelial cells).Normal state;regressive changes;hyperplasia;tumors[J].Curr Top Pathol,1970,53:161-220.
[2] Yahara T,Yamaguchi R,Yokoyama G,etal.Adenomyoepithelioma of the breast diagnosed by a mammotome biopsy:report of a case[J]. Surg Today,2008,38(2):144-146.
[3] 廖秋林,赖日权,陈晓东,等.男性乳腺腺肌上皮瘤1例[J].临床与实验病理学杂志,2003,19(4):455.
[4] 肖宁新,黎德生.乳腺腺肌上皮瘤一例[J].中华病理学杂志,2000,29(1):78.
[5] 陈定宝,戴林,宋秋静,等.乳腺腺肌上皮瘤临床病理观察[J].诊断病理学杂志,2006,13(4):275-277.
[6] Salto-Tellez M,Putti TC,Lee CK,et a1.Adenomyoepithelioma of the breast:description of allelic imbalance and mierozatelite instability[J]. Histopathology,2005,46(2):230-231.[7] Tavassoli FA.Myoepithelial lesions of the breast.Myoepitheliosis,adenomyoepithelioma,and myoepithelial carcinoma[J].Am J Surg Pathol,1991,15(6):554-568.
[8] Tavassoli FA,Devilee P. World Health Organigation classification of tumours. Pathological and genetic of tumours of the breast and female genital organs[M].Lyon:IARC Press,2003:86-88.
[9] 何春年,宋利军,张印霞,等.乳腺错构瘤:附6例报告[J].中国肿瘤临床,1994,21(7):557-558.
[10]Howlett DC,Mason CH,Biswas S,et al.Adenomyoepithelioma of the breast:spectrum of disease with associated imaging and pathology[J].Am J Roentgenol,2003,180(3):799-803.[11]Rosen PP.Adenomyoepithelioma of the breast[J].Hum Pathol,l987,18(12):l232-1237.
[12]Leibl S,Gogg-Kammerer M,Sommersacher A,et a1.Metaplastic breast carcinomas:are they of myoepithelial differentiation?:immunohistochemical profile of the sarcomatoid subtype using novel myoepithelial markers[J].Am J Surg Pathol,2005,29(3):347-400.
[13] 丁华野,皋岚湘.特殊类型乳腺癌(三) [J].诊断病理学杂志,2001,8(2):65-70.

