纳米与微米CuO及Cu2+对土壤脲酶的生态毒性比较研究
金盛杨,王玉军,汪鹏,李连祯,周东美,*
1.中国科学院南京土壤研究所 土壤与农业可持续发展国家重点实验室,南京210008
2.中国科学院研究生院,北京100049
1 引言(Introduction)
随着纳米技术的迅猛发展,纳米金属材料遍及电子、生物医药、化妆品、化工催化和新材料开发等各个领域,成为应用最为广泛的工程材料之一(Griffitt et al.,2008;Nowack et al.,2007).纳米氧化铜(CuO NPs)作为其中最重要的一类纳米材料,既可替代贵金属充当氧化催化剂,又能作为机械的传热导体和润滑剂等,因此在工业上应用十分广泛.但是,CuO NPs在科学研究、生产、运输、使用及废物处理等过程中,将不可避免地通过各种途径间接或直接进入水体、土壤环境,从而产生安全性风险.研究结果表明,CuO NPs对水生生物如微藻(Pseudokirchneriella subcapitata)能够产生显著的毒性效应(Aruoja et al.,2010).Mortimer等(2008)发现CuO NPs还能抑制费希尔弧菌(Vibrio fischeri)的荧光度.目前,关于CuO NPs生态毒性效应的大部分研究集中于水体环境,而对土壤生态系统影响研究尚是空白.在土壤系统氮素循环过程中,土壤脲酶通过专性水解尿素等有机氮源而释放出铵,起调节土壤肥力的重要作用.因此有必要考察CuO NPs对土壤脲酶活性的影响以推进纳米金属材料对土壤质量的环境安全性研究.
纳米金属材料既有纳米材料量子尺寸效应等一般特征,又由金属元素组成.由于其表面高活性,因此易在环境中发生金属离子溶出.研究发现,CuO NPs在细胞培养介质和自然水体中均能释放出Cu2+(Midander et al.,2009;Blinova et al., 2010).当前急需回答的问题在于金属材料的生态毒性究竟是来自纳米颗粒还是其溶出离子,或者是两者共同作用(Lubick,2008).Karlsson等(2008)考察了20mg·L-1和40mg·L-1CuO NPs暴露对肺部上皮细胞DNA损伤情况,结果认为生理毒性主要是由纳米颗粒态导致的.而Blinova等(2010)研究浓度高于1000mg·L-1CuO NPs对不同自然水体中甲壳纲动物毒性效应时,发现主要是溶出Cu2+引起了纳米动物毒性.两者的研究结论差异在一定程度上说明,CuO NPs在不同浓度下可能存在不同的生物致毒机制.许多研究为了使纳米毒性效应更明显,常常采用高浓度纳米材料进行相关毒理试验(Chen et al.,2006;Lee et al.,2008),其研究结果自然很难扩展至低浓度下的纳米作用机理.另外,从微米到纳米尺寸的变化金属材料表面活性发生变化而影响其生物毒性.Meng等(2007)虽然比较了纳米与微米Cu对小鼠致死率的差异,但并未探讨两者致毒机理的差异.
决定纳米材料生态毒性的关键在于其在特定环境的物理化学行为(Scott-Fordsmand et al., 2008),因此本文通过研究纳米与微米CuO在不同环境中的离子溶出,考察其对土壤脲酶活性的生态毒性效应,并设置了跨三个数量级的浓度梯度和Cu2+组以阐明浓度和粒径对颗粒态CuO生态毒性机制的影响.研究结果将填补纳米金属材料对土壤生态系统影响数据的短缺,为将来制定完善的纳米材料环境暴露风险标准及安全管理提供毒理学依据.
2 材料与方法(Materials and methods)
2.1 实验材料
纳米材料:纳米氧化铜(CuO NPs)和微米氧化铜(CuO MPs)购自南京埃普瑞纳米材料有限公司,样品纯度均>99.8%.
供试土壤:红壤(Udic Ferrosols,0~20cm)采自江西鹰潭生态试验站,为荒地土壤.乌栅土(Anthrosol,0~20cm)采自常熟农业生态试验站试验田.所有样品经风干后磨碎,过20目筛,均匀混合后储藏备用.两种土壤的基本理化性质见表1,其测定参考文献方法(鲁如坤,1999).
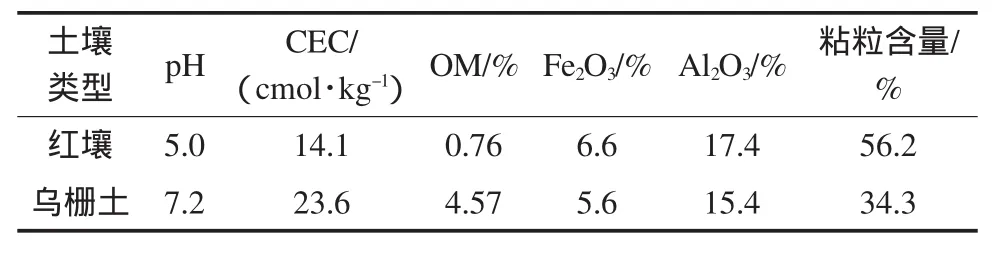
表1 供试土壤的基本理化性质Table 1 Some physico-chemical characteristics of the soils tested
试剂及仪器:CuCl2·2H2O、KCl、NaOH、NaClO、(NH4)2SO4、NaH2PO4、Na2HPO4和EDTA-Na2(乙二胺四乙酸二钠),苯酚钠、尿素、甲醇、甲苯、乙醇和丙酮等实验相关试剂均为分析纯及以上;用水为去离子水;H-7650型透射电子显微镜(TEM,日立公司,日本),JW-004型BET氮气吸附仪(北京精微高博公司),MLR-351H型人工恒温气候培养箱(三洋公司,日本),KQ-300VDE型超声波仪(昆山超声仪器有限公司),Allegra X-22R型高速离心机(贝克曼库尔特公司,美国),Z-2000型原子吸收光谱仪(日立公司,日本).
2.2 纳米与微米氧化铜形貌表征
称取一定量的CuO NPs和CuO MPs加入到乙醇中配制成200mg·L-1(本研究CuO NPs和CuO MPs浓度均以Cu计)的CuO有机悬液,经30min超声(45Hz,300W)处理后采用TEM观察颗粒形貌和测量粒径,采用氮吸附BET法测定颗粒的比表面积.
2.3 纳米与微米氧化铜悬液和Cu2+溶液制备
称取一定量的CuO NPs和CuO MPs加入到去离子水中配成颗粒悬液的母液,经 60min超声(45Hz,300W)分散处理后在玻璃棒不断搅拌下稀释获得1~1000mg·L-1颗粒悬液待用.Cu2+组的设置主要目的是考察CuO NPs和CuO MPs在土壤中的离子溶出带来的生态毒性效应,从而区分开颗粒态致毒和离子态致毒机理.参照文献报道(Blinova et al.,2010)CuO NPs和 CuO MPs在自然环境中的溶出比率,用CuCl2·2H2O配制0.1~ 10mg·L-1Cu2+溶液待用.
2.4 土壤脲酶活性测定和铜离子溶出
土壤脲酶活性测定参考Sannino(2001)的方法.称取1g土壤于5组50mL离心管中,向其中2组加入1mL 1~1000mg·L-1CuO NPs,另2组加入1mL 1~1000mg·L-1CuO MPs悬液,向最后一组加入1mL 0.1~10mg·L-1Cu2+溶液,然后在(37±1)℃下黑暗培养24h,所有处理均为三重复.培养后向每支离心管加入4mL 0.25M尿素溶液(含100mM磷酸缓冲液和1mM EDTA-2Na,pH调至7.0),并加甲苯3滴,于(37±1)℃下继续黑暗培养4h.取出分别加了CuO NPs、CuO MPs和Cu2+的3组后立即放入冰箱冷冻10min使酶失活,加入10mL的2M KCl溶液,振荡10min后过滤,用靛酚蓝法测定溶液中NH4+浓度,以溶液中NH4+浓度计算土壤脲酶活性.各处理对土壤脲酶活性影响用抑制率表示:

为考察CuO NPs和CuO MPs在土壤培养过程中的离子溶出,28h培养后取出剩余2组并振荡5min,20000×g高速离心 10min后取上清液过0.22μm滤膜用原子吸收光谱法测量溶出Cu含量.在本次土培实验开始前后分别测定了各个处理的体系pH,数值在6.9~7.3之间,因此不同材料处理带来的pH变化不会影响土壤脲酶活性(Frankenberger and Johanson,1982).
2.5 数据处理和统计
数据结果采用统计软件SPSS 11.5 for Windows进行分析,用LSD(最小显著差法)分析检验处理组与对照组之间的差异显著性,设定差异显著水平为p≤0.05,差异极显著水平为p≤0.01.
3 结果与分析(Results and analysis)
3.1 CuO NPs与CuO MPs形貌表征
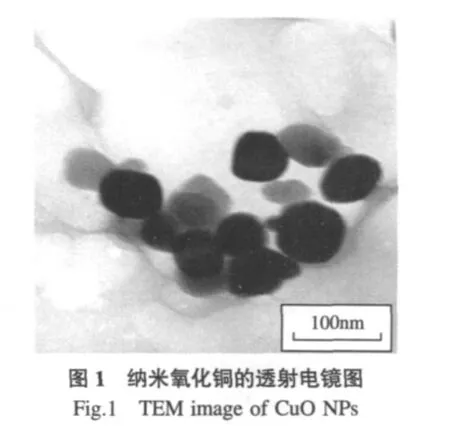

如图1所示,CuO NPs为近圆球形粒子,其粒径范围为25~80nm,平均粒径为55nm,比表面积为23.9m2·g-1.CuO MPs在形貌上与CuO NPs有较大差异(图2),CuO MPs为不规则颗粒状,其粒径范围在500nm~15μm之间,平均粒径为7μm,比表面积为1.5m2·g-1.CuO颗粒从微米到纳米的尺寸变化不仅改变了其粒径和比表面积,而且对其外形特征也产生了重大影响,纳米颗粒态形貌更为均一和规则,而微米颗粒大部分为无规则形态.
3.2 CuO NPs与CuO MPs在土壤中的Cu2+溶出
CuO NPs与CuO MPs的差异不仅表现在形貌等物理特征上,两者在土壤介质中的环境化学行为也不尽相同.如表2所示,红壤中CuO NPs的Cu2+溶出量随其浓度增加而增加,但溶出比例随浓度增加而减少.1mg·kg-1CuO NPs溶出 0.4mg· kg-1Cu2+,溶出比率高达40%,1000mg·kg-1CuO NPs溶出57.1mg·kg-1Cu2+,溶出比率仅为5.7%.红壤中相同浓度CuO MPs无论是溶出浓度还是溶出比率都小于CuO NPs,但溶出规律与CuO NPs相同,即Cu2+溶出量随其浓度升高而升高,溶出比例随其浓度升高而降低.1mg·kg-1CuO MPs溶出0.2mg·kg-1Cu2+,只有 CuO NPs的1/5,1000mg· kg-1CuO MPs溶出22.5mg·kg-1Cu2+,约为CuO NPs的40%.以上结果说明CuO颗粒的离子溶出具有明显的浓度效应,纳米态离子溶出高于微米态表明纳米粒子高表面反应活性有助于释放出金属离子.
在乌栅土中,CuO NPs与CuO MPs随投放浓度变化的离子溶出规律与其在红壤中具有一致性(表 2),但相同浓度下 Cu2+溶出量显著减少. 1000mg·kg-1的 CuO NPs与 CuO MPs分别溶出32.6mg·kg-1和8.8mg·kg-1,仅为其在红壤中溶出量的57%和39%,这表明CuO颗粒释放Cu2+受到土壤性质的显著影响.

表2 纳米与微米氧化铜在土壤中的离子溶出Table 2 Cupric ion release from nanometer-and micrometer-sized CuO in soils
3.3 CuO NPs与CuO MPs及Cu2+对红壤脲酶活性的影响
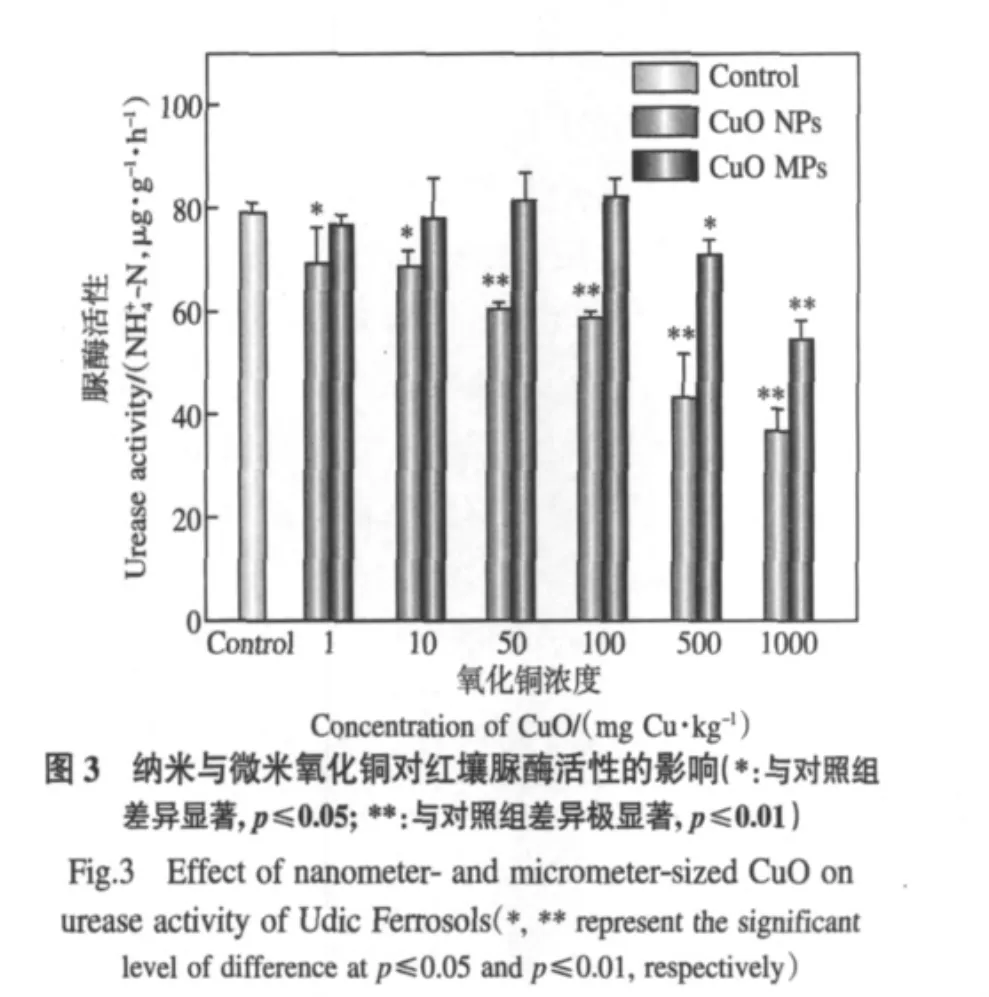
如图3所示,1~1000mg·kg-1CuO NPs均对红壤脲酶活性产生了显著或极显著的抑制效应,且随着CuO NPs浓度增加,抑制效应增强.1mg·kg-1CuO NPs对脲酶活性的抑制率为13.0%,而当浓度达到1000mg·kg-1时其对脲酶活性的抑制率高达53.1%.在相同浓度下,CuO MPs对红壤脲酶的抑制率均显著低于CuO NPs(图3).1~100mg·kg-1范围内,CuO MPs对脲酶活性影响与对照组相比无显著差异,当浓度继续增大到500mg·kg-1及以上时,CuO MPs开始显著抑制脲酶活性.500mg· kg-1CuO MPs抑制率为10.4%,1000mg·kg-1时抑制率为31.4%,明显低于同浓度下CuO NPs对脲酶的抑制率,结果均说明纳米态CuO的生态毒性高于微米态.
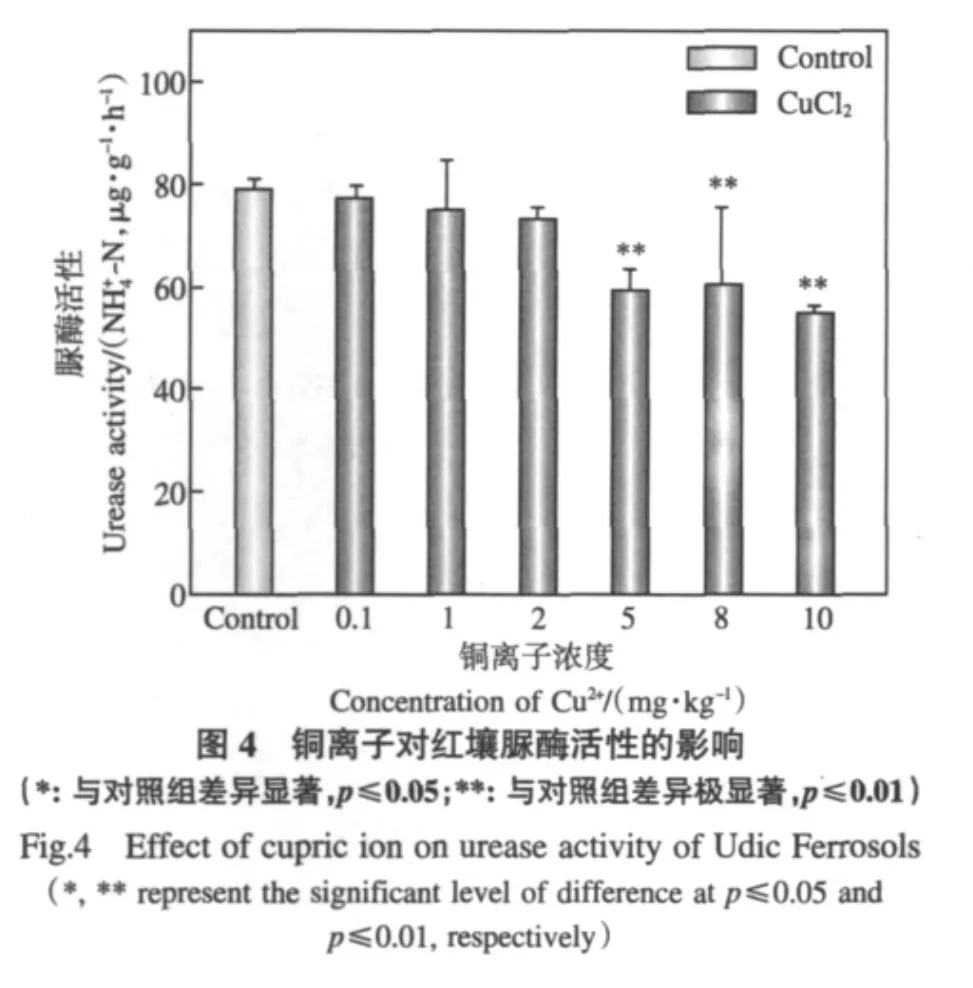
图4表明,只有当红壤中Cu2+浓度达到5mg· kg-1及以上时才会对脲酶活性产生显著的抑制效应.在红壤中,CuO NPs在1~10mg·kg-1时Cu2+溶出小于 5mg·kg-1,在浓度为 50~1000mg·kg-1时Cu2+溶出大于5mg·kg-1(表2),且图3表明CuO NPs在1~1000mg·kg-1范围内均对脲酶活性产生了显著或极显著抑制效应.这说明在相对低浓度(1~10mg·kg-1)时,纳米颗粒态导致了CuO NPs对脲酶的生态毒性,而在相对高浓度(50~1000mg· kg-1)时则应该是纳米颗粒态和溶出Cu2+共同作用的结果.由表2和图3还可知,CuO MPs只有在Cu2+溶出大于5mg·kg-1的浓度范围(≥500mg·kg-1)才能对脲酶产生活性抑制作用,说明其致毒原因主要是溶出的Cu2+,与其微米颗粒态关系不大.
经图3和图4比较,浓度同为1mg·kg-1时各处理对红壤脲酶活性抑制作用大小可排序为:CuO NPs>CuO MPs≈Cu2+,10mg·kg-1时的排序为:Cu2+>CuO NPs>CuO MPs.值得注意的是,1mg·kg-1时CuO NPs对脲酶活性具有显著的抑制效应,而CuO MPs和Cu2+影响很小.以上说明纳米粒子对土壤酶的作用可能具有与传统离子态不同的独特机理,并且在低浓度下具有相对较强的生态毒性.
3.4 CuO NPs与CuO MPs及Cu2+对乌栅土脲酶活性影响
与在红壤中相同,CuO NPs在1~1000mg·kg-1范围内显著或极显著地抑制了乌栅土脲酶活性,且随着CuO NPs浓度升高,抑制效应增强,相同浓度下CuO NPs对脲酶活性的抑制作用大于CuO MPs(图5).1mg·kg-1CuO NPs对乌栅土脲酶活性的抑制率即可达15.6%,1000mg·kg-1CuO NPs暴露浓度时对脲酶活性的抑制率为68.8%.显然,CuO NPs在乌栅土中对酶的生态毒性大于其在红壤中的毒性.与CuO NPs不同,CuO MPs仅在1000mg·kg-1下对脲酶产生活性抑制效应(图5),抑制率为18.3%,比其在红壤中降低了13.1%,这说明乌栅土能缓解CuO MPs带来的生态毒性效应.
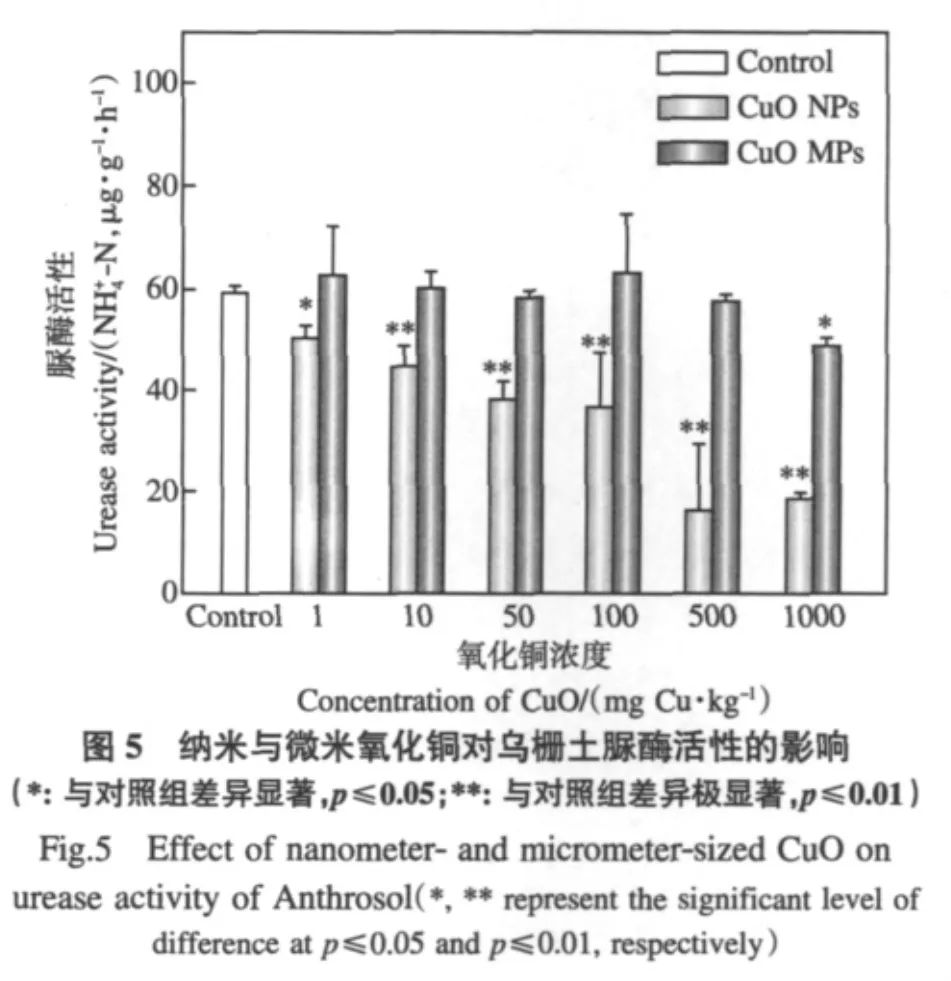
与CuO MPs结果相似,Cu2+在乌栅土中对脲酶活性的影响也小于其在红壤中,只有当Cu2+浓度达到8mg·kg-1及以上时才会对脲酶活性产生显著的抑制效应,抑制率为16.8%(图6).由表2可知,乌栅土中CuO NPs在1~100mg·kg-1时Cu2+溶出小于8mg·kg-1,在500~1000mg·kg-1时Cu2+溶出大于8mg·kg-1,但是其在1~1000mg·kg-1范围内均引起了脲酶活性显著抑制效应.这表明在1~100mg·kg-1时,纳米颗粒态导致了CuO NPs对脲酶的生态毒性,而在500~1000mg·kg-1时则应该是纳米颗粒态和溶出Cu2+共同作用的结果.与3.3中结果相比较后可知,虽然乌栅土减少了CuO NPs的离子溶出,但通过增大纳米颗粒态致毒作用而导致总体上增强了CuO NPs对脲酶活性的抑制.在红壤中一样,只有在Cu2+溶出大于8mg·kg-1的CuO MPs浓度(1000mg·kg-1)下才能对脲酶产生活性抑制作用(表2,图5).结合3.3中CuO MPs对红壤脲酶抑制效应结果,可以证实其毒性根源主要是溶出的Cu2+.
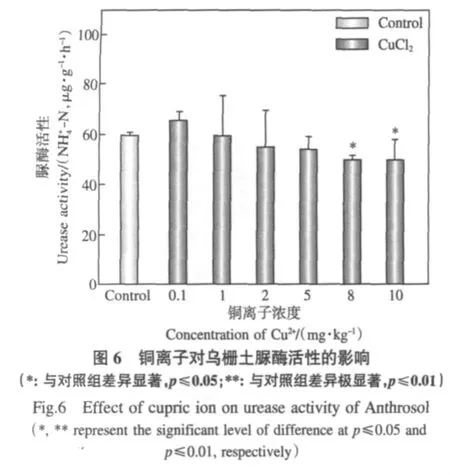
经图5和图6比较,浓度为 1mg·kg-1和10mg·kg-1时,各处理对红壤脲酶活性抑制作用大小排序都为:CuO NPs>Cu2+>CuO MPs.结果也同样证明低浓度(1mg·kg-1)纳米态Cu对脲酶活性具有微米态和离子态Cu所没有的独特抑制效应.
4 讨论(Discussion)
实验表明,CuO NPs和CuO MPs在土壤中的Cu2+溶出规律具有一致性(表2),即溶出量随着浓度增加而增加,而溶出比率刚好相反,随着浓度的增加而减少.将CuO NPs投放至溶液和琼脂中,也同样观察到了这一离子溶出规律.由于固体金属材料的离子溶出是一个表面化学过程(Shabalovskaya et al.,2009),随着CuO浓度的增加,其所含颗粒之间的吸附或团聚效应就越严重,从而导致颗粒表面活性位点被互相遮蔽而阻止Cu2+溶出.在高浓度下CuO单个颗粒的Cu2+溶出效率低于其在低浓度下的值,因此其溶出比率相对较低.由于CuO浓度升高所获得更多的活性位点超过了由于颗粒间互相遮蔽所致的活性位点损失,所以Cu2+溶出绝对量仍高于低浓度下的值.表2数据表明CuO NPs和CuO MPs在红壤和乌栅土中的Cu2+溶出量相差很大,说明环境介质对纳米金属的离子溶出也具有重要影响.红壤和乌栅土最大的差异体现在pH和有机质含量上,由于实验体系是一个pH均一化的缓冲体系(7.0左右),因此本文利用这两种土壤主要研究了有机质变化对CuO NPs和CuO MPs离子溶出及其生态毒性的影响.表1表明乌栅土有机质含量约为红壤的6倍,表2则说明乌栅土相对红壤减少了两种CuO颗粒材料的离子溶出,因此可推断土壤有机质具有CuO颗粒表面结合并减少其离子溶出的作用.Liu等(2010)研究环境因素对纳米银离子溶出影响时发现,有机质的确可以减少纳米金属离子溶出,从而肯定了本文的推断.
CuO NPs和CuO MPs不仅存在着形貌和离子溶出方面的差异,而且其对土壤酶活性的作用机理也不一致.在相对低浓度下,纳米颗粒态导致了CuO NPs对土壤脲酶活性的抑制毒性,在相对高浓度下,纳米颗粒态和溶出Cu2+共同作用引起了脲酶活性抑制.与CuO NPs不同,CuO MPs只通过溶出Cu2+抑制土壤脲酶活性,其颗粒态对脲酶活性无显著影响.有机质可以通过与Cu2+络合降低其生物毒性(Blinova et al.,2010),但同时增强了纳米颗粒的分散性和稳定性(Li et al.,2007),因此有机质的作用解释了含高有机质的乌栅土相对低有机质的红壤降低了CuO MPs和Cu2+对脲酶活性的抑制,却增强了CuO NPs对脲酶的生态毒性现象.
另外,在1~1000mg·kg-1范围内CuO NPs的纳米颗粒态均参与了其脲酶活性抑制效应,以往高浓度纳米暴露毒理研究将其生物毒性直接归结为溶出离子作用(Chen et al.,2006),这可能会掩盖纳米颗粒态的重要贡献.本研究结果还表明,1mg· kg-1CuO NPs对土壤脲酶活性具有微米态和离子态所没有的抑制毒性.以上充分说明传统的Cu与土壤酶活性中心作用理论(王娟等,2007;Chaperon et al.,2007)已难以解释低浓度CuO NPs对脲酶的抑制效应.低浓度下,由于纳米颗粒间碰撞、吸附和团聚机率相对较低,往往以单个小颗粒存在,因此其表面化学活性大大强于高浓度下纳米团聚单体.Lynch等(2008)报道了某些纳米材料(氧化铈、碳纳米管、聚乙烯包被的量子点)能增强淀粉样蛋白(amyloidogenic protein)的表面纤维化,并促使其变性.脲酶本身也是一类蛋白,因此推测低浓度下具有高活性表面的CuO NPs与脲酶之间可能存在着类似的机理,但此推测需要进一步的研究进行确认.
由于CuO NPs对土壤酶的高毒性效应,因此必须在其生产、运输、消费和处置过程中进行严格管理,防止其进入环境从而破坏土壤质量.另外,有必要加强从蛋白金属组学角度解答纳米金属颗粒态对土壤酶的毒性效应机理及其影响因素,进一步推动纳米生物安全性研究进展.
Aruoja V,Dubourguier H C,Kasemets K J,Kahru A.2009. Toxicity of nanoparticles of CuO,ZnO and TiO2to microalgae Pseudokirchneriella subcapitata [J]. Science of the Total Environment,407(4):1461-1468
Blinova I,Ivask A,Heinlaan M,Mortimer M,Kahru A.2010. Ecotoxicity of nanoparticles of CuO and ZnO in natural water[J].Environmental Pollution,158(1):41-47
Chaperon S,Sauvé S.2007.Toxicity interaction of metals(Ag, Cu,Hg,Zn)to urease and dehydrogenase activities in soils[J]. Soil Biology&Biochemistry,39(9):2329-2338
Chen Z,Meng H,Xing G M,Chen C Y,Zhao Y L,Jia G, Wang T C,Yuan H,Ye C,Zhao F,Chai Z F,Zhu C F,Fang X H,Ma B C,Wan L J.2006.Acute toxicological effects of copper nanoparticles in vivo[J].Toxicology Letters,163(2): 109-120
FrankenbergerW T Jr,Johanson J B.1982.Effect of pH on enzyme stability in soils[J].Soil Biology&biochemistry,14(5):433-437
Griffitt R J,Luo J,Gao J,Bonzongo J C,Barber D S.2008. Effects of particle composition and species on toxicity of metallic nanomaterials in aquatic organisms[J].Environmental Toxicology and Chemistry,27(9):1972-1978
Karlsson H L,Cronholm P,Gustafsson J,MöllerL.2008. Copper oxide nanoparticles are highly toxic: A comparison between metaloxide nanoparticles and carbon nanotubes[J]. Chemical Research in Toxicology,21(9):1726-1732
Lee W M,An Y J,Yoon H,Kweon H S.2008.Toxicity and bioavability of copper nanoparticles to the terrestrial plants mung bean(Phaseolus radiatus)and wheat(Triticum aestivum):Plant agar test for water-insoluble nanoparticles[J].Environmental Toxicology and Chemistry,27(9):1915-1921
Li X F,Zhu D S,Wang X J.2007.Evaluation on dispersion behavior of the arueous copper nano-suspensions[J].Journal of Colloid and Interface Science,310(2):456-463
Liu J Y,Hurt R H.2010.Ion release kinetics and particle persistence in aqueous nano-silver colloids[J].Environmental Science&Technology,44(6):2169-2175
Lu R K.1999.Analysis method of the soil agriculture chemistry[M].Beijing:Chinese Agriculture Science Press(in Chinese)
Lubick N.2008.Nanosilver toxicity:ions,nanoparticles-or both?[J].Environmental Science&Technology,42(23):8617
Lynch I,Dawson K A.2008.Protein-nanoparticle interactions[J].Nanotoday,3(1-2):40-47
Meng H,Chen Z,Xing G M,Yuan H,Chen C Y,Zhao F, Zhang C C,Zhao Y L.2007.Ultrahigh reactivity provokes nantoxicity:Explanation of oral toxicity of nano-copper particles[J].Toxicology Letters,175(1-3):102-110
Midander K,Cronholm P,Karlsson H L,Elihn K,Möller L, Leygraf C,Wallinder I O.2009.Surface characteristics,copper release,and toxicity of nano-and micrometer-sized copper and copper(Ⅱ)oxide particles:A cross-disciplinary study[J].Small, 5(3):389-399
Mortimer M,Kasemets K,HeinlaanM,KurvetI,KahruA. 2008.High throughoutkinetic Vibrio fischeribioluminescence inhibition assay for study of toxic effects of nanoparticles[J]. Toxicology in Vitro,22(5):1412-1417
Nowack B,Bucheli T D.2007.Occurrence,behavior and effects of nanoparticles in the environment[J].Environmental Pollution, 150(1):5-22
Sannino F,Gianfreda L.2001.Pesticide influence on soil enzymatic activities[J].Chemosphere,45(4-5):417-425
Scott-Fordsmand J J,Krogh P H,Lead J R.2008.Nanomaterials in ecotoxicology[J].Integrated Environmental Assessment and Management,4(1):126-128
Shabalovskaya S A,Tian H,Anderegg J W,Schryvers D U, Carroll W U,Hunbeeck J V.2009.The influence of surface oxides on thedistribution and releaseofnickelfrom Nitinol wires[J].Biomaterials,30(4):468-477
Wang J,He W X,Sun T H.2007.Soil urease activity affected by copper[J].Journal of Northwest A&F University(Natural Science edition),35(11):135-140(in Chinese)
中文参考文献
鲁如坤.1999.土壤农业化学分析方法[M].北京:中国农业科技出版社
王娟,和文祥,孙铁珩.2007.铜对土壤脲酶活性特征的影响[J].西北农林科技大学学报(自然科学版),35(11):135-140
