微波结合紫外诱变选育辅酶Q10高产菌株
朱俊丰,郑方亮,艾海新,朱春玉,季士坤,丁国伟,白婷婷,王加友,李雪娇,朱光宇,刘宏生,*
(1.辽宁大学生命科学院,辽宁沈阳 110036;2.辽宁省生物大分子计算模拟与信息处理工程技术研究中心,辽宁沈阳 110036;3.辽宁省高校动物资源与疫病防治重点实验室,辽宁沈阳 110036)
辅酶Q10(CoenzymeQ10,CoQ10),又称泛醌,是细胞呼吸链上的一种递氢体。研究表明,CoQ10有良好的心脏保护作用,且无任何毒副作用,可用于心肌保护。近来研究发现,CoQ10对帕金森症、癌症、心脑血管等疾病的治疗也有很好的作用[1-5]。维生素K3是CoQ10的结构类似物,筛选出的突变株对维生素K3的耐受浓度提高,可能部分解除了终产物对参与CoQ10生物合成的有关酶进行的反馈抑制,提高了CoQ10合成量[6]。叠氮钠(sodium azide,NaN3)作为线粒体有氧呼吸链细胞色素c氧化酶(cyto2chrome c oxidase,COX,即呼吸链复合体 IV)的特异性抑制剂,能阻断呼吸链电子传递,从而抑制呼吸导致细胞凋亡,由于CoQ10是呼吸链中的重要递氢体,因此若诱变菌株能在含有一定浓度的NaN3的培养基上生长,则表明该突变株体内CoQ10积累量有可能提高[7]。微波作为一种高频电磁波,能刺激水、蛋白质、核苷酸等极性分子快速震动。在2 450 MHz频率作用下,水分子能在1 s内180°来回震动2.45×109次。强烈的震动摩擦使胞内DNA分子氢键和碱基堆积力受损,使DNA结构发生变化,从而导致遗传变异[8]。本研究旨在通过微波与紫外线联合诱变对LNUB335菌株进行遗传改良,以期进一步提高其CoQ10产量。
1 材料与方法
1.1 材料
1.1.1 菌种 根瘤农杆菌(Agrobacterium tum efaciens)LNUB335本实验室保藏。
1.1.2 培养基 ①斜面培养基:牛肉膏蛋白胨培养基;②种子培养基(g/L):葡萄糖20,蛋白胨10,酵母膏10,NaCl 5,pH 7.0;③发酵培养基(g/L):蔗糖40,玉米浆20,(NH4)2SO410,KH2PO40.5,K2HPO40.5,MgSO4·7H2O 0.25,pH 7.0;④完全培养基(g/L):葡萄糖5,牛肉膏3,酵母膏3,蛋白胨10,MgSO4·7H2O 0.2;⑤初筛培养基:在完全培养基中分别加入一定量的维生素K3和NaN3。
1.2 方法
1.2.1 维生素K3和NaN3对菌株的最小抑制浓度的确定 取0.1 mL菌液涂布于分别含有维生素K3(药物浓度25、50、75、100、125 mg/L)和NaN3(药物浓度5、10、15、20、25 mg/L)的平板上,以未加药物的平板为对照,培养48 h后观察菌落生长情况。
1.2.2 菌悬液的制备 取对数生长期的菌体,将菌洗下,移入装有20 mL无菌生理盐水的三角瓶(内含无菌玻璃珠)中,摇床振荡30 min,再用生理盐水离心洗3次,最后稀释制成约108cfu/mL菌悬液。
1.2.3 紫外诱变 开启紫外线灯(20W)预热10 min,取5 mL制备好的菌悬液置一直径为6 cm的培养皿中,将其放置在离紫外灯30 cm(垂直距离)处的磁力搅拌器上,分别振荡照射0、30、60、90、120、150、180 s后,在红灯下将处理菌液稀释,平板涂布,用遮光布包好,30℃倒置培养48 h,计菌落数,绘制致死率曲线。对照组为原菌悬液,不进行紫外照射,其他操作相同。正式试验时,将适当浓度的菌悬液在搅拌条件下照射适当时间,取1 mL作适当稀释后吸0.1 mL涂布于含有适当浓度抗性物质的平板上,用黑布包好,置恒温培养箱30℃培养48 h。进行菌落计数,计算致死率。致死率[9](%)=[(对照菌落数-处理菌落数)/对照菌落数]×100%。
1.2.4 微波诱变 将装有5 mL菌悬液的试管置于含有冰块的烧杯中[8],采用频率为2 450 MHz,输出功率为900 W,照射10、20、30、40、50、60、70 s。照射后将处理菌液稀释,平板涂布,放入培养箱,30℃培养48 h,计菌落数,绘制致死率曲线。正式试验时,将适当浓度的菌悬液在搅拌条件下照射适当时间,取1 mL作适当稀释后吸0.1 mL涂布于含有适当浓度抗性物质的平板上,置恒温培养箱30℃培养48 h。进行菌落计数,计算致死率。致死率[9](%)=[(对照菌落数-处理菌落数)/对照菌落数]×100%。
1.2.5 初筛 将诱变后的菌液稀释涂布于筛选平板培养基上,30℃培养48 h,挑取生长快、菌落大的单菌落,接入斜面,30℃培养48 h后,4℃保藏,以备复筛。
1.2.6 复筛 将初筛得到的菌株逐个接入种子培养基中,30℃,200 r/min培养24 h,然后按5%接种量转接到发酵培养基中,32℃,220 r/min培养96 h,离心收集菌体,提取CoQ10,测定菌体生物量及CoQ10含量。
1.2.7 薄层层析法鉴定CoQ10[10]称取硅胶G 4.5 g,加0.2%的羧甲基纤维素钠溶液10 mL,置研钵中充分研成均匀稀糊状,取1块洁净干燥的玻板,将硅胶均匀摊开轻震玻板,使其均匀分布,自然风干。110℃活化1 h,备用。用微量注射器将样品溶液点样于活化好的硅胶板上,点样量为50μL,点样线距底边2.0 cm(标准品点状点样,点样量为50μl)。将薄板置于层析缸内,装入20 mL展层剂,室温下展层,溶剂上行移动15 cm,挥发干展层剂,碘蒸汽显色。
1.2.8 高效液相色谱法鉴定CoQ10[10]色谱条件:色谱柱:Spherisorb C18,(10μm,25 cm×416 mm ID);流动相:无水乙醇:甲醇=1:1(体积比);流速:1 mL/min;检测波长:275 nm;温度:30℃;进样量:20μL。
1.2.9 突变株的传代稳定性实验 在牛肉膏蛋白胨培养基上连续传代5次,进行发酵培养,对菌体的遗传标记进行鉴定,测定菌体生物量及菌体内CoQ10变化情况。
1.2.10 突变株菌体生物量测定 取5 mL发酵液,6 000 r/min离心15 min,去上清液,所得湿菌体经去离子水洗2次后,烘干至恒重,称量[11]。
1.2.11 CoQ10的提取 细胞培养结束后,10 000 r/min,20 min离心收集菌体,用蒸馏水洗涤2~3次后,45℃烘干。称取一定量的干菌体,按10 mL/g(干菌体)的量添加3 mol/L盐酸,90℃破壁25 min,迅速冷却。将获得的细胞碎片移入圆底烧瓶中,加入2.5倍(体积比)量的10%的氢氧化钾-甲醇溶液,60℃回流30 min,迅速冷却,按40 mL/g的料液比添加石油醚,萃取2次,静置分层,合并上清液用去离子水洗至中性,以无水硫酸钠脱水至澄清,用真空旋转蒸发仪(50℃)浓缩至干,然后加入无水乙醇10 mL,放入冰箱冷冻,过滤,无水乙醇定容至50 mL,待测。
1.2.12 CoQ10含量的测定 紫外分光光度法,在波长为190~350 nm之间进行紫外全波长扫描,275 nm下的峰值即为CoQ10的吸收峰。紫外分光光度法的标准曲线:y=0.011 6x+0.161。
2 结果与分析
2.1 维生素K3对出发菌株最小抑制浓度的确定
由图1可知,维生素K3对根瘤农杆菌LNUB335的抑制临界浓度为75 mg/L,因此选择100 mg/L为抗性平板维生素K3的起始浓度。
2.2 NaN3对菌株ARK004最小抑制浓度的确定
由图2可知,NaN3对ARK004菌的抑制临界浓度为15 mg/L,因此选择20 mg/L为抗性平板维生素K3的起始浓度。
2.3 紫外线诱变剂量的确定
任何诱变剂都同时具有致死和诱变的双重效应,因此需要测定出发菌株LNUB335经紫外线照射后的存活曲线,确定最佳诱变时间。按照1.2.3所述方法测得LNUB335紫外线照射的致死曲线见图3。

图1 维生素K3添加对LNUB335的致死率Fig.1 Fatality Rate ofLNUB335 by adding vitamin K3

图2 NaN3对LNUB335的致死率Fig.2 Fatality Rate ofLNUB335 by addingNaN3

图3 紫外线照射对LNUB335的致死率Fig.3 Fatality Rate ofLNUB335 byUV irradiation
近年来,通过对紫外线、X射线和乙烯亚胺等多种诱变剂诱变效应的研究发现,正向突变(提高产量)较多地出现在偏低剂量中。因此,选择紫外线照射时间为60~90 s作为筛选抗性突变株的诱变剂量。
2.4 紫外诱变的筛选结果
将经过紫外诱变处理后的菌悬液直接涂布于含100 mg/L维生素K3药物平板上,30℃培养48 h,从平板上挑取生长良好的单菌落共18株,编号ARK001~ARK018。对18株菌进行摇瓶复筛,发现有7株菌产CoQ10水平有所提高。结果见表1。菌株ARK004的CoQ10产量最高,每克干菌体的CoQ10含量达1.95 mg,较出发菌株提高30.87%,CoQ10产量为9.8 mg/L,较出发菌株提高37.64%,诱变结果较好。选择ARK004作为后续试验的出发菌株。

表1 紫外诱变的筛选结果Table 1 Screening results ofLNUB 335 byUV
2.5 微波诱变的剂量确定
测定出发菌株ARK004经微波照射后的存活曲线,确定最佳诱变时间。按照1.2.4所述方法测得ARK004微波照射的致死曲线,见图4。选择微波线照射时间为30 s作为筛选抗性突变株的诱变剂量。
2.6 微波诱变的结果
将经过微波诱变处理后的菌悬液直接涂布于含20 mg/L NaN3药物平板上,30℃培养48 h,从平板上挑取生长良好的菌落共25株,编号ARN001~ARN025。对25株菌进行摇瓶复筛,发现有6株菌产CoQ10水平大幅度提高。结果见表2。菌株ARN007的CoQ10产量最高,每克干菌体的CoQ10含量达2.46 mg,较出发菌株提高65.1%,CoQ10产量为12.01 mg/L,较出发菌株提高68.67%,诱变结果较好。选择ARN007作为培养基优化的出发菌株。试验中发现根瘤土壤杆菌生物量与CoQ10合成不呈现正相关,有些诱变株摇瓶发酵时生物量较高,但菌体合成CoQ10的能力不一定强。因此,筛选菌种时应以CoQ10产量作为考察的主要指标。
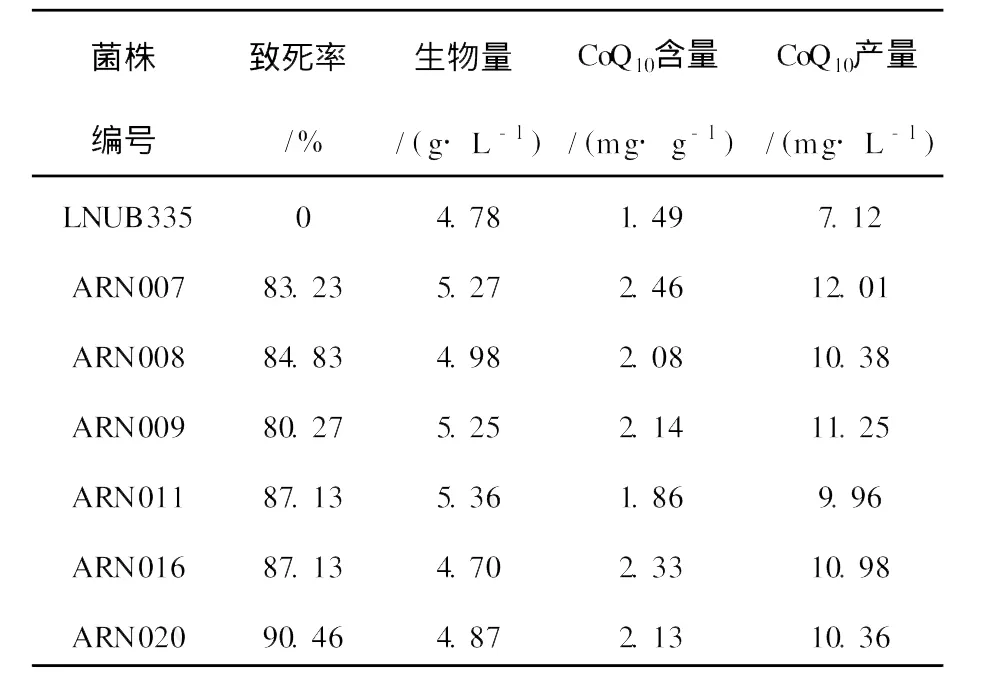
表2 NaN3抗性突变株发酵结果Table 2 Fermentation results ofmutantwith resistance ofNaN3
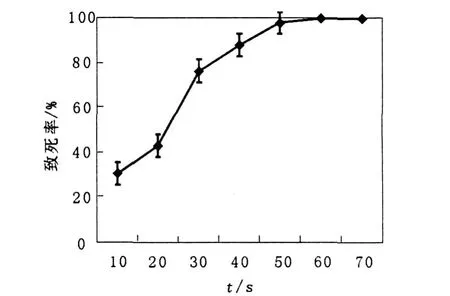
图4 微波辐射对LNU335的致死率Fig.4 Fatality Rate ofLNUB335 bymicrowave irradiation
2.7 CoQ10的鉴定
2.7.1 薄层层析法鉴定CoQ10由图5所示,突变株ARN007的粗提品中有与CoQ10标准品在同一位置的点,初步可以判定突变株ARN007的粗体品含有CoQ10。
2.7.2 高效液相色谱法鉴定CoQ10由图6和图7看出,CoQ10标准样品和突变株ARN007提取样品色谱峰保留时间均为17.4 min,证明为同一种物质,说明突变株菌体的粗提品中的确存在CoQ10。

图5 突变株ARN007提取样品与CoQ10标准样品的薄层层析图Fig.5 Thin-layer chromatography result ofmutantARN007
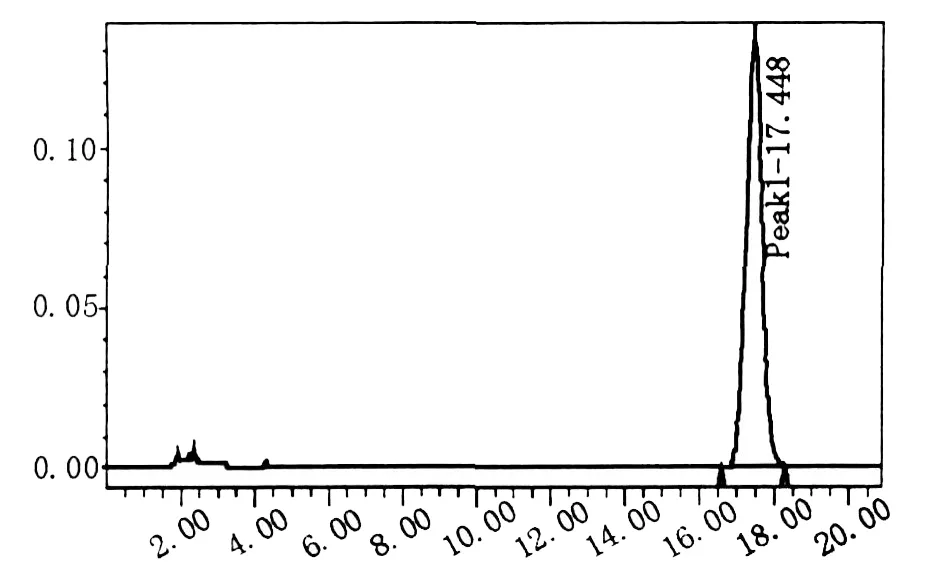
图6 CoQ10标准样品的HPLC图谱Fig.6 HPLC results ofmaster sample of CoQ10

图7 ARN007提取液的HPLC图谱Fig.7 HPLC results of CoQ10extracted from ARN007
2.8 突变株遗传稳定性的研究

表3 突变株经传代后的遗传标记结果Table 3 Inherited stability of yeast strains

图8 ARN007遗传稳定性结果Fig.8 Inherited stability ofARN0078
由表3和图8可知,随着传代次数的增加,突变株ARN007的遗传标记始终存在,CoQ10含量无明显变化,始终维持在12 mg/L左右,突变株ARN007的菌体质量无明显变化,始终维持在5 g/L左右,说明突变株ARN007的遗传性是稳定的。
3 讨 论
目前,国内外研究主要通过发酵条件优化、构建基因工程菌等方法来提高CoQ10的产量,产量大多集中在20 mg/L左右,个别高达120 mg/L,由于CoQ10合成途径复杂,受多基因调控,故CoQ10高产菌株至今未有突破性报道[12]。本研究首次利用微波与紫外联合诱变的方法进行CoQ10高产菌株的筛选,该方法筛选到的菌株CoQ10产量和菌体生物量较出发菌株相比有了一定的提高,且遗传性状稳定,为后续试验打下基础。
本实验的筛选模型只挑选了2个筛选因素,并未对营养缺陷型等其他有利于CoQ10在微生物体内积累的因素进行筛选,造成CoQ10产量较低,提高幅度不大。因此在下一步试验中应进一步完善筛选模型,提高筛选效率,以期获得更高产量的CoQ10生产菌株。
[1] Petra Niklowitz,ThomasMenke,Werner Andler,et al.Simultanceous analysis of coenzyme Q10in plasma,crythrocyres and latekets:comparison of the antioxidant level in blood cells and their environment in healthy children and after oral supplementation in adults[J].Clinica chimica Acta,2004,342:219-226.
[2] Kenneth A Conklin.Coenzyme Q10for prevention of anthracycline-induced cardioxicity[J].Integr Cancer Ther,2005,4:110-130.
[3] Soongs wang J,Sangtawesin C,Durongpisitkul K,et al.The effect of coenzyme Q10on idiopathic chronic dilated cardiomyopathy in children[J].Pediatr Cardiol,2005,26(4):361-366.
[4] Weber CA,ErnstME.Antioxidants,supplements,and Parkinson’s disease[J].Ann Pharmacother,2006,40(5):935-938.
[5] Roffe L,Schmidt K,Ernst E.Efficacy of coenzyme Q10for improved tolerability of cancer treatments:a systematic review[J].J Clin Oncol,2004,22(21):4418-4424.
[6] 刘克杉,吴文芳,韩斯琴,等.辅酶Q10高产菌株的选育[J].沈阳农业大学学报,2005,36(1):89-92.
[7] 关付,于波,齐国先,等.叠氮钠对心肌细胞活力影响的研究[J].中国医科大学学报,2006,35(4):345-347.
[8] 向家云,邓伯勋,刘昱佳.微波诱变选育柑橘采后拮抗菌柠檬酸形克勒克酵母研究[J].微生物学杂志,2008,28(1):8-11.
[9] 沈萍,范秀容,李广武,等.微生物学实验(第3版)[M].北京:高等教育出版社,1999:124-128.
[10] 方立超,黄雪峰,杜珍辉,等.产生辅酶Q10的光合细菌菌株的分离及鉴定[J].微生物学报,2005,45(5):772-775.
[11] 王普,张晓军,沈佳佳,等.发酵法生产辅酶Q10的季也蒙假丝酵母菌株的选育[J].浙江工业大学学报,2006,34(3):281-285.
[12] 李继扬,丁妍,周珮.通过耐受前体或结构类似物质筛选提高辅酶Q10产量[J].复旦学报,2008,35(3):393-395.
