胃病患者胃黏膜真菌感染的检测
郑剑玲,王垂杰,齐 贺,傅纪婷,李玉峰,段 薇
(1.辽宁中医药大学辽宁省基础医学研究所免疫微生物室,辽宁沈阳 110101;2.辽宁中医药大学附属一院消化科,辽宁沈阳 110032)
胃溃疡是临床常见的多发性消化系统疾病,也是胃癌的癌前病变,严重影响患者的消化功能和生活质量,对胃溃疡的预防学研究具有重要意义。除了目前普遍认为幽门螺杆菌感染与胃溃疡、胃癌的发生和转化有密切关系[1]之外,也有胃溃疡、胃癌合并真菌感染的报道[2-3],但目前尚未见到关于寄居于胃黏膜的真菌的基因多态性与溃疡病损程度关系的研究报道。核糖体DNA的内转录间隔区(internal transcribed spacer region,ITS)的ITS1-ITS2部分进化较快,具有种间特异性和种内保守性,是用于真菌种类鉴定和进化方式的重要遗传信息研究的工具[4]。本研究通过检测胃炎和胃溃疡、胃癌患者胃黏膜寄居的真菌ITS序列基因多态性,了解胃黏膜真菌的菌种多样性及其与胃溃疡的关系,为胃溃疡预防学研究奠定微生物学理论基础。
1 材料与方法
1.1 材料
1.1.1 标本来源 采集2008年7月至8月间消化科就诊患者的胃镜钳取胃黏膜标本63例(所有研究对象均知情同意,自愿参加本项研究),近3个月内未使用糖皮质激素等免疫抑制剂,无肿瘤、糖尿病等导致免疫低下的系统性疾病。
1.1.2 试剂 CHROM agar假丝酵母菌显色培养基(郑州博赛生物技术股份有限公司);酵母样真菌生化鉴定管(杭州天和微生物试剂有限公司);lyticase(Sigma,US);protease K(Merk,Ger many);Tris、EDTA、SDS(Sigma,US);dNTP(Roche,Switzerland);TaqE(TaKaRa,大连宝生物工程有限公司);genefinder核酸染料(Bio-V,厦门百维信生物科技有限公司);DNA分子量标准为DL2000 Marker(大连宝生物工程有限公司);真菌ITS序列通用引物[5](上海生工生物工程技术服务有限公司)。
1.1.3 仪器 Olympus DP 71图像采集系统(Tokyo,Japan); Image Pro Plus 4.5 sof tware(Media Cybernetics Inc.,Silver Spring,MD,USA);DYY-8B型稳压稳流电泳仪(北京六一仪器厂);蓝盾TM551可见光凝胶电泳-透射仪(Bio-V,厦门百维信生物科技有限公司);80-1离心机(上海手术器械厂)。
1.2 方法
1.2.1 样本的采集 样本来自2008年7月7日至8月25日于辽宁中医药大学消化科胃镜检查的患者,经知情同意,自愿参加本项研究,共63人。男性41名,女性22名,年龄3~81岁,平均年龄38.78岁。用胃镜钳取胃窦部黏膜组织样本,约3 mm×2 mm×1 mm大小,置于无菌Ep管中,-20℃保存。同时记录受检者年龄、性别、学历、吸烟、饮酒习惯、胃镜检查所见、病理诊断、病史、用药治疗情况。
1.2.2 真菌分离培养 胃黏膜样本加入20μL生理盐水稀释,吹打混匀。取20μL样本液,接种于CHROM agar假丝酵母菌显色培养基,37℃培养3 d,依据分离培养菌落颜色进行鉴定(白假丝酵母菌呈绿色,热带假丝酵母菌呈蓝色,光滑假丝酵母菌呈紫色,克柔假丝酵母菌呈粉色,其余假丝酵母菌呈白色)。
1.2.3 真菌菌种形态学鉴定 采用微量培养法:将分离培养得到的菌株接种于玉米吐温80培养基[6],37℃培养24 h。加入亚甲基蓝染色,加热融化琼脂,盖上盖玻片,光学显微镜下观察,并摄像记录其孢子形态。
1.2.4 真菌菌株的ITS序列检测菌种多样性①真菌DNA提取:取分离培养的白假丝酵母菌5 μL,置1 mL液体沙保罗培养基中增菌。菌液加入3 mg/mL的溶细胞酶(以山梨醇溶液配制)5 μL,37℃水浴过夜,去细胞壁。常规酚-氯仿法提取DNA;②PCR扩增:用真菌ITS序列通用引物ITS1:TCCGTAGGTG AACCT GCGG;ITS4:TCCTC CGCTTATTGA TATGC进行PCR扩增。PCR体系(50μL):H2O 41μL,10×buffer 5.0μL,10 mmol/L dNTP 1μL,20μmol/L前引物0.5μL,20 μmol/L后引物0.5μL,5 U/μL TaqE 0.25μL,DNA模板2μL。循环条件:95℃热启动5 min;95℃30 s,55℃30 s,72℃30 s,40个循环;72℃10 min;4℃保存。2%琼脂糖1×TAE缓冲液,genefinder核酸染料染色,110 V 30 min电泳。PCR产物500~900 bp,紫外线凝胶扫描成像,并记录实验结果;③ITS序列限制性片段长度多态性检测(Restriction fragment length polymorphism,RFLP):RFLP真菌菌种鉴定方法参见文献[2]。取20μL PCR产物,加入10 U Msp I液,操作参照说明书。
1.2.5 统计学处理 采用SPSS11.5统计软件对数据进行pearsonχ2检验,ANOVA方差分析,Kendall等级相关分析,对ITS序列酶切结果、病理诊断、年龄、性别、学历、吸烟、饮酒习惯等各观察指标进行比较分析。P<0.05为显著统计学意义。
2 结果与分析
2.1 胃黏膜真菌分离培养检测结果
32个样本(32/63,50.8%)检出真菌阳性。CHROM agar假丝酵母菌显色培养基检测结果,31个样本呈绿色为白假丝酵母菌,1个样本呈紫色为光滑假丝酵母菌。CHROM agar假丝酵母菌显色培养基检测结果见图1。

图1 CHROM agar假丝酵母菌显色培养基检测结果Fig.1 CHROM agarCandidaculture medium results
2.2 玉米吐温80培养基厚壁孢子法菌种鉴定结果
31个白假丝酵母菌菌株样本产生较大圆形厚壁孢子,部分有明显假菌丝。1个光滑假丝酵母菌呈较小类圆形孢子,无菌丝。形态学检测结果见图2。
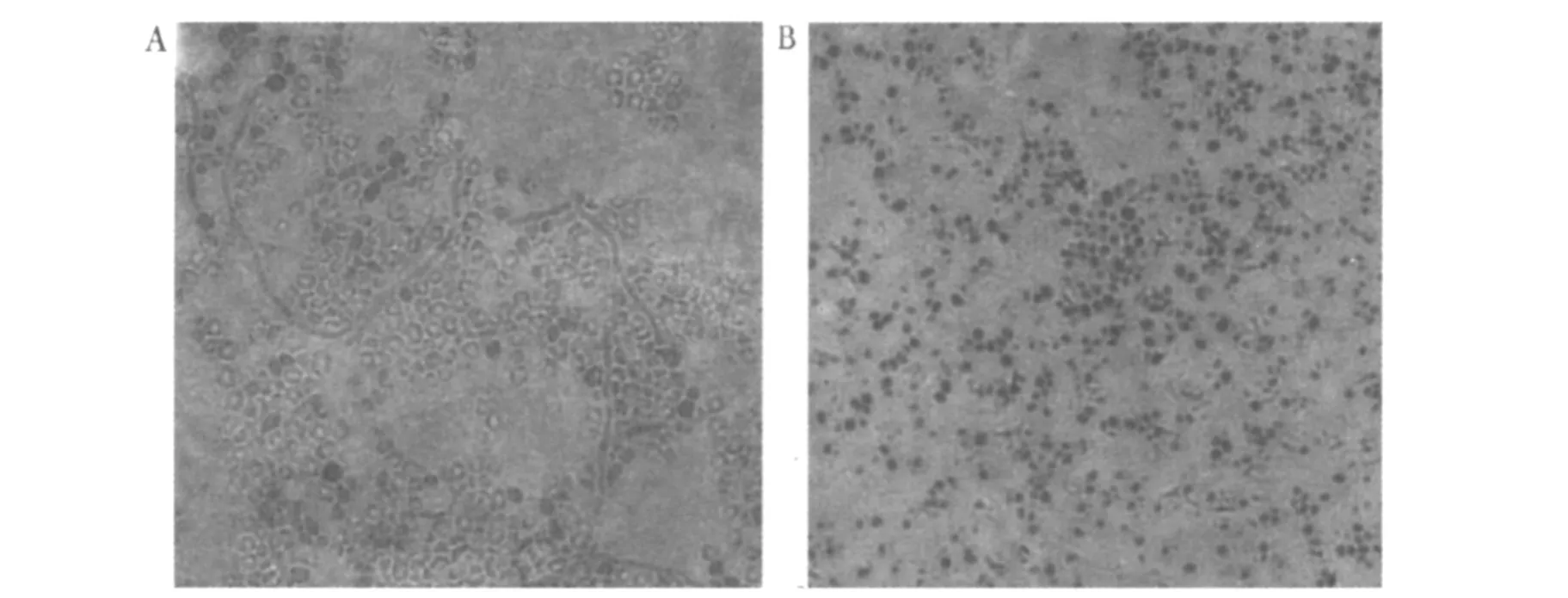
图2 光学显微镜下形态学检查结果,亚甲基蓝染色(40×)Fig.2 Microscope morphological examination results,methylene blue staining(40×)
2.3 ITS序列RFLP检测结果
32个真菌菌株样本均可扩增出ITS1-2基因序列,31个白假丝酵母菌菌株样本PCR产物约为535 bp,1个光滑假丝酵母菌株样本PCR产物约为871 bp。用限制性内切酶Msp I酶切后,31个白假丝酵母菌菌株样本酶切产物为297 bp和238 bp的2个条带,1个光滑假丝酵母菌菌株样本酶切产物为557 bp和314 bp的2个条带。ITS序列PCR结果及Msp I酶切后结果见图3。
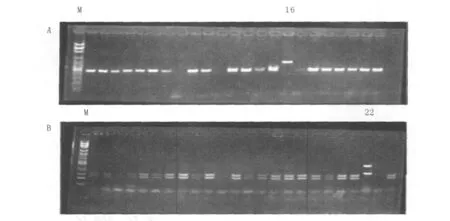
图3 ITS序列RFLP检测结果Fig.3 Electrophoresis figures for ITS sequences
2.4 ITS序列分析
浅表性胃炎、萎缩性胃炎、胆汁反流性胃炎,共抽取7个样本进行ITS测序。糜烂性胃炎抽取7个样本,胃溃疡抽取7个样本进行ITS测序。抽取胃癌1个样本进行ITS测序。ITS序列系统进化树见图4。
2.5 真菌检出阳性与病理诊断及流行病因素相关性分析
经Kendall等级相关分析,真菌阳性与病理诊断成正相关(r=0.263,P=0.027),与性别、年龄、吸烟、饮酒、学历的相关性,均无统计学意义(P>0.05)。在浅表性和萎缩性胃炎、糜烂性胃炎、胃溃疡、胃癌样本中真菌阳性率状况见表1。

表1 在浅表性胃炎、糜烂性胃炎、胃溃疡、胃癌样本中真菌检出阳性率状况Table 1 Positive rate of fungi from samples of patientswith superficial gastritis,erosive gastritis,gastric ulcer,gastric cancer
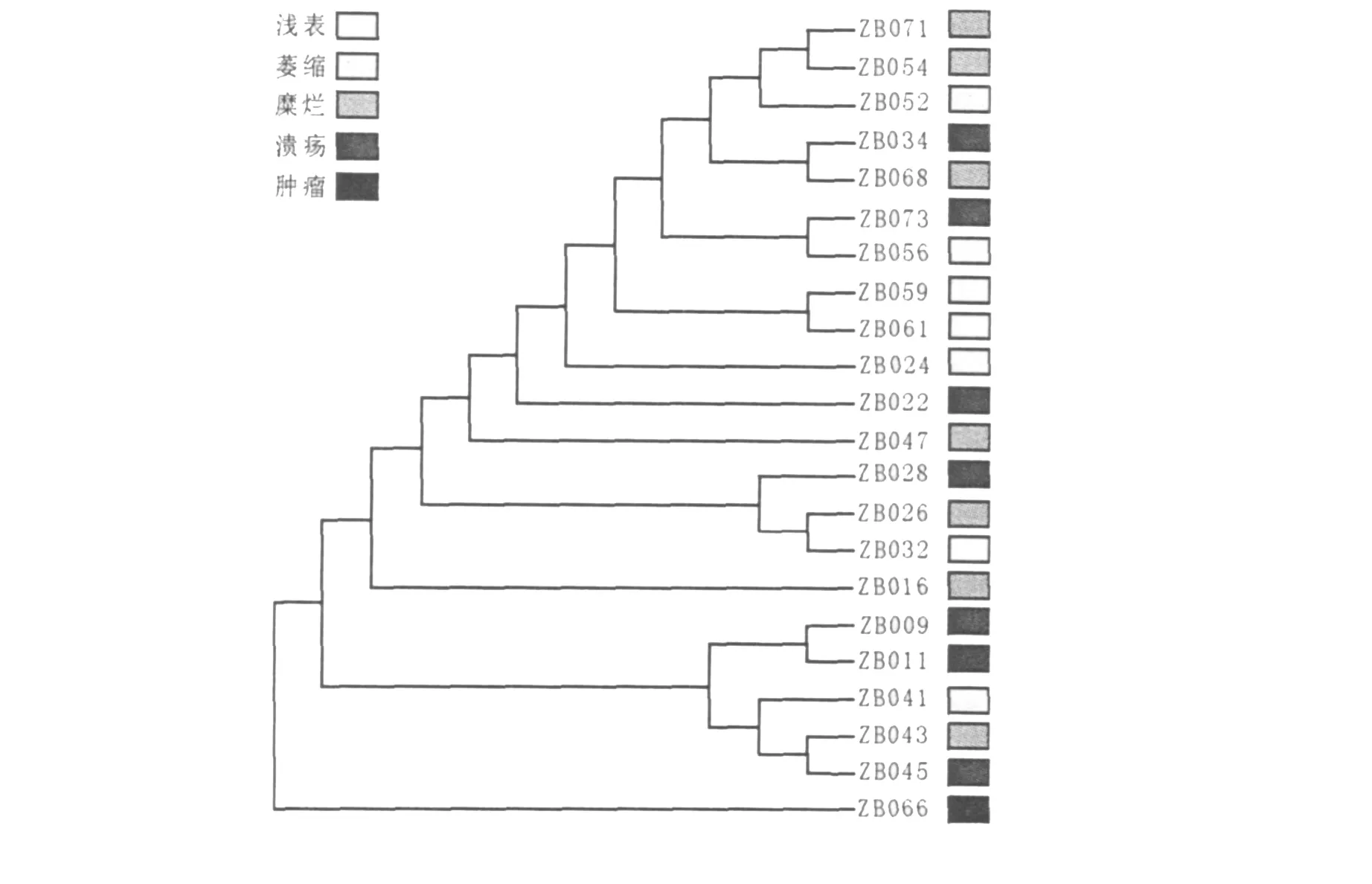
图4 22个真菌菌株测序样本ITS序列系统进化树Fig.4 Phylogenetic tree of ITS sequence from 22 fungal strains
3 讨 论
胃肠道内正常微生物菌群与宿主建立了一种相互依存、相互制约的微生态关系,有诱因时会出现定植在胃肠道的潜在病原菌感染。胃内各种疾病的真菌感染率报道不一,以胃溃疡并发真菌感染多见,其发病率一般为9.1%~33%[7]。陶文洲报道胃癌合并胃真菌感染者达50%[3]。本实验对63名胃炎、胃溃疡和胃癌患者胃黏膜标本经分离培养真菌,结果显示阳性率为50.8%。
Zwolinska等学者于2006年检测了293个消化不良和胃溃疡患者的胃黏膜活检样本,他们用API系统检测从胃溃疡样本分离培养出真菌菌种,光滑假丝酵母菌占42.4%,白假丝酵母菌占38.7%[2]。本实验分离培养出的胃炎和胃溃疡患者的胃黏膜真菌样本绝大多数为白假丝酵母菌,与现有的报道不尽相同,本实验鉴定真菌菌种采用的是ITS序列检测方法,所以白假丝酵母菌检出率差异可能与样本选取和检测方法有关。
本实验选取ITS序列作为对白假丝酵母菌多样性检测方法,因真核细胞核糖体rRNA基因编码DNA序列为18S rRNA-ITS1-5.8S rRNA-ITS2-28S rRNA的串联重复,其中ITS1和ITS2为内含子转录间隔区,ITS1-ITS2部分受自然选择压力小,进化速度较快,从中可以获得较多的进化信息。同时,5S rRNA-5.8S rRNA rRNA-28S rRNA高度保守,具有种间特异性和种内保守性。对真菌的ITS序列进行分析,可以获得真菌种类鉴定和进化方式的可靠遗传信息,将ITS序列提交GenBank,与全球各地提交的真菌ITS进行序列比对,从而了解相关真菌菌种和菌株的同源性关系、进化方向和分布情况,已经广泛应用于真菌的分类进化方面的研究[8]。
在人体内寄居的真菌主要是假丝酵母菌属,其中以白假丝酵母菌最为常见。本实验分离培养真菌32(32/63,50.8%)株,经ITS序列测序鉴定检测到的真菌以白假丝酵母菌为主,白假丝酵母菌31株,光滑假丝酵母菌1株。白假丝酵母菌是重要的条件致病性真菌,在机体免疫功能低下、消化道黏膜生物屏障功能受损时转化为致病菌,其致病性与菌体的黏附、芽管生成、疏水性和胞外酶等有关[9]。白假丝酵母菌有菌丝相和酵母相两种生存形式,菌丝相更易黏附和入侵宿主组织,是该菌在体内的主要致病形式[10-13],但这是假菌丝。伴有白假丝酵母菌感染的消化道黏膜增生病变,将出现癌变比例的增高。有研究显示,白假丝酵母菌胃癌株的毒力及侵袭能力均较正常人口腔菌株强大[14],表明胃病患者与正常人体内白假丝酵母菌存在差异。从基因水平上判断何种差异是最精确的,需对胃病患者与正常人体内白假丝酵母菌真菌菌株测序分析,构建ITS序列系统进化树。本实验发现在浅表性胃炎、糜烂性胃炎、胃溃疡、胃癌样本中真菌检出阳性率呈现出随着病情的加重而逐渐上升的趋势。为此本实验选取22个样本的真菌菌株测序分析,构建ITS序列系统进化树,结果显示真菌基因序列的差异与所致病理损害存在相关性。病理损害程度相近似的样本,其菌株基因型之间同源性较高。因为受限于基因测序样本例数,仅对这一现象进行初步探讨,尚不能得出具有统计学意义的结论,进一步明确其相关性有待更深入实验研究。
从慢性胃炎到最终发展为胃癌的演变过程中,各种致病因子可能单独或协同作用于不同的阶段,微生物感染是其中一个很重要的因素。目前已普遍认为幽门螺杆菌感染是引起胃溃疡的病因,而同样可以在胃肠道黏膜寄居的真菌在胃癌、胃溃疡的发生、发展上可能起一定作用,在这一过程中微生物菌群间的相互作用值得重视,它们之间的关系如何仍有待进一步的探讨研究。
[1] ZwolinskaWM,Budak A,Trojanowska D,et al.Fungalcolonization ofthe stomach and its clinical relevance[J].Mycoses,1998,41(728):327-334.
[2] Mirhendi H,Makimura K,Khoramizadeh M,et al.A one-enzyme PCR-RFLP assay for identification of sixmedically importantCandida species[J].Nippon Ishinkin Gakkai Zasshi,2006,47(3):225-229.
[3] 陶文洲,王娟,池桂霞.胃及十二指肠霉菌感染的前瞻性研究[J].医师进修杂志,1990,11:11.
[4] 周曾同,赵民,张济,等.口腔白色念珠菌的PCR ITS1-ITS2基因分型法的建立及应用[J].实用口腔医学杂志,2006,22(1):60-63.
[5] Chen Y C,Eisner J D,KatterM M,et al.Polymorphic internal transcribed spacer region 1 DNA sequences identify medically important yeasts[J].J ClinMicrobiol,2001,39:4042-4051.
[6] 吴绍熙.现代医学真菌检验手册[M].北京:北京医科大学中国协和医科大学联合出版社,1998:153-168.
[7] 蒋儒忠,王荣金.胃霉菌感染性溃疡五例误诊分析[J].实用外科杂志,1988,8(8):448.
[8] 俞和韦,王中康,刘莉,等.贡嘎蝠蛾幼虫肠道真菌多样性分析[J].微生物学报,2008,48(4):439-445.
[9] 王丹敏,韩景田,董小青,等.白色念珠菌蛋白酶与其毒力关系的研究[J].中国微生态学杂志,2000,12(4):215-216.
[10] Shi QM,Wang Y M,Zheng XD,et al.Critical role of DNA checkpoints in mediating genotoxic-stress-induced filamentous growth in Candida albicans[J].Mol Biol Cell,2007,18(3):815-826.
[11] 张宏,董正蓉,谢明,等.白念珠菌菌丝相与酵母相ERG11基因PCR-RFLP比较分析[J].中国皮肤性病学杂志,2006,20(2):71-73.
[12] Li CR,Wang Y M,De Zheng X,et al.The formin family protein CaBni1p has a role in cellpolarity control during both yeast and hyphal growth inCandida albicans[J].J Cell Sci.,2005,118(12):2637-2648.
[13] Fleischmann J,Liu H,Wu CP.Polyadenylation of ribosomal RNA byCandida albicans also involves the small subunit[J].BMC MolBiol.,2004,5:17.
[14] 高仕英,高天舒,陈丽丽.白色念珠菌胃癌株的生物学特征[J].中国卫生检验杂志,2002,12(5):533-534.

