鼠李糖脂生物表面活性剂及其纯化方法研究进展
田 静 ,王 靖 ,冀 光 ,李 明
(中国石油大学(北京)化学科学与工程学院,北京 102249)
鼠李糖脂生物表面活性剂及其纯化方法研究进展
田 静 ,王 靖 ,冀 光 ,李 明
(中国石油大学(北京)化学科学与工程学院,北京 102249)
鼠李糖脂生物表面活性剂是由微生物在一定的培养条件下分泌的次级代谢产物,具有良好的环境相容性,生产成本是制约其工业化应用的主要因素。综述了鼠李糖脂的常用纯化方法,并对其研究方向进行了展望。
鼠李糖脂;生物表面活性剂;纯化;展望
生物表面活性剂是天然表面活性剂的一种,是微生物在特定条件培养时分泌的具有表面活性的一类代谢产物[1~3]。其中研究较多的是鼠李糖脂生物表面活性剂。与化学表面活性剂相比,鼠李糖脂生物表面活性剂除了具有类似的分子结构、一定的表/界面活性外,还表现出良好的环境和生物兼容性,即具有无毒、无害、易降解的特性。因此,近年来广泛用于环境治理、石油开采、生物医药、造纸及化妆品等领域[4~8],并逐步拓展其它领域的研究应用。
由于化学表面活性剂合成步骤复杂、生产成本固定,而鼠李糖脂生物表面活性剂可以通过选择经济实用的分离方法、优化操作工序来降低成本。因此,寻找经济、实用、高效的分离纯化生物表面活性剂的方法已经成为科研工作者急需解决的问题。
作者在此综述了鼠李糖脂常用的纯化方法,拟为相关研究提供理论及技术基础。
1 鼠李糖脂的结构
鼠李糖脂主要有4种结构[9,10],如图1所示。
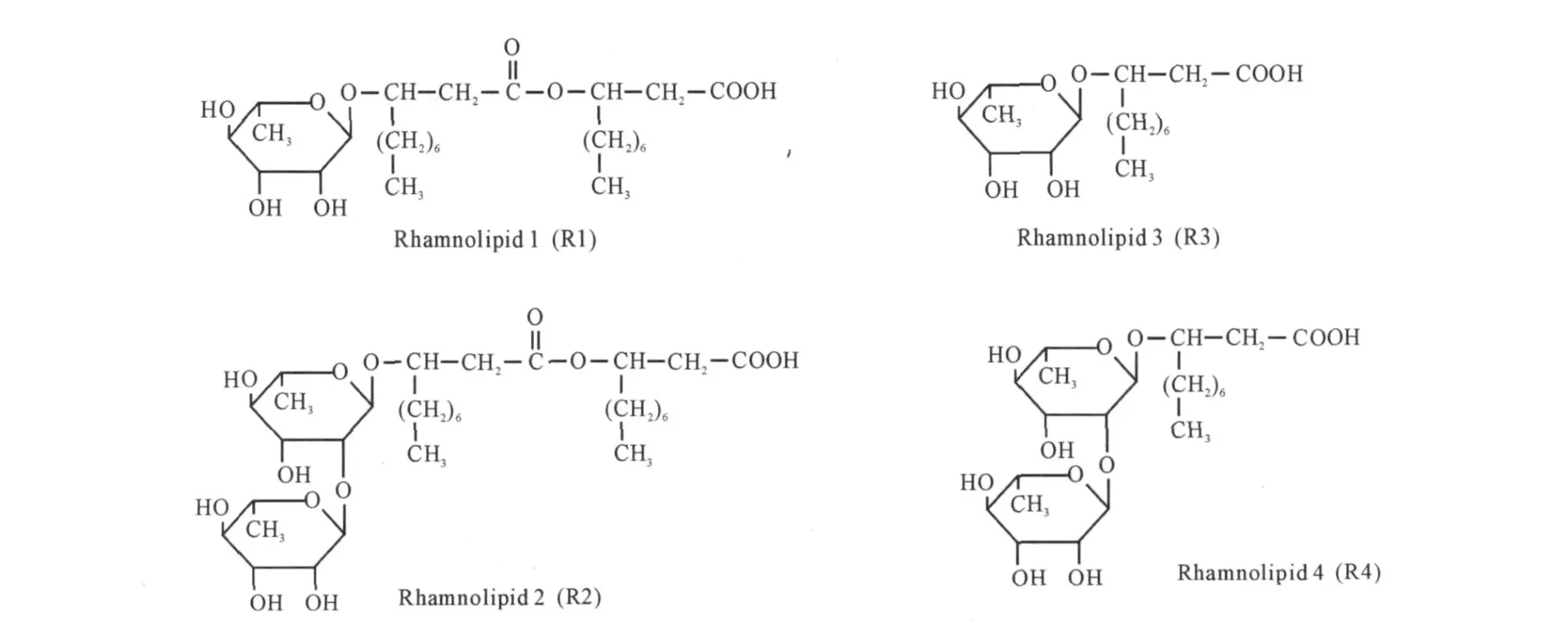
图1 铜绿假单胞菌合成的4种鼠李糖脂的结构Fig.1 Structures of four rhamnolipids produced by P.aeruginosa
2 鼠李糖脂的生物合成途径
鼠李糖脂公认的生物合成途径由Burger等[11]和Ochsner等[12]通过放射性同位素标记前体物质的方法研究并提出(图2)。在此合成途径中,鼠李糖脂的合成是由一系列连续的糖基转移反应完成的,每个反应过程均由特定的鼠李糖脂转移酶进行催化,其中腺苷二磷酸鼠李糖(d TDP2L-鼠李糖)作为糖基的供体,L-鼠李糖苷-β-羟基癸酰-β-羟基癸酸和β-羟基癸酰-β-羟基癸酸分别作为糖基的受体。
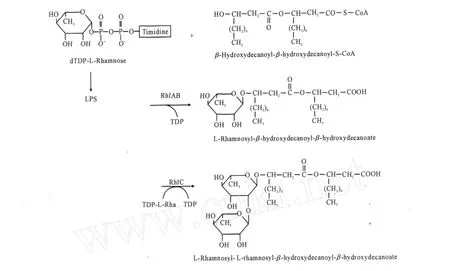
图2 鼠李糖脂的生物合成途径Fig.2 Biosynthetic route of rhamnolipids
3 鼠李糖脂的纯化方法
3.1 预处理微生物发酵液
微生物产鼠李糖脂,一般分泌在细胞外,易贴附于细胞壁上,因此,在分离纯化之前,要进行预处理,通过离心等操作将菌体细胞与培养液分开。
3.2 鼠李糖脂的分离纯化
根据分离方法的不同,鼠李糖脂的分离纯化分为初级纯化和随程提取。
3.2.1 初级纯化
(1)沉淀法:微生物发酵液预处理之后,加入酸使生物表面活性剂沉淀[13],同时进一步去除培养液中残留的菌体细胞。具体方法是:向处理后的发酵液中加入酸类物质,使其最终p H值达到2~ 3;在4℃下放置,观察是否有白色沉淀产生(生物表面活性剂不同,产生沉淀的时间也有所不同),若有白色沉淀产生则产物是脂肽类表面活性剂,若没有白色沉淀产生则是水溶性表面活性剂,离心收集沉淀。为了除去沉淀中夹带的酸性物质,可以选择合适的缓冲溶液重悬沉淀物[14]。
一般来说,在萃取前酸化发酵液沉淀产物可以提高萃取量。
(2)有机溶剂萃取法:有机溶剂萃取法是初步分离纯化技术,常用于去除水溶性杂质。其原理是:利用物质在互不相溶的两相中分配系数的差异而使物质达到分离的目的。戊烷、乙醚、乙酸乙酯、氯仿、甲醇以及氯仿/甲醇等有机溶剂常被用于生物表面活性剂的分离纯化[15~17]。王靖等[18]采用酸沉淀和有机溶剂萃取的方法筛选出的铜绿假单胞菌株Lz221,能以原油为碳源产鼠李糖脂表面活性剂。具体操作是:将发酵液离心去除菌体,用6 mol·L-1的盐酸调上清液p H值为2.0,用等体积的乙酸乙酯萃取2次,合并有机相,40℃减压蒸馏,得到黄色油状的鼠李糖脂粗产品。
分离较低亲水、亲油平衡性的非离子型糖脂类表面活性剂时,一般采用极性较低的甲基叔丁基醚(M TBE)作为萃取剂,这是因为M TBE具有不易燃、低毒性、可生物降解等优点,适用于生物表面活性剂的工业萃取。
3.2.2 随程提取
(1)吸附法:根据疏水程度,通常采用聚苯乙烯树脂或苯酚甲醛离子交换树脂等同时具有吸附和解吸作用的疏水性的两性物质进行吸附。基本步骤[19]是:将微生物发酵液离心后的上清液直接倒入装有吸附剂的吸附柱中,用0.1 mol·L-1的磷酸盐缓冲溶液调p H值至6.1(吸附剂的消耗可以通过测量表面张力得到);用蒸馏水洗涤吸附剂去除可溶性物质及游离脂肪酸;用有机溶剂将生物表面活性剂洗脱下来,旋转蒸发后得到生物表面活性剂粗品;将粗品溶解在适当的缓冲溶液中,用色谱法进一步纯化生物表面活性剂。使用过的吸附剂用1 mol·L-1的NaOH溶液再生循环使用。
吸附过程通常在40℃、p H值5~10的条件下进行,而脱附或解吸过程通常在30℃才能尽可能多地回收生物表面活性剂。活性炭相对于其它吸附剂在上述条件下能表现出良好的吸附性能,而且使用寿命长,能从生物表面活性剂中脱除绝大多数水溶性物质,是目前广泛使用的吸附剂。
相对于萃取法,吸附法除了可以用于连续提取外,还能减少有机溶剂用量,节约成本。
(2)膜滤法:膜滤法是利用膜表面的微孔结构对物质进行选择性分离的处理技术。当液体混合物在一定压力下流经膜表面时,小分子溶质透过膜(称为滤液),而大分子物质被截留,使原液中大分子浓度逐渐增大(称为浓缩液),从而实现大、小分子的分离,达到浓缩和净化的目的。
近年来,膜滤法已经成为提取纯化生物表面活性剂的主要方法。根据生物表面活性剂结构大小的不同,选用不同型号的薄膜。低p H值条件下,生物表面活性剂浓度在临界胶束浓度(CMC)以上时,蛋白质和发酵液中的其它物质更促进了生物表面活性剂聚集成胶束[20],以致无法通过薄膜;但加入有机溶剂后,胶束会自行分散,生物表面活性剂随溶剂透过薄膜。运用此原理分别对原发酵液、初级滤液和甲醇处理过的次级滤液进行高效液相色谱分析[21]。结果发现,如果有峰在原发酵液中出现、在初级滤液中消失、在次级滤液中重新出现,则该峰为表面活性剂特征吸收峰;生物大分子在甲醇的作用下不会裂解,只会失活,因此只会在原发酵液中出现,不会在初级和次级滤液中出现,不会造成干扰。
膜滤法对产品损失很小,但是过滤层的积累会加大渗透压力,造成溶剂流动的附加压力,从而影响溶剂通过膜层的流动,对操作不利。因此,过滤时,应在膜表面处进行混合搅拌,抑制过滤层的形成。
(3)泡沫分离法:泡沫分离法是连续提取的新方法,与膜滤法类似,利用了生物表面活性剂在临界胶束浓度以上形成胶束的特性。微生物的好氧发酵过程中,在充氧和快速搅拌的作用下产生泡沫,生物表面活性剂胶束在其中稳定存在。目的产物在泡沫上的吸附取决于p H值、离子强度和其它表面活性物质的浓度等[22,23]。随着在分离柱中停留时间的延长,重力作用使泡沫中水相液体下沉,有利于目的产物的回收。因此,可以从生物反应器中分离出泡沫,通过酸处理或离心处理使胶束分散,获得生物表面活性剂粗品。
3.3 不同纯化方法的优缺点比较
针对不同的生物表面活性剂,根据其性质的差异,应该选择合适的分离纯化方法。不同分离纯化方法的优缺点比较见表1。

表1 不同纯化方法的优缺点比较Tab11 Comparison of different purification methods
4 展望
鼠李糖脂生物表面活性剂相对于化学表面活性剂具有环境友好、经济实用等优点,因此在微生物采油领域具有很好的应用前景,如菌株Lz-21所产鼠李糖脂的临界胶束浓度为0.63 g·L-1,接种24 h后其发酵液的表面张力达到最低值28 m N·m-1,对原油的乳化指数达78.6%,培养7 d后鼠李糖脂的浓度约为1.8 g·L-1。因此,菌株Lz-21能够有效降解原油,提高原油采收率,同时也可以用于修复烃类污染。由于精细化工领域对表面活性剂精度要求较高,导致生物表面活性剂的生产成本比化学表面活性剂要高出许多,所以生产成本是制约生物表面活性剂广泛应用的主要因素。要降低生产成本,一方面可以采用细胞融合技术等遗传工程手段将多种降解基因转入到同一微生物中构建基因工程菌,提高菌株产表面活性剂能力;另一方面,可以优化表面活性剂的分离纯化操作。在节约成本的前提下,宜综合运用多种方法,同时结合先进的技术手段(如色谱、光谱技术等),开发出更多更好的分离纯化方法。
[1]Das P,Mukherjee S,Sen R.Genetic regulation of the biosynthesis of microbial surfactants:An overview[J].Biotechnology and Gen- et Eng Rev,2008,25:165-186.
[2]M ukherjee S,Das P,Sen R.Towards commercial production of mi2 crobial surfactants[J].Trends Biotechnol,2006,24(11):509-515.
[3]Christofi N,Ivshina IB.Microbial surfactants and their use in field studies of soil remediation[J].J Appl Microbiol,2002,93(6):915-9-9.
[4]Cameotra S S,Makkar R S.Recent applications of biosurfactants as biological and immunological molecules[J].Curr Opin Microbi-ol,2004,7(3):262-266.
[5]陈文求,孙争光.生物表面活性剂的生产与应用[J].胶体与聚合物,2007,25(3):45-46.
[6]Desai J D,Banat IM.Microbial production of surfactants and their commercial potential[J].Microbiol Mol Biol Rev,1997,61(1):47-64.
[7]Rodrigues L,BanatIM,Teixeria J,et al.Biosurfactants:Potential applications in medicine[J].Antimicrob Chemother,2006,57(4):609-618.
[8]Das P,Mukherjee S,Sen R.Antimicrobial potential of a lipopep- tide biosurfactant derived from a marine Bacillus circulans[J].Appl Microbiol,2008,104(6):1675-1684.
[9]Hisatsuka K,Nakahara T,Sano N,et al.Formation of rhamnolipid by Pseudomonas aeruginosa and its function in hydrocarbon fer- mentation[J].Agricultural and Biological Chemistry,1971,35:686-692.
[10]Guerra-Santos L,Kappeli O,Fiechter A.Pseudomonas aerugino- sa biosurfactant production in continuous culture with glucose as carbon source[J].Applied and Environmental Microbiology,1984,48(2):301-305.
[11]Burger M M,Glaser L,Burton R M.The enzymatic synthesis of a rhamnose-containing glycolipid by extracts of Pseudomonas aeruginosa[J].J Biol Chem,1963,238:2595-2602.
[12]Ochsner U A,Hembach T,Fiechter A.Production of rhamnolip- id biosurfactants[J].Advances in Biochemical Engineering Bio- technology,1996,53:89-118.
[13]Prabhu Y,Phale PS.Biodegradation of phenanthrene by Pseudo- monas sp.strain PP2:Novelmetabolic pathway,role of biosurfac- tant and cell surface hydrophobicity in hydrocarbon assimilation[J].Appl Microbiol Biotechnol,2003,61(4):342-351.
[14]梁生康,王修林,陆金仁,等.假单胞菌O-2-2产鼠李糖脂的结构表征及理化性质[J].精细化工,2005,22(7):499-502.
[15]Yin Hua,Qiang Jing,Jia Yan,et al.Characteristics of biosurfac- tant produced by Pseudomonas aeruginosa S6 isolated from oiL- containing w astewater[J].Process Biochemistry,2009,44(3):302-308.
[16]Das K,Mukherjee A K.Crude petroleum-oil biodegradation effi-ciency of Bacillussubtilis and Pseudomonas aeruginosa strains i- solated from a petroleum-oil contaminated soil from North-East India[J].Bioresource Technology,2007,98(7):1339-1345.
[17]Sivapathasekaran C,Mukherjee Soumen,Samanta Ramapati,et al.High-performance liquid chromatography purification of bio- surfactant isoforms produced by a marine bacterium[J].Anal Bioanal Chem,2009,395(3):845-854.
[18]王靖,章厚名,安明泉,等.高效产表面活性剂菌株(Lz-21)的筛选及其特性研究[J].石油化工高等学校学报,2009,22(3):33-36.
[19]Ahimou F,Jacques Philippe,Deleu Magali,et al.Surfactin and iturin A effects on Bacillus subtilis surface hydrophobicity[J].Enzyme and Microbial Technology,2000,27(10):749-754.
[20]Heyd M,Kohnert A,Tan T H,et al.Development and trends of biosurfactant analysis and purification using rhamnolipids as an example[J].Anal Bioanal Chem,2008,391(5):1579-1590.
[21]傅海燕,曾光明,袁兴中,等.生物表面活性剂的分离提纯及其发展前景[J].生物学杂志,2003,20(6):1-4.
[22]Sarachat Thitima,Pornsunthorntawee Orathai,Chavadej S,et al.Purification and concentration of a rhamnolipid biosurfactant pro-duced by Pseudomonas aeruginosa SP4 using foam fractionation[J].Bioresource Technology,2010,101(1):324-330.
[23]Lotfabada Tayebe Bagheri,Shourianc Mitra,Roostaazada Reza,et al.An efficient biosurfactant-producing bacterium Pseudo- monas aeruginosa MR01,isolated from oil excavation areas in south of Iran[J].Colloids and Surfaces B:Biointerfaces,2009,69(2):183-193.
Research Progress of Rhamnolipid Biosurfactant and Its Purification Methods
TIAN Jing,WANG Jing,JIGuang,LIMing
(Faculty of Chemical Science&Engineering,China University of Petroleum,Beijing 102249,China)
Rhamnolipid biosurfactant is the secondary metabolites secreted by microorganism s under certain culture conditions.It has a good environmental compatibility,but the cost of production is the major limiting factor in its industrial applications.The review is outlined in terms of the methods in purification of rhamnolip- id.The development trend of this field in the future is forecasted.
rhamnolipid;biosurfactant;purification;p rospect
TQ 423
A
1672-5425(2010)06-0013-04
国家科技部863课题子课题基金资助项目(2009AA 063504),中石油天然气股份有限公司科技管理部科技开发基金资助项目(2008A21403)
2010-03-09
田静(1987-),女,黑龙江人,硕士研究生,研究方向:应用微生物学、微生物采油;通讯作者:王靖,博士,教授。E-mail:tianjing1-001@163.com,sw hgw j898@cup.edu.cn。

