Cheddar干酪附属发酵剂筛选及其应用
杭志奇,韩清波,许景松
(贝兰德乳业有限公司,河北宁晋 055550)
Cheddar干酪附属发酵剂筛选及其应用
杭志奇,韩清波,许景松
(贝兰德乳业有限公司,河北宁晋 055550)
为了筛选能够促进Cheddar干酪成熟,从泡菜、腐乳及不同产地的Cheddar中筛选具有高肽酶活力和自溶度的乳杆菌作为Cheddar干酪附属发酵剂,并应用于Cheddar干酪的制作中。结果表明,从美国Cheddar干酪中筛选出1株Lactobacillus plantarumQD具有较高的肽酶活力和自溶度,运用于Cheddar干酪的制作中能显著提高其游离氨基酸浓度,改善其风味,有利于加快干酪的成熟。
干酪;附属发酵剂;非发酵剂乳酸菌
0 引言
近年来,农场挤奶及干酪生产等技术、设备的发展使得用于生产干酪的原料乳微生物数量非常低[1]。这对消费者食用乳制品的安全性是有利的,但这也导致了一些对产品风味品质有贡献作用的次生菌群的消失和数量的降低,所以干酪生产者和研究者开始开发附属发酵剂。为抑制乳酸菌继续产酸,在干酪凝乳过程后期进行的热烫处理,致使主要为嗜温菌的主发酵剂乳酸菌的产酸被抑制,而主要为嗜热菌的非发酵剂乳酸菌则不受影响,得以生长至后期成熟中起作用。因此,非发酵剂乳酸菌是干酪附属发酵剂的研究热点之一。本文从泡菜、腐乳及不同产地的Cheddar中筛选具有高肽酶活力和自溶度的乳杆菌,以期筛选到具Cheddar干酪附属发酵剂潜力的菌株,并促进Cheddar干酪的成熟。
1 实验
1.1 材料及设备
生鲜牛乳,全脂和脱脂乳粉,卷心菜泡菜(市售),万方糟方腐乳,自制成熟中期及后期Cheddar干酪,美国蓝多湖Cheddar干酪,金凯利爱尔兰风味淡Cheddar干酪。BX60型相差显微镜。
凝乳酶MARZYME 150,干酪主发酵剂RA070。酪素—琼脂培养基(质量浓度):磷酸二氢钾0.36 g/L,七水硫酸镁0.5 g/L,氯化锌0.014 g/L,七水磷酸氢二钠1.07 g/L,氯化钠0.16 g/L,氯化钙0.002 g/L,硫酸亚铁0.002 g/L,酪素4 g/L、胰酶0.05 g/L、琼脂20 g/L,pH值为6.5~7.0[2];MRS液体及固体培养基,ROGOSA固体培养基;其他为实验室常规分析纯化学试剂。
1.2 Cheddar干酪附属发酵剂乳杆菌的初步筛选
准确称取10.0 g样品,转移至装有含有玻璃珠及90.0 mL无菌水的三角瓶中,用玻璃珠将样品打散。吸取1 mL的样品,用PBS缓冲液进行梯度稀释至合适浓度,吸取0.1 mL的样品并涂布于调整的ROGOSA琼脂平板(3%的NaCl浓度,pH值为5.0,近似干酪成熟环境)上,30℃倒置厌氧培养36~72 h[3]。挑取典型菌并于MRS固体培养基上进行划线纯化,镜检选取目的菌株并将单菌落菌株于斜面划线保存以备后用。
1.3 Cheddar干酪附属发酵剂乳杆菌的复筛
附属发酵剂一般是具备高的肽酶活力[4]、高的自溶度[5,6]并能在干酪成熟环境中生长的乳杆菌,因此,选用自溶度及肽酶活力对初筛得到的乳杆菌进行复筛。
1.3.1 总肽酶活力的测定
(1)铬—茚三酮法测定总游离氨基酸含量:取1 g氯化铬溶解于1 mL去离子水中,0.8 g茚三酮溶于80 mL的90%(体积比)乙醇和10 mL的冰醋酸混合液中,两溶液混合摇匀,即得铬—茚三酮试剂。分别取100,200,300,400,500与600 μL浓度为2.0 mmol/L的亮氨酸溶液,用蒸馏水补齐至1 mL,加入2 mL铬—茚三酮试剂,84℃水浴中保温5 min,取出室温下保持10 min,在λ= 507nm处测定吸光度[7]。
(2)菌体总肽酶活力测定底物的制备:以质量浓度为10 g/L酪蛋白溶解于浓度为0.05 mol/L的柠檬酸钠溶液中(pH值为5.4凝乳酶最适pH值,含质量浓度2 g/L的叠氮钠)中,85℃下加热10 min,水浴中冷却至30℃,以质量浓度120 g/100L的量加入凝乳酶(凝乳酶加入前以pH值为5.4,浓度为0.05 mol/L柠檬酸钠溶液稀释20倍),30℃条件下酶解解24 h,再热处理(85℃,10 min)使凝乳酶失活。用pH值为7.0、浓度为0.05 mol/L的柠檬酸钠溶液调节pH值为6.0,所得溶液通过0.2 μm的膜过滤,滤液即为总肽酶活力测定的反应底物,-20℃储存备用[8]。
(3)菌体无细胞提取液的制备:将1.3初步筛选得到的菌株接入MRS培养基中30℃培养24h,连续活化2代,以体积分数为2%的接种量接入三角烧瓶中进行增殖培养,待增殖至对数生长期时,将菌体培养液于4℃下5 000 g冷冻离心15 min收集菌体。将菌体重新悬浮于浓度0.05 mol/L pH值为7.0的磷酸缓冲液中,在冰浴中用超声波破碎菌体。然后4℃下20000g冷冻离心10 min收集上清液,即为菌体无细胞提取液(CFE),-20℃下储存备用。
(4)菌体无细胞提取液总肽酶活力的测定:将一定量的菌体培养液接种于500 μL的底物中,在30℃下培养48 h,测定溶液中总游离氨基酸的浓度。由于铬—茚三酮只与游离氨基酸反应显色,而不与肽反应,所以通过这种方法测定溶液中总游离氨基酸的浓度,并依此评价各菌株总肽酶活力的高低[9]。
1.3.2 乳酸菌自溶度的测定
当乳酸菌的菌体细胞发生自溶时,自溶酶裂解细胞壁从而造成原生质体溶解,因此,导致菌体悬浊液在可见光范围内的吸光值下降[10]。根据此原理,将1.3初步筛选得到的菌株接入MRS培养基中30℃培养24 h,连续活化2代,以体积分数为2%的接种量接入液体MRS中进行增殖培养18 h,将菌体培养液于4℃下5 000 g离心15 min收集菌体,将离心所得到的菌体用浓度为0.1 mol/L(pH值为5.4)的PBS缓冲溶液(含质量浓度15 g/L的NaCl)洗涤2次,最后悬浮于相同的PBS溶液中并调整初始A645nm为0.8~1.0。将带菌体的缓冲液置于30℃培养箱内培养,每隔一定时间测定菌液在645 nm处吸光值的变化。自溶度的计算公式为[11]
自溶度=(1—At/A0)×100%,
式中:At为菌体不同培养时间时的吸光值;A0为起始菌体悬浮液吸光值。
1.4 筛选菌株的特征和鉴定
将筛选得到的菌株进行革兰氏染色镜检;采用体积分数为3%的H2O2进行过氧化氢酶试验;采用API 50 CH试剂盒试剂中API 50 CHL培养基进行49种碳水化合物的发酵试验。
1.5 筛选菌株的制作Cheddar干酪的应用
以干酪主发酵剂RA070制作的Cheddar干酪作为空白对照,用筛选出的最佳菌株作为干酪附属发酵剂来制作Cheddar干酪,并测定其对干酪的生产过程中的产酸速率、成熟期游离氨基酸浓度和感官的影响。
2 结果与讨论
2.1 附属发酵剂的初筛
泡菜汁、腐乳汁、MG公司自制的成熟中期与后期的Cheddar干酪、美国和爱尔兰进口的Cheddar干酪及新鲜牛乳样品按方法1.3进行乳杆菌的分离及纯化。实验结果表明,所有样品中均存在能够于ROGOSA上生长的微生物,并从中挑选出典型菌落。典型菌落共计35个,其中,泡菜汁来源的有12株,编号为PC1~PC12;腐乳汁来源的有3株,编号为FR1~FR3;由MG公司提供的成熟中期的Cheddar干酪中分离到1株,编号为QD1;由MG公司提供的成熟后期的Cheddar干酪中分离到4株,编号为QD2~QD5;从美国Cheddar干酪中分离到5株,编号为QD6~QD10;由爱尔兰Cheddar干酪中分离到6株,编号为QD11~QD16;由生鲜牛乳中分离到4株,编号为SR1~SR4。
无菌操作,挑取单个菌落,进行革兰氏染色,镜检观察菌体形态是否单一,并选取G+无芽孢杆菌为目的菌株。实验结果表明,G+杆菌共27株,分别为PC1~PC12,QD1,QD3~QD10,QD12,QD14,QD15,SR1,SR2,SR4。腐乳汁中的微生物于ROGOSA平板上仅形成3个菌落,其菌落形态较其他来源亦有显著差异,经镜检确定为霉菌,因此,腐乳汁中乳杆菌不是优势菌种,生长受抑制,数量极少。
2.2 附属发酵剂的复筛
2.2.1 总游离氨基酸含量的测定
采用铬—茚三酮试剂法测定不同亮氨酸浓度溶液在507nm的吸光度,并以亮氨酸浓度为横坐标,507nm处的吸光度为纵坐标作图,数据点经线性拟合得到亮氨酸浓度—A507nm的标准曲线,如图1所示。
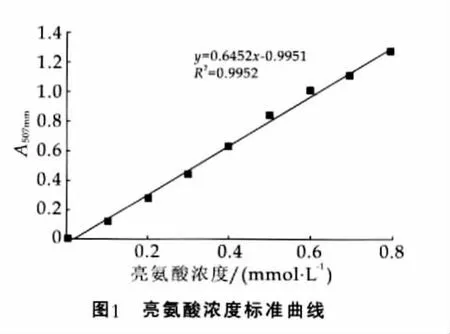
由图1可以看出,亮氨酸溶液的A507nm与其浓度呈正相关的关系,拟合得到的2者关系曲线为y= 0.6452x-0.9951,R2=0.9952。
2.2.2 总肽酶活力的测定
将MRS培养好的菌株,离心收集菌体并用灭菌的PBS调整其菌体浓度约为108mL-1,并按1.3.1(3)中方法制备菌体无细胞提取液,分别取500 μL的CFE接种于按1.3.1(2)制备的500 μL总肽酶活力测定的反应底物的底物中。以蒸馏水作空白进行调零,分别测定各溶液的A507nm,并依此评价各菌株总肽酶活力的高低,结果如表1所示。
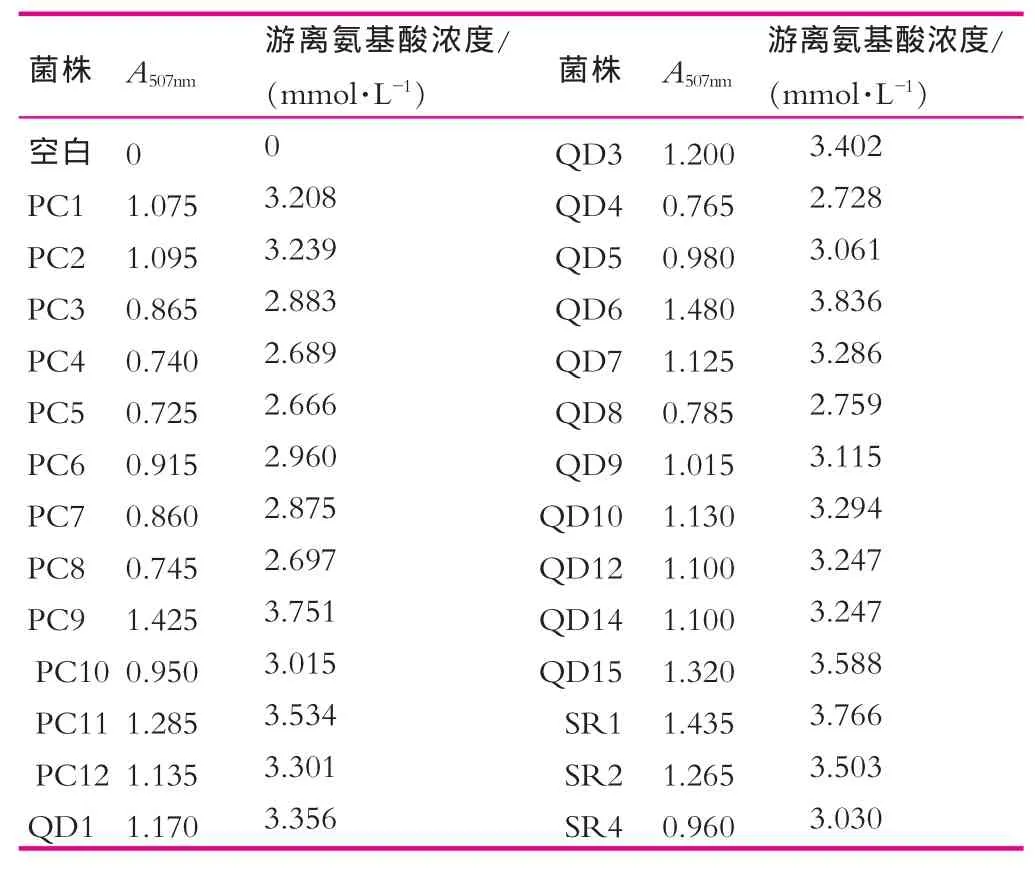
表1 不同菌株菌体无细胞抽提液总肽酶活力(以Leu计)
由表1可以看出,接种无细胞提取液的酪蛋白水解液都有一定的A507nm,就说明了这27株菌都有一定的肽酶活力,其中的PC1~PC8,PC10,PC12,QD1,QD4,QD5,QD8,QD9,QD10,QD12,QD14及SR4显示出了较低的肽酶活力;选择肽酶活力较高的PC9,PC11,QD3,QD6,QD7,QD15,SR1及SR2以自溶度为指标进行进一步筛选。
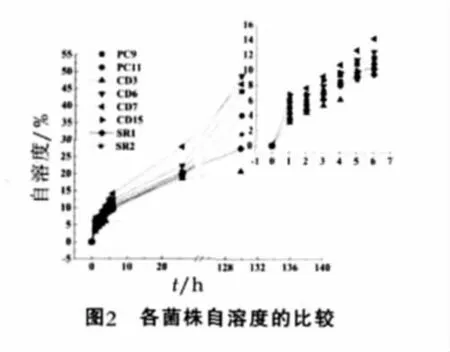
由图2可以看出,各菌株在30℃条件下用浓度为0.1 mol/L(pH值为5.4)的磷酸氢钠缓冲溶液中的自溶度进行比较发现,PC9,PC11,QD3,QD6,QD7,QD15,SR1及SR2中的QD6和QD7具有较高的自溶度,且QD7略高于QD6。而QD6的肽酶活力比QD7高,因此最终确定QD6为具Cheddar干酪附属发酵剂潜力的理想菌株。
2.3 菌种鉴定
对菌株QD6进行革兰氏染色并镜检,确定其为典型的G+杆菌;过氧化氢酶反应结果为阴性。
采用法国梅里埃(bioMérieux)公司的API 50 CHL试剂盒,对QD6进行49种碳水化合物的发酵试验,37℃培养48 h。将QD6利用碳水化合物的情况(数据未给出)输入梅里埃(bioMérieux)公司的细菌鉴定系统,经数据库查询核对,得出鉴定结果:菌株QD6为乳酸菌属植物乳杆菌Ⅱ型(Lactobacillus plantarumⅡ)。因此,将该菌株命名为Lactobacillus plantarumQD。
2.4 L.plantarum QD对干酪成熟的影响
将L.plantarumQD作为附属发酵剂,RA070作为主发酵剂,接种于巴氏灭菌牛乳中,制成干酪凝块,并以只添加RA070制作的干酪凝块作空白对照,比较L. plantarumQD对干酪成熟的影响,2者的原料如表2所示。L.plantarumQD对干酪生产工艺参数的影响如表3所示。
表2 干酪生产原料
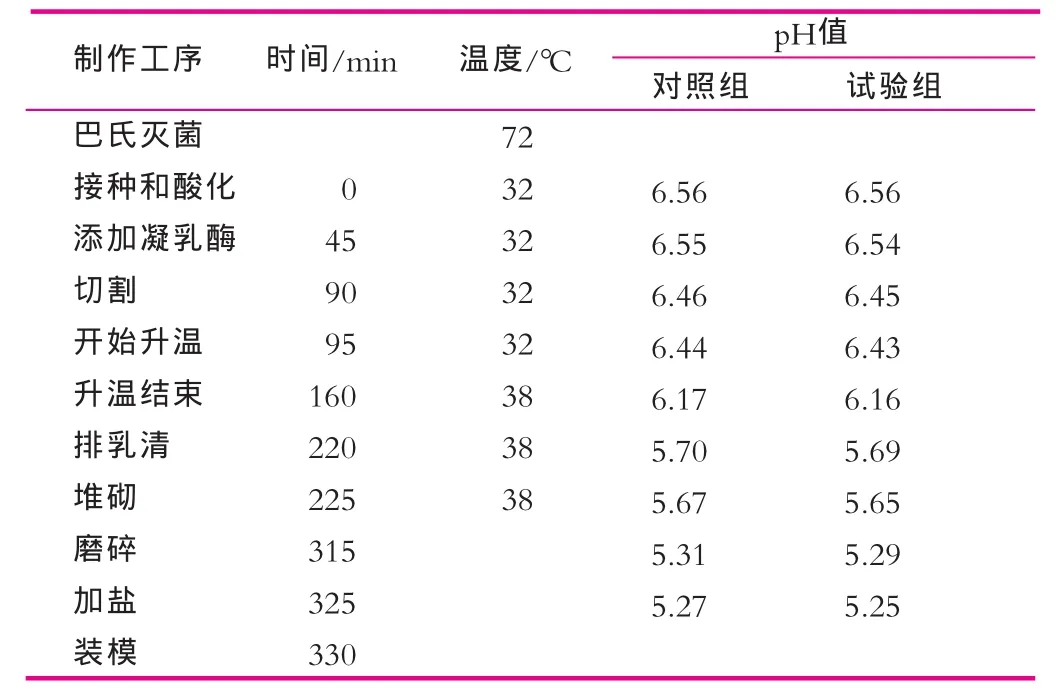
表3 干酪生产工艺参数对照
由表3可以看出,添加了L.plantarumQD的干酪与空白对照干酪相比,没有影响干酪生产过程中的产酸速率,对干酪的生产工艺也没有影响。因此,其在干酪的实际加工生产过程中初步应用的效果良好。
将制成的2块干酪置于13℃成熟间静置成熟,分别于7,14及21 d定期取其少量样品,用无菌水稀释10倍后,以铬-茚三酮试剂法测其游离氨基酸生成量,结果如表4所示。
由表4可以看出,干酪凝块在13℃成熟了21 d后,接种了L.plantarumQD作附属发酵剂的干酪凝块中游离氨基酸浓度(以Leu计)对照组干酪凝块多了4.12mmol/L,且风味较对照组好。这表明了L.plantarumQD在干酪实际应用中的成熟阶段也显示出了较高的肽酶活力,有利于加快干酪的成熟。
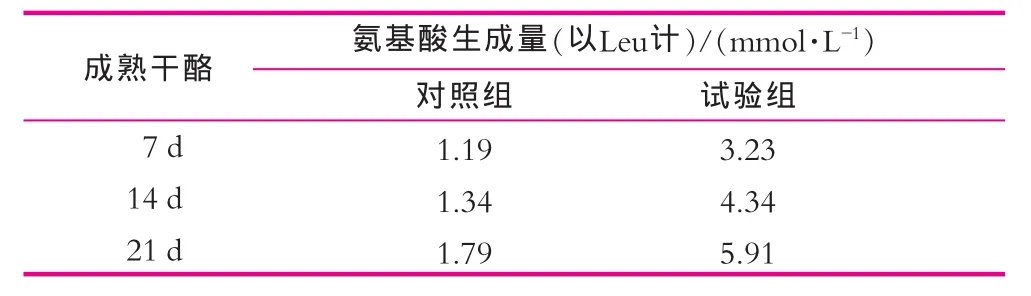
表4 L.plantarum QD对干酪氨基酸生成量的影响
3 结论
以高肽酶活力及自溶度为指标,从泡菜、腐乳及不同产地的Cheddar中筛选能够促进其成熟的乳杆菌作附属发酵剂。从美国Cheddar干酪中筛选出1株L. plantarumQD具有较高的肽酶活力与自溶度,将其以附属发酵剂添加至Cheddar干酪的制作中,其对主发酵剂RA070的产酸凝乳过程没有显著影响,但在3周的成熟过程中能显著增加干酪中的游离氨基酸浓度,并增强其风味。因此,L.plantarumQD是1株具Cheddar干酪附属发酵剂潜力的菌株,但须对其安全性作进一步评价。
[1]杭锋,郑小平,赵建,等.促干酪成熟附属发酵剂的研究进展[J].中国乳品工业,2008,36(2):45-49.
[2]常维山,张春阳,牛钟相,等.产蛋白酶枯草芽胞杆菌益生菌种的筛选与应用[J].中国畜牧杂志,2003,39(3):10-11.
[3]赵玲艳,邓放明,杨抚林,等.自然发酵辣椒中乳酸菌的分离及其发酵性能研究[J].食品科学,2005,26(10):82~86.
[4]SODA M E,MADKOR S A,TONG P S.Evaluation of Commercial Adjuncts for Use in Cheese Ripening:Comparison between Attenuated and Not Attenuated Lactobacilli[J].Milchwissenschaft,2000,55:260-263.
[5]KAWABATA S,VASSAL L,BARS D L,et al.Phage-induced Lysis of Lactococcus lactis during Saint-Paulin Cheese Ripening and Its Impact on Proteolysis[J].Lait,1997,77:229-239.
[6]LEPEUPLE A S,VASSAL L,CESSELIN B,et al.Involvement of a Prophage in the Lysis of Lactococcus lactis ssp.Cremoris AM2 during Cheese Ripening[J].International Dairy Journal,1998,8(7):667-674.
[7]FOLKERTSMA B,FOX P F.Use of the QD-ninhydrin Reagent to Assess Proteolysis in Cheese during Ripening[J].Journal of Dairy Research,1992,59:217-224.
[8]KUCHROO C N,FOX P F.Soluble Nitrogen in Cheddar Cheese: Comparison of Extraction Procedures[J].Milchwissenschaft,1982,37(6): 331-335.
[9]BOUTROU R,GRIPON J C,SEPULCHRE A,et al.Simple Tests for Predicting the Lytic Behavior and Proteo-lytic Activity of Lactococcal Strains in Cheese[J].Dairy Sci,1998,81(9):2321-2338.
[10]冯镇.乳酸菌自溶影响因素及机理研究[D].哈尔滨:东北农业大学, 2004.
[11]冯镇,张兰威,姚伟.培养时间对乳酸菌自溶影响及菌体形态学变化[J].中国乳品工业,2006,34(7):28-30.
Screening and application of adjunct culture for cheddar cheese
HANG Zhi-qi,HAN Qing-bo,XU Jing-song
(Heibei Beilande Dairy Co.,Ltd Ninjin 055550,China)
Lactobacilliwith high peptidase activities and autolysis rates were screened from pickle,fermented beancurd and different cheddar cheese as adjunct culture,in order to accelerate the ripening the cheddar cheese.The results showed that the peptidase activitiy and autolysis rate ofLactobacillus plantarumQD from American cheddar cheese were both higher than other screened Lactobacilli.The amount of free amino acid and sensor of cheddar cheese addedLactobacillus plantarumQD as adjunct culture were higher and better than the control,respectively.Therefore,Lactobacillus plantarumQD was useful for accelerating the ripening the cheddar cheese.
cheese,adjunct culture,NSLAB
TS252.53
A
1001-2230(2010)04-0013-04
2010-01-18
杭志奇(1956-),男,总工程师,研究方向为乳品加工技术。
- 中国乳品工业的其它文章
- 益生菌制品的研究进展

