厌氧氨氧化膨胀污泥床反应器的化学计量学特性
唐崇俭,郑 平 (浙江大学环境工程系,浙江 杭州 310029)
在缺氧条件下,厌氧氨氧化菌能够以亚硝酸盐为电子受体氧化氨生成氮气[1],从水中去除氮污染物.厌氧氨氧化工艺无需曝气,可减少能耗,也无需补充有机物,运行费用较低[2-3].该工艺的容积基质去除速率可达50.75kg N/(m3·d)[4],远远高于硝化-反硝化生物脱氮工艺[<0.5kg N/(m3·d)],现已成功应用于污泥压滤液等高氨氮废水处理[5].
厌氧氨氧化是以氨和亚硝酸盐为反应物的生物反应,其主要产物为氮气和硝酸盐[6].理论上,该反应消耗的NH4+-N、NO2--N与生成的NO3--N摩尔计量系数之比为1:1.32:0.26[6].但在反应器的实际运行中,各研究者测得的化学计量关系不尽相同,据 Liu等[7]研究,反应器去除的NO2--N与NH4+-N之比为0.91:1,而据Strous等[8]研究,SBR去除的NO2--N与NH4+-N之比可达2.0:1.各研究者测得的硝酸盐产生量也有较大差异,文献报道的硝酸盐产生量与氨氮去除量之比为0.04~0.41[5-6,9-11].一般推测,反应器的运行条件(如 HRT)和菌群结构是造成化学计量关系产生差异的重要原因[7,9].本研究采用膨胀污泥床反应器(ESB),通过改变进水基质浓度和进水基质比例,考察了该工艺的化学计量学特性.
1 材料与方法
1.1 试验废水
试验采用模拟废水,其组成(g/L)为[12]:KH2PO40.01, CaCl2·2H2O 0.0056, MgSO4·7H2O 0.3,KHCO31.25;微量元素浓缩液Ⅰ、Ⅱ各1.25 mL/L.微量元素浓缩液Ⅰ的成分(g/L)为:EDTA 5,FeSO45;微量元素浓缩液Ⅱ的成分(g/L)为[13]:EDTA 15,H3BO40.014, MnCl2·4H2O 0.99, CuSO4·5H2O 0.25, ZnSO4·7H2O 0.43, NiCl2·6H2O 0.19,NaSeO4·10H2O 0.21, NaMoO4·2H2O 0.22. NH4+-N和NO2--N由(NH4)2SO4和NaNO2提供,浓度按需配制.
1.2 试验装置
采用ESB反应器(图1),由有机玻璃制成,容积为1.1L,外裹黑布,以防光的负面影响[14].废水通过蠕动泵连续泵至反应器底部,反应生成的氮气从反应器顶部气室引出,出水从反应器上部溢流堰排放.进水pH值采用盐酸调节为6.8左右[15],操作温度控制在(35±1)℃,回流比(R)控制为1.07.

图1 厌氧氨氧化ESB反应器示意Fig.1 Schematic diagram of anammox ESB reactor
1.3 接种污泥
厌氧氨氧化ESB反应器的接种污泥取自实验室小试厌氧氨氧化反应器,在进行本实验前,该反应器已成功启动并已稳定运行 60d[16].从反应器中部取样测得污泥浓度为15.2g VSS/L,VSS/TSS为0.81.
1.4 试验方法
在整个试验过程中,反应器的水力停留时间(HRT)和R分别控制为11.7h和1.07不变.试验共分为3个阶段,分别记为Phase I、II、III.在Phase I期,同时提高进水氨氮和亚硝酸盐浓度,进水NO2--N/NH4+-N控制为1.0~1.1,以提升反应器的容积负荷,强化反应器的厌氧氨氧化功能. Phase II期间,固定进水氨氮浓度为420mg/L,设置不同的进水亚硝酸盐浓度,考察亚硝酸盐浓度变化对反应器化学计量关系的影响.在Phase III阶段,控制进水亚硝酸盐浓度为600mg/L,设置不同的进水氨氮浓度,考察氨氮浓度变化对反应器化学计量关系的影响.在Phase II和III期间,在每个进水浓度下反应器至少运行1周,待反应器运行性能稳定后再调整进水浓度.
1.5 测定项目与方法
氨氮:水杨酸-次氯酸盐光度法[17];亚硝氮:N-(1-萘基)-乙二胺光度法[17];硝氮:紫外分光光度法[17];pH值:pHS-9V型酸度计;TSS、VSS:重量法[17].比污泥厌氧氨氧化活性采用Dapena-Mora等[18]的方法测定.由于试验中没有有机氮,故总氮(TN)浓度为3种无机氮浓度之和.
2 结果
2.1 反应器稳定运行性能
在Phase I,控制ESB反应器的HRT为11.7h,回流比为1.07,逐步将进水氨氮和亚硝酸盐氮浓度分别由198,210mg/L提高至420,450mg/L(图2a),容积氮负荷升高为1.78kg/(m3·d).由图2a可见,在负荷提升过程中,反应器的出水氨氮和亚硝酸盐氮浓度比较稳定,其中亚硝酸盐氮浓度稳定在30mg/L以下;硝酸盐氮浓度随基质浓度的提高而逐渐升高至(69±4)mg/L.运行至第40~50d时,反应器的容积基质氮去除速率为(1.63±0.02)kg/(m3·d),亚硝酸去除率稳定在97%左右(图2b),比污泥厌氧氨氧化活性升高为0.26kg/(kgVSS·d).此阶段反应器的化学计量关系如图2c所示.随着反应器容积负荷的提高,反应器去除的NH4+-N,NO2--N以及产生的NO3--N之比逐渐稳定于1:(1.25±0.01):(0.20±0.01)(图2c),接近厌氧氨氧化的化学计量关系[式(1)]和文献报道值[5-6],表明反应器内厌氧氨氧化反应正常.

2.2 NO2-对化学计量学的影响
在pHase II,控制进水氨氮浓度为420mg/L,将进水 NO2--N/NH4+-N 设定为0.86~1.67,反应器出水中的各污染物浓度列于表 1.根据进出水浓度,可算得反应器对氨氮和亚硝酸盐的去除量(ΔNH4+-N、ΔNO2--N)以及硝酸盐的产生量(ΔNO3--N),如图3所示.

图2 厌氧氨氧化ESB反应器稳定运行时的性能Fig.2 Performance of the anammox ESB reactor during Phase I
根据图 3,当进水亚硝酸盐浓度逐渐升高至554mg/L时(进水NO2--N/NH4+-N逐渐升高至理论值 1 .32),ΔNH+-N、ΔNO--N以及ΔNO--N423逐渐升高为(415±3),(537±21),(94±5)mg/L.这表明在反应物氨氮相对过量时,反应物的转化和产物的产生由亚硝酸盐浓度控制.当进水亚硝酸盐浓度为600mg/L时(进水NO2--N/NH4+-N为1.43,亚硝酸盐相对过量),ΔNH4+-N和ΔNO3--N分别为 ( 417±4),(94±3)mg/L,与 进 水 NO2--N/NH4+-N=1.32时的值相当(图3),但ΔNO2--N 为(554±9)mg/L,平均值增加了 17mg/L,表明在NO2--N相对过量时,反应器对剩余的NO2--N具有额外的吸纳作用.而当进水NO2--N/NH4+-N为1.67时(进水 N O2--N 浓度为 700mg/L),ΔNH4+-N、ΔNO2--N以及ΔNO3--N均下降(图3),这主要是由于进水NO2--N/NH4+-N严重偏离理论值,导致亚硝酸盐过量较多,亚硝酸盐的抑制作用使得反应器的厌氧氨氧化性能恶化[8],出水NH4+-N、NO2--N浓度急剧升高(表 1 ),因而相应的去除量和产生量均降低.

表1 pHase II期反应器的进出水氮浓度Table 1 Influent and effluent nitrogen concentration of the ESB reactor during Phase I
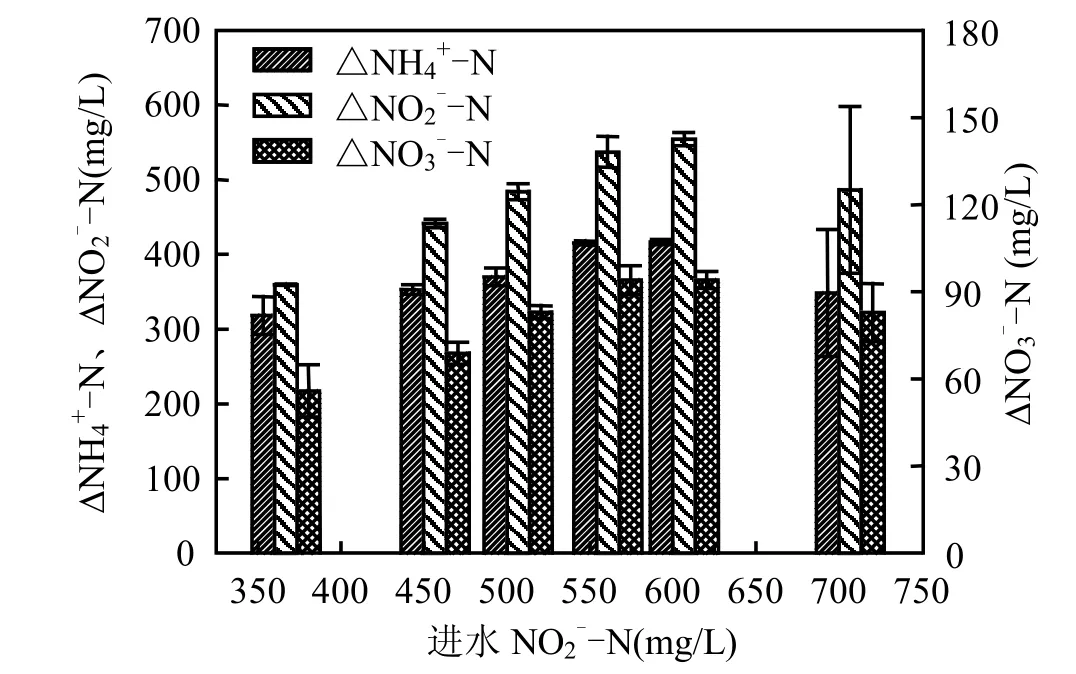
图3 pHase II 期氨氮、亚硝酸盐的去除量和硝酸盐产生量Fig.3 Ammonium and nitrite removal and nitrate production during Phase II
Phase II期的化学计量关系如图4所示.在氨氮浓度不变时,随着进水NO2--N/NH4+-N的升高,反应器去除的NO2--N/NH4+-N和产生的NO3--N/NH4+-N均呈直线增加趋势(R2分别为0.930 和 0 .932),其中 N O2--N/NH4+-N 由 1 .16±0.03(进水 N O2--N/NH4+-N为0.86)升高至1.40±0.05(进水 N O2--N/NH4+-N为 1 .67),可见化学计量关系也呈现额外吸纳基质的性能,即亚硝酸盐的相对量多,被转化亚硝酸盐的量也多;NO3--N/NH4+-N由0.18±0.03升高为0.25±0.05.一般认为,在厌氧氨氧化过程中,从亚硝酸盐转化为硝酸盐的反应可产生还原力[19],被转化的亚硝酸盐绝对量和相对量越多,产生的硝酸盐绝对量和相对量也越多.

图4 pHase II期ESB反应器的化学计量关系Fig.4 Stoichiometry of the ESB reactor during Phase II
2.3 NH4+对化学计量学的影响
在pHase III 期,进水亚硝酸盐浓度设定为600mg/L.表 2列出了在不同进水氨氮浓度下反应器的出水水质情况.在不同进水氨氮浓度下反应器的氨氮去除量(ΔNH4+-N)、亚硝酸盐去除量(ΔNO2--N)以及硝酸盐产生量(ΔNO3--N)如图5所示.
由图5可知,当进水NH4+-N/NO2--N超过了厌氧氨氧化反应的理论值(0.76),亦即进水中氨氮相对过量时,随着进水氨氮浓度的升高,ESB反应器对亚硝酸盐氮的去除量保持稳定,为597~600mg/L.氨氮去除量逐渐由 528mg/L升高至 585mg/L,增加 57mg/L,表明在氨氮相对过量时,反应器对氨氮也存在额外的吸纳作用.而硝酸盐氮产生量呈减少趋势,至进水 NH4+-N浓度为1000mg/L 时,仅为(57±5)mg/L(表2、图 5).如前所述,厌氧氨氧化菌可从亚硝酸盐氧化成硝酸盐的反应获得还原力,在亚硝酸盐去除量一定的情况下,根据反应式(1),硝酸盐产生量理应保持稳定,但本研究结果显示硝酸盐产生量随进水氨氮相对量的增加而减少,这一现象尚未见有研究者深入分析.

表2 pHase III 期反应器的进出水氮浓度Table2 Influent and effluent nitrogen concentration of the ESB reactor during Phase III
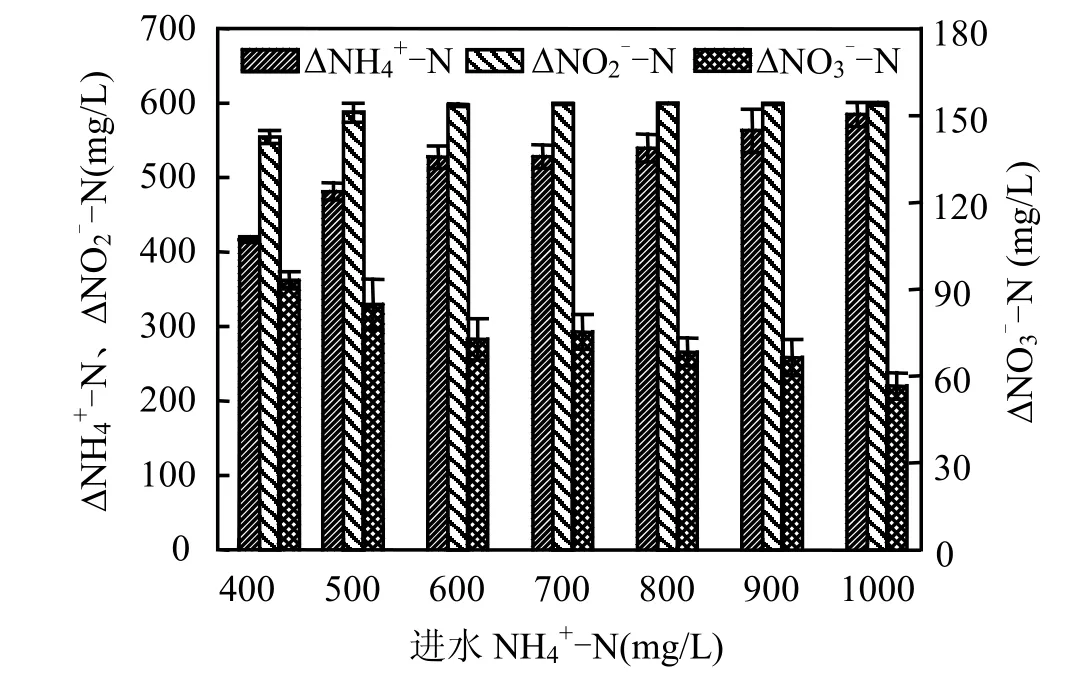
图5 pHase III 期的氨氮、亚硝酸盐去除量和硝酸盐产生量Fig.5 Ammonium and nitrite removal and nitrate production during Phase III
Phase III 期间ESB反应器的化学计量关系如图6所示.在进水亚硝酸盐浓度固定不变的情况下,随着进水 NH4+-N/NO2--N 的增加,氨氮去除量增多,导致反应器去除的NO2--N/NH4+-N之比呈线性递减(R2=0.804);而氨氮去除量增多以及硝酸盐产生量减少则使得反应器产生的NO3--N/NH4+-N 之比呈直线下降(R2=0.919).至进水NH4+-N/NO2--N为1.67时,反应器去除的NO2--N/NH4+-N降低为1.03±0.03,产生的NO3--N/NH4+-N 降低为0.10±0.01,分别是进水 NH4+-N/NO2--N为理论值0.76时的77%和44%.

图6 pHase III 期反应器的化学计量学特性Fig.6 Stoichiometry of the ESB reactor during Phase III
综合Phase I、II和III的情况来看,当反应器的进水氨氮和亚硝酸盐浓度保持一定比例时,反应器的化学计量学关系基本上保持稳定(Phase I,图2);而固定进水氨氮浓度不变,逐步提高亚硝酸盐时,反应器对富余的亚硝酸盐有额外的吸纳能力,反应器去除的NO2--N/NH4+-N增大(Phase II,图3、图 4);固定进水亚硝酸盐浓度不变而逐步提高进水氨氮浓度时,反应器对与富余的氨氮也具有额外的吸纳作用,去除的NO2--N/NH4+-N下降(Phase III, 图5、图6).厌氧氨氧化反应器这种有趣的对富余基质的吸纳现象类似于溶液缓冲体系,哪种基质多,其转化量也多[20].
3 讨论
3.1 厌氧氨氧化工艺化学计量学特性的机理
厌氧氨氧化菌为化能自养型细菌,倍增时间长达11d,细胞产率很低.根据式(1),厌氧氨氧化菌每转化 1g NH4+-N,用于细胞合成的氮素为0.0099g,仅占 0.99%,可见在反应器体系中,厌氧氨氧化菌细胞生长对化学计量关系的影响可忽略不计.
根据厌氧氨氧化反应的化学模型(图7)[19],当反应物氨相对过量时,根据化学平衡的原理,反应①的平衡向生成联氨(N2H4)的方向移动,因此,参与反应的NH4+增多,表现为体系对氨具有额外吸纳的现象,导致氨氮去除的绝对量和相对量均增加;此外,反应①的平衡移动使得参与反应的羟胺(NH2OH)的量也增多,而根据反应④,产物NH2OH减少,会导致反应④的平衡向生成NH2OH的方向移动,亦即体系中参与反应④的反应物NO2-的量增多(体系内总NO2-的量不变),必然导致参与反应⑤的NO2-减少,因此,反应⑤的平衡向反应物方向移动,NO3-的绝对产生量和相对产生量均降低.实验测得硝酸盐产生量减少,与此吻合.当反应物 NO2-增加时,同样根据化学平衡的原理,反应④、⑤的化学平衡均向生成产物的方向移动,具体表现为体系对亚硝酸盐也存在额外吸纳的现象,NO3-的产生量亦随之增加.可见,当反应物浓度增加时,化学平衡的移动是厌氧氨氧化工艺呈现出对剩余基质具有额外吸纳现象的本质原因.

图7 厌氧氨氧化反应模型Fig.7 Metabolic model of anaerobic ammonium oxidation
3.2 厌氧氨氧化工艺化学计量学特性的应用
对于废物生物处理工程的设计,质量平衡(化学计量学)具有指导作用[21].对于一定量的废物,通过化学计量学可确定满足微生物能量、营养和环境需求的反应物量,也可以估算系统中的最终产物量.本研究表明,通过控制厌氧氨氧化反应器的进水基质浓度和基质比例,可获得不同的化学计量关系.对于废水的厌氧氨氧化生物脱氮,从废水处理的角度来说要求出水达标排放,这就要求出水中各污染物浓度最低;另外,由于厌氧氨氧化菌生长缓慢,倍增时间长达11d,细胞产率极低,厌氧氨氧化菌的扩增困难,因此,从厌氧氨氧化菌富集培养的过程来看,则须获取最大的反应物转化速率和厌氧氨氧化菌得率,亦即开发高效厌氧氨氧化工艺[22-23].
根据表1和表2,在进水NO2--N/NH4+-N低于理论值1.32时,出水中的亚硝酸盐浓度和硝酸盐浓度较低,但剩余氨氮浓度偏高,出水中总氮(TN)浓度较高,不易达标排放;在进水NO2--N/NH4+-N高于理论值1.32时,由于反应器不能将亚硝酸盐有效转化,容易导致亚硝酸盐对厌氧氨氧化菌的毒害,造成厌氧氨氧化反应器性能恶化,出水难以达标排放;在进水基质比例为理论值时,反应器出水中各污染物浓度较低,容易实现达标排放.此外,厌氧氨氧化反应器对多余基质的额外吸纳也有助于出水达标排放.
在厌氧氨氧化反应器负荷提升过程中,要获得高效性和稳定性,必须避免亚硝酸盐的毒害[8,22-23].将出水亚硝酸盐浓度维持在较低水平以获得较高的亚硝酸盐去除率是避免亚硝酸盐抑制的重要措施[22].从表 2可知,控制进水中氨氮浓度相对过量(进水 NO2--N/NH4+-N低于1.32 ),亚硝酸盐去除率高达99%,可将出水中的亚硝酸盐浓度维持在很低水平(低于 5mg/L).另外,在进水中氨氮相对过量时,厌氧氨氧化反应器对多余氨氮的额外吸纳作用也可强化反应器的高效性(图5).
4 结论
4.1 厌氧氨氧化的2种反应物(氨和亚硝酸盐)及其比例可影响反应器的化学计量关系.当进水中氨相对过量时,反应器对氨去除的绝对量和相对量都增加;同样,当进水中亚硝酸盐浓度相对过量时,反应器对亚硝酸盐的去除量增加.厌氧氨氧化反应器具有对富余基质的额外吸纳能力,这对出水达标排放以及反应器高效性都有积极作用.
4.2 厌氧氨氧化工艺的化学计量学特性的本质是一种反应物浓度增加导致了化学平衡的移动.
4.3 厌氧氨氧化工艺的化学计量学特性有助于反应器的运行.要保证出水水质达标排放,宜将进水NO2--N/NH4+-N 控制为理论值(1.32);要获得反应器的高效性和稳定性,则宜控制进水NO2--N/NH4+-N低于理论值.可根据不同的需求选取不同的运行方式.
[1]Jetten M S M, Strous M, van de Pas Schoonen K T. The anaerobic oxidation of ammonium [J]. FEMS Microbiol. Rev.,1999,22(5):421-437.
[2]van Dongen U, Jetten M S M, van Loosdrecht M C M. The SHARON®–ANAMMOX®process for treatment of ammonium rich wastewater [J]. Water Sci. Technol., 2001,44(1):153-160.
[3]Jetten M S M, Cirpus I, Kartal B, et al. 1994-2004: 10 years of research on the anaerobic oxidation of ammonium [J]. Biochem.Soc. Tran., 2005,33:119-123.
[4]唐崇俭,郑 平,汪彩华,等.高负荷厌氧氨氧化 EGSB反应器的运行及其颗粒污泥的ECP特性 [J]. 化工学报, 2010,61(3):732-739.
[5]van der Star W R L, Abma W R, Bolmmers D, et al. Startup of reactors for anoxic ammonium oxidation: Experiences from the first full-scale anammox reactor in Rotterdam [J]. Water Res.,2007,41(18):4149-4163.
[6]Strous M, Heijnen J J, Kuenen J G, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms [J]. Appl.Microbiol. Biotechnol., 1998,50:589-596.
[7]Liu S T, Yang F L, Meng F G, et al. Enhanced Anammox consortium activity for nitrogen removal: Impacts of Static Magnetic Field [J]. J. Biotechnol., 2008,138(3/4):96-102.
[8]Strous M, Kuenen J G, Jetten M S M. Key physiology of anaerobic ammonium oxidation [J]. Appl. Environ. Microbiol.,1999,65(7):3248-3250.
[9]Chamchoi N, Nitisoravut S. Anammox enrichment from different conventional sludges [J]. Chemosphere, 2007,66:2225-2232.
[10]唐崇俭,郑 平,陈建伟,等.不同接种物启动 Anammox反应器的性能研究 [J]. 中国环境科学, 2008,28(8):653-658.
[11]Wang J L, Kang J. The characteristics of anaerobic ammonium oxidation (ANAMMOX) by granular sludge from an EGSB reactor [J]. Process Biochem., 2005,40:1973-1978.
[12]Trigo C, Campos J L, Garrido J M, et al. Start-up of the Anammox process in a membrane bioreactor [J]. J. Biotechnol.,2006,126:475-487.
[13]van de Graaf A A, De Bruijn P, Robertson L A, et al. Autotrophic growth of anaerobic ammonium-oxidizing microorganisms in a fluidized bed reactor [J]. Microbiology, 1996,142:2187-2196.
[14]van der Star W R L, Miclea A I, van Dongen U G J M, et al. The membrane bioreactor: A novel tool to grow ANAMMOX bacteria as free cells [J]. Biotechnol. Bioeng., 2008,101(2):286-294.
[15]Tang C J, Zheng P, Mahmood Q, et al. Start-up and inhibition analysis of the Anammox process seeded with anaerobic granular sludge [J]. J. Ind. Microbiol. Biotechnol., 2009,36(8):1093-1100.
[16]唐崇俭,郑 平,陈建伟,等.中试厌氧氨氧化反应器的启动与调控 [J]. 生物工程学报, 2009,25(3):406-412.
[17]国家环境保护总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2002.
[18]Dapena-Mora A, Campos J L, Mosquera-Corral A, et al. Stability of the Anammox process in a gas-lift reactor and a SBR [J]. J.Biotechnol., 2004,110:159-170.
[19]郑 平,胡宝兰,徐向阳.新型生物脱氮理论与技术 [M]. 北京:科学出版社, 2004.
[20]金仁村.自养型生物脱氮反应器性能的研究 [D]. 杭州:浙江大学, 2007:150-151.
[21]Rittmann B E, McCarty P L. Environmental biotechnology:principles and applications [M]. Colambus, OH: McGraw-Hill,2001.
[22]唐崇俭,郑 平,陈建伟,等.基于基质浓度的厌氧氨氧化工艺运行策略 [J]. 化工学报, 2009,60(3):718-725.
[23]Tsushima I, Ogasawara Y, Kindaichi T, et al. Development of high-rate anaerobic ammonium-oxidizing (anammox) biofilm reactors [J]. Water Res., 2007,41(8):1623-1634.

