不同混凝剂对流溪河水源水中藻类去除的对比
李明玉,潘 倩,王丽燕,刘丽娟,任 刚,宋 琳 (1.暨南大学环境工程系,广东 广州 510630;2.广东省高校水土环境毒害性污染物防治与生物修复重点实验室,广东 广州 510630)
目前我国富营养化湖泊超过70%,沿海城市近岸富营养化海域达60%以上,并且其面积和强度均在大幅度增长[1].饮用水源水的富营养化产生的危害甚多,如在城市供水系统中堵塞滤池、穿透滤床、恶化水质、水质异味、堵塞或腐蚀管道等[2].藻类暴发及藻毒素释放,严重影响饮水安全和人体健康.如何高效去除水源水中的藻类污染,保障水质,已经成为人们关注的焦点问题之一.
目前,除藻方法多采用化学预氧化、强化混凝、气浮及使用改性滤料强化过滤等[3-4].采用化学预氧化除藻效果好,但易产生消毒副产物;气浮方法则需要对水厂现有传统工艺进行较大的改造,存在投入高、占地面积大等缺点.混凝沉淀则基于现有的“混凝-沉淀-过滤和消毒”传统工艺,能在不破坏藻细胞的基础上将藻类去除[5],故该法在业界倍受重视.但是,强化混凝除藻效果的优劣,往往受源水水质、水温、混凝剂种类与性能、工艺条件与使用方法等因素影响.因此,为了得到良好的除藻效果,作者针对不同的水源水,选用不同的混凝剂进行优化试验.
流溪河是广州市主要水源地之一,因其受沿岸污水排放的影响以及地处亚热带地区,常年水温偏高,水中藻类污染已成为影响供水水质的重要因素之一.流溪河下游水源水,在春夏多雨季节和秋冬少雨季节水质变化较大.本研究根据流溪河水质变化的主体特征,选用硫酸铝(AS)、聚合氯化铝铁(PFAC)、聚合硫酸铁(PFS)、聚合硫酸铝(PAS)等混凝剂,对夏秋季节流溪河下游水源水进行了混凝除藻处理研究,考察了药剂种类、投加量、pH值和水温等因素对混凝除藻效果的影响,为水厂提供参考数据.
1 实验部分
1.1 材料与仪器
1.1.1 材料 硫酸铝(市售,Al2O3=15.6%,工业级);聚合硫酸铝(自制,Al2O3=7.65%,盐基度68%);聚合氯化铝铁(PFAC自制,Al2O3=10%,Fe2O3=1%);聚合硫酸铁(自制,Fe=11%,盐基度12%);Lugol溶液.
1.1.2 仪器 ZR4-6型混凝搅拌机(深圳市中润水工业技术发展有限公司);HACH2100N浊度仪(美国哈希公司);CX31 奥林巴斯光学显微镜,BX61奥林巴斯荧光显微镜(日本奥林巴斯公司);pH计(上海精密科学仪器有限公司).
1.2 含藻水源水
试验用源水取自广州流溪河下游(珠江西航道),取样时间为2009年8~11月份.源水的pH值在7.1~7.8,浊度在27~38NTU之间,藻细胞总量在1.14×107~4.10×107个/L 之间.实验期间水体外观显淡绿色,光学显微镜观察,水中藻类较丰富,优势藻为直链藻、小球藻,约占80%;此外,还有盘星藻、十字藻、栅藻等.
1.3 实验方法
分别取1L水样,置于6个容积为1L的搅拌杯中,同时加入一定量混凝剂,以280,150,80,50r/min转速,分别搅拌1.5,1.0,2.0,3.0min,静置沉降10min,于液面下2cm处,取上层清液测定浊度和藻含量.
1.4 测定方法
1.4.1 浊度的测定采用STZ-A24光电式浊度仪,测定源水浊度和处理后上清液水样中的剩余浊度,重复3次,取平均值,误差在2%以内.
1.4.2 藻总量的测定取500mL水样加入7.5mL Lugol溶液固定,置于避光处沉降24h后,去掉上清液,余下沉淀物约50mL,转入50mL比色管中,定容.然后,吸取 0.1mL样品注入藻类计数框中,用奥林巴斯CX31型显微镜在10×10倍镜下计数,重复2次,取平均值.
1.4.3 藻细胞光学显微拍照 将混凝沉淀后产生的含藻絮体放置于玻片上,在 BX61奥林巴斯显微镜下观察含藻絮体结构并于不同的倍镜下拍照.
2 结果与讨论
2.1 不同药剂及投加量对混凝效果的影响
图1和图2分别是在水温25℃,pH7.3,浊度为21~23NTU下,AS、PAS、PFAC和PFS 4种混凝剂在不同投加量(铝盐以Al2O3计;铁盐以Fe计)下的去浊除藻率的变化曲线.
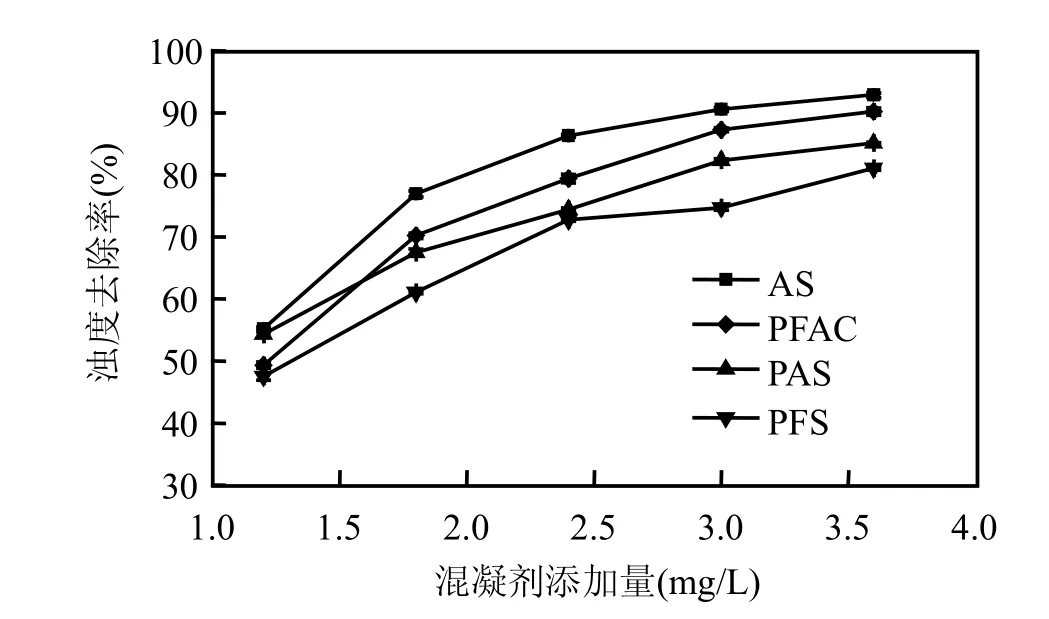
图1 不同混凝剂的投加量与去浊率之间的关系曲线Fig.1 Effect of typical coagulants dosages on turbidity removal rate
由图1可看出,随着4种混凝剂投加量的增加,其去浊率均呈上升的趋势;在相同药剂投加量下,AS的混凝去浊效果优于其他3种混凝剂.另外,在混凝过程中可观察到,AS和PFAC在混凝过程中形成的矾花大,且沉降速度相对较快,而PAS和PFS形成的矾花小,沉降速度也相对较慢.4种混凝剂的混凝去浊效果的优劣顺序依次为AS>PFAC>PAS>PFS.

图2 不同混凝剂的投加量与除藻率之间的关系曲线Fig.2 Effect of typical coagulants dosages on algae removal rate
由图2可知,藻去除率随着混凝剂投加量的增加,呈不断上升的趋势,AS的除藻效果最好,PFS的除藻效果最差.该结果与浊度去除率相关性很好.比较图1和图2知,4种混凝剂的去浊率都明显高于其除藻率.以混凝效果最佳的As为例,当其投加量为3.6mg/L时,除藻率为84%,而去浊率已达到93%左右.可见,混凝去除水中藻类,比去除水中其他悬浮物或胶体颗粒难.因为藻细胞表面ξ电位多在-40mV以上,比水中普通颗粒物带有更高的负电荷,因此,对藻细胞进行静电中和及压缩双电层而达到脱稳状态时,需要投加更多的药剂.
在本实验中,当AS投加量增加到3.0mg/L后,除藻率便趋于平缓,基本维持在85%以下.通过显微镜观察,在高投加量下,优势藻直链藻几乎全被去除,而小球藻则较难去除.小球藻细胞直径较小,比表面积较大,表面所带的负电荷量也较大[7],这应是导致其较难去除的原因之一.
实际上,因水质不同,无论是去除浊度,还是去除藻类,相同的混凝剂有时会表现不同的混凝效果.以秋季广东某含藻湖水为混凝除藻对象时,发现聚合氯化铝(PAC)混凝除藻去浊效果最好,其次是 PFAC、PFS、PAS和AS,其中As的效果最差[6].当以高岭土模拟水样为混凝处理对象时,PFAC的混凝去浊效果最好,其次是PFS、PAS和AS.针对流溪河水源水的混凝除藻去浊处理,AS的混凝效果最佳,而PFS的混凝效果最差.由此可见,对于同一种混凝剂,由于处理的水质不同,混凝条件不同,产生的效果也不尽相同.在使用混凝剂或处理不同的水源水时,应根据实际情况选择合适的混凝剂.
2.2 pH值对混凝效果的影响
在混凝反应中,水体的pH值是影响藻类和浊度去除效果的重要因素.它对胶体颗粒的Zeta电位、混凝剂的性能等有较大的影响,不同的混凝剂有其最佳混凝pH值区域[8].用盐酸和氢氧化钠溶液调节原水的pH值分别为5.0,6.0,7.0,8.0,9.0,几种混凝剂的投加量均为3.0mg/L,结果见图3和图4.
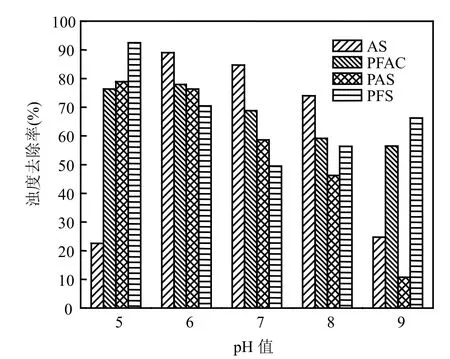
图3 不同混凝剂的去浊率与pH值之间的关系曲线Fig.3 Effect of typical coagulants on turbidity removal rate at different pH
由图3可知,对AS而言,在pH值为6~8范围内,其对浊度的去除率在74%~89%之间,而在pH值为5或pH值为9的条件下,其混凝去除浊度的效果不佳,去除率仅为20%.相比而言,PFS的混凝效果随pH值的变化情况则恰好相反,经多次重复试验,在pH值为7时其混凝去浊效果最差,仅为50%,而在pH≤6和pH值为9时,其去浊率较高,如pH5时可达93%;PFAC对流溪河水质的pH适应范围相对较宽,在整个pH值为5~9的区间内,随pH值的递增,呈现逐渐降低的变化趋势,但变化幅度较小;PAS则随pH值在5~9范围内递增,其去浊率快速下降,波动幅度较大,从pH值为5时的去浊率为78.9%,降至pH值为9时的10.7%.
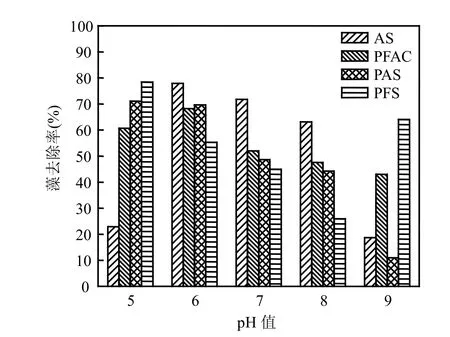
图4 不同混凝剂的除藻率与pH值之间的关系曲线Fig.4 Effect of typical coagulants on alga
图4是除藻与pH值之间的关系曲线,其变化趋势基本与图3相似.在少雨季节,广州流溪河水的pH值基本维持在7~8之间,此时,混凝剂的去浊和除藻效果优劣依次为:AS>PFAC>PAS>PFS;而在春季多雨时,因受酸雨影响,流溪河水的pH值较低,当pH≤5时,AS不适宜作为去浊除藻的混凝剂,可考虑使用PFS和PAS.
针对流溪河水源水的混凝处理而言,混凝剂的最佳pH值适用范围,与文献中报道的数据并不完全一致.其主要原因在于所选用的待处理水质不同.无机混凝剂的最佳pH值适用范围,不仅与混凝剂本身的理化特性有关,而且也与待处理水的水质有关.因此,在实际的水处理工作中,应针对不同水质和药剂,对其最佳pH值适用范围进行优化选择.
2.3 温度对混凝效果的影响
分别调节原水温度为5,10,15,20,30℃,由图5和图 6可知,浊度去除率和藻去除率随温度的变化趋势呈正相关,其中AS、PFAC和PFS的除藻率和除浊率均随着温度的升高而升高,但PAS却出现反常,其除藻率和除浊率却随着温度的升高呈下降趋势.当水温为5℃时,PAS的去浊率和除藻率分别达到了79.8%和70.4%,均高于其他3种混凝剂;而当水温逐渐升高至 30℃时,其混凝效果却逐渐下降,除藻率只有60%左右.在 30℃时,AS、PFAC和PFS的去浊率分别为88.89%、88.50%和69.97,除藻率分别为79.45%、76.34%和63.21%,均比低温时高.

图5 温度对不同混凝剂除浊率的影响Fig.5 Effect of various temperatures on turbidity removal rate

图6 温度对不同混凝剂除藻率的影响Fig.6 Effect of various temperatures on algae removal rate
因水的温度影响无机混凝剂的水解反应速度和水的密度,所以水温的高低往往成为影响水处理混凝效果的重要影响因素.一般情况下,水温较低时,无机混凝剂的水解速度较慢,水的密度较大,这导致在低水温时絮凝反应速度慢、矾花小、沉淀慢、混凝效果差;反之,水温较高时,混凝效果好.这一规律,可以较好地解释AS、PFAC和PFS的除藻率和除浊率与水温之间的关系.对于 PAS而言,与其他混凝剂相比,最大的不同就在于其触水后迅速水解的特点,甚至在对高浓度的PAS溶液进行稀释时,也可引起其水解沉淀,从而降低其混凝效果.当将PAS加入到较高水温的水中后,进一步加快了其水解速度,以至于在 PAS尚未完全扩散到待处理的整个水体中时,PAS已完成水解过程并转化为氢氧化铝,这使待处理的原水中的部分颗粒物表面的负电荷不能被静电中和,从而影响其后续的凝聚和絮凝,并最终影响到混凝效果.因PAS的这一特性,使其在处理常温和较高温水时,与其他混凝剂相比,往往不具有混凝优势.但是,在处理低温水时,因低水温并不能显著抑制PAS的水解反应,使其快速的水解和絮凝反应速度得以体现,从而表出现相对较好的混凝效果.因此,PAS更适宜于在低温水的混凝处理中应用.
广州流溪河地处亚热带,其水温度常年偏高,绝大部分的时间水温均高于15℃,一般情况下应考虑选用AS或PFAC.
2.4 水体的Zeta电位与絮体显微相片分析
2.4.1 Zeta电位分析水藻类种群众多,藻体的形态、数量、ζ电位以及细胞外泄物等对水体中藻类的去除都有影响[9].水中的藻类细胞与其他胶体颗粒一样,是带负电的.它们之所以能在水中稳定存在而不聚沉,原因在于藻细胞之间以及藻细胞与其他胶体颗粒之间的静电斥力、胶粒表面的水化作用及胶粒之间范德华引力共同作用的结果[10].Zeta电位是胶体或悬浮物质稳定性的重要标志[11].若向水中投加正电荷的混凝剂,形成许多带正电的铝或铁的水解聚合阳离子,它们通过吸附电性中和、压缩双电层等作用[12-13],使滑动面上Zeta电位降低.一旦Zeta电位减少到一定程度或完全消失,即等电状态时,藻类胶体就会凝聚下沉.对于无机混凝剂,颗粒间架桥能力相对较弱,其混凝能力主要取决于使胶体或悬浮颗粒脱稳程度,而这一过程中起主要作用是吸附电性中和和压缩双电层.因而,可以通过测定Zeta电位的变化,考察几种混凝剂的混凝除藻效果.由图7可知,随着混凝剂投加量的增加,水中胶体颗粒的Zata电位由带负电逐渐上升到达等电点,之后又反转为带正电.一般情况下,当胶体颗粒的Zeta电位达到或接近零时,胶体颗粒可以获得最佳的絮凝沉降效果.到达等电点时所需的4种混凝剂的投加量分别为AS 12mg/L,PFAC 15mg/L,PAS 17.5mg/L,PFS 30mg/L.可见,针对流溪河水源水,AS在混凝剂投加量最小的情况下达到等电点,所以其静电中和能力最强,混凝去浊和除藻效果也最佳.
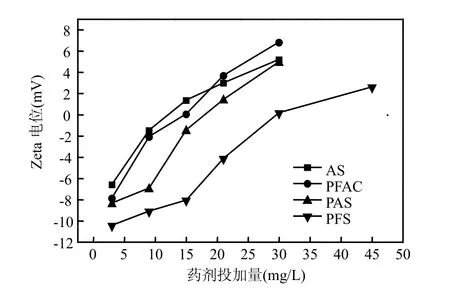
图7 混凝剂不同投加量的Zeta电位Fig.7 Zata potential changes under different dosage of coagulants
一般情况下.无机高分子混凝剂(PFAC、PAS和PFS)比低分子的无机混凝剂As有更好混凝性能.但是,在对流溪河水的混凝处理研究中,AS作为一种小分子的无机混凝剂,却表现出了比无机高分子混凝剂更加优良的混凝效果与电中和能力.可见,水处理混凝效果的优劣,并不完全取决于混凝剂的理化特性,还需要综合考虑待处理水的水质特性,只有通过优化比选,才能确定最适宜的混凝剂种类.
2.4.2 混凝沉淀中絮体显微拍照分析 图 8是4种混凝剂在经混凝沉淀 10min后,取其絮凝物进行显微拍照分析的结果.
根据对混凝实验现象和图 8显微照片的观察可知,投加4种混凝剂后,絮凝体的形成过程有很大的区别.在混凝搅拌初期,PFS最先出现细小絮体.混凝搅拌中期,随搅拌过程的进行,AS和PFAC的絮体逐渐长大,且明显大于PFS的絮体.混凝搅拌后期,AS所形成的絮体最大且密实,结构越密实,絮体间的斥力就越小,引力越大,结合点越多[14],水的透明度最高,沉淀后表现出最好的去浊效果;PFAC形成的絮体也较大,但明显可看出絮体中空隙大且不密实,沉降效果较As差;PFS所形成的絮体虽密实但体积小,沉降后剩余浊度较高;PAS形成的絮凝体和沉降效果,介于PFAC与PFS之间.

图8 藻类和絮凝体中藻类的显微照片Fig.8 Optical micrographs of algae cell morphology
另外,由图8a可看出,AS形成的絮体中吸附的藻细胞量最多且絮体密度较大,这与其静电中和能力最强及吸附的带高负电的藻细胞多和结合点位多有关.而由图8d可看出,PFS形成的絮体最小,絮体中所吸附的藻细胞量最低.
3 结论
3.1 针对流溪河下游水源水,4种混凝剂的混凝去浊和除藻效果都随着药剂投量的增加而增强.4种药剂的混凝性能优劣依次为:AS>PFAC>PAS>PFS.
3.2 PFAC在pH值为5~9范围内,表现出较好的混凝效果;AS的最佳pH值适用范围为6~8.针对少雨季节的流溪河下游原水pH7~8,选用As为混凝剂最为适宜.
3.3 As、PFAC和PFS的混凝去浊和除藻效果,均随着水体温度的升高而增强;但PAS的混凝效果却随着水体温度的升高呈下降趋势,因此,只有在冬季水温较低时,可考虑采用PAS作为混凝剂.
3.4 与其他3种混凝剂相比,AS在投加量为12mg/L时就能达到等电点,投药量最低,其静电中和能力最强,混凝去浊除藻效果最佳.
[1]王 芳,朱广伟,许 海,等.太湖梅梁湾水体中胶体对铜绿微囊藻生长的促进效应 [J]. 中国环境科学, 2009,29(5):538-542.
[2]Jiang J Q, Kim C G. Comparison of algal removal by coagulation with clays and Al-based coagulants [J]. Water Research, 2005,39(18):4420-4428.
[3]Montiel A, Welte B. Preozonation coupled with flotation filtration: successful removal of algae [J]. Water Science and Technology, 1998,37(2):65-73.
[4]王金丽,梁文艳,马炎炎,等.Ti/RuO2电氧化法降解藻毒素MCLR影响因素的研究 [J]. 中国环境科学, 2008,28(8):709-713.
[5]彭海清,谭章荣,高乃云,等.给水处理中藻类的去除 [J]. 中国给水排水, 2002,18(2):29-31.
[6]汪 琳,李明玉,刘丽娟,等.不同混凝剂对湖水中藻类强化混凝去除的研究 [J]. 中国给水排水, 2010,26(5):80-83.
[7]孟红旗.聚合氯化铝铁的性质和除藻应用研究 [D]. 武汉:武汉科技大学, 2004.
[8]徐国想,阮复昌.铁系和铝系无机絮凝剂的性能分析 [J]. 重庆环境科学, 2001,23(3):52-55.
[9]Henderson R K, Parsons S A, Jefferson B. The impact of algal properties and pre-oxidation on solid Cliquid separation of algae[J]. Water Research, 2008,42(8/9):1827-1845.
[10]刘振濡,赵容禄,斐建文.Al和Fe共聚合及其混凝效果的研究[J]. 环境科学学报, 1995,15(1):18-20
[11]Henderson R K, Parsons S A, Jefferson B. Successful removal of algae through the control of Zeta potential [J]. Separation Science and Technology, 2008,43(7):1653-1666
[12]王绍文.水和废水技术研究 [M]. 北京:中国建筑工业出版社,1992:156
[13]Jiang J Q, Nigel J D G. Removal of algae and air halomethane(THM) precursors by coagulation [J]. Water Treatment, 1992,7:155-168.
[14]Li T, Zhu Z, Wang D S, et al. The strength and fractal dimensioncharacteristics of alum-kaolin flocs [J]. Mineral Processing, 2007,82:23-29.

