酸浸法提取煤矸石中氧化铝的动力学分析
周朋朋,舒新前,何 菂,
(中国矿业大学(北京)化学与环境工程学院,北京 100083)
酸浸法提取煤矸石中氧化铝的动力学分析
周朋朋,舒新前,何 菂,
(中国矿业大学(北京)化学与环境工程学院,北京 100083)
本文以煤矸石、某浓度硫酸为原料,对硫酸浸取煤矸石中的Al2O3反应动力学进行了研究。酸浸法提取煤矸石中的Al2O3是一个液—固非催化反应过程,对反应过程的动力学模型进行预测、验证,结果表明该反应过程符合未反应收缩芯模型。在该模型基础上通过控制化学反应的条件,建立反应动力学方程。
煤矸石;Al2O3;未反应收缩芯;动力学方程
1 前言
煤矸石是煤炭开采和洗选过程中产生的固体废物,我国每年产生大量煤矸石,据统计,我国现有煤矸石山1 500余座,约40亿t[1-2]。目前,我国煤矸石的利用率仅有43%,距离75%的目标还有很长的路要走[3]。煤矸石大量堆积,不仅对生态环境造成危害,而且造成严重的资源浪费。
据研究,煤矸石中通常含有50%~60%的SiO2,20%~35%的Al2O3,0.6%~8%的Fe2O3。而我国因为Al2O3、Fe2O3资源短缺,每年需要进口大量的铝土矿、铁矿石等资源,通过有效途径提取煤矸石中Al2O3、Fe2O3成分具有很重要的现实意义。
目前,国内外利用煤矸石提取氧化铝的工艺研究主要集中在碱熔法和酸浸法。其中碱熔法开展的研究较多,但此法有高能耗、高碱耗、高成本、生产工艺繁琐和产生废渣量大等缺点,为此,本研究采用酸浸法直接浸取煤矸石中的Al2O3。
通过酸浸法提取煤矸石中氧化铝,化学反应过程较为复杂,从动力学角度揭示其反应规律,可以为选择合适的操作条件提高氧化铝的浸出率,同时为下一步设计酸浸反应器提供科学依据,对有效利用煤矸石资源具有重要意义。
2 试验结果和讨论
2.1 样品
本试验选用山西霍州矿区三交河矿煤矸石。煤矸石样品化学成分分析结果为(%):SiO243.438,Al2O326.869,Fe2O34.239,CaO 1.961,MgO 0.444,TiO20.086,LOI 22.047。
利用X-射线衍射仪进行了煤矸石的XRD分析(见图1),主要矿物有高岭石、石英、多水高岭石、方解石等。

2.2 试剂和试验器材
试验所用器材和试剂主要有:油浴恒温器、带冷凝回流装置的石英反应器、抽滤装置、硫酸等。
2.3 试验流程
首先将煤矸石样品进行烘干、研磨处理,浸取试验的温度由油浴恒温器进行调节,将样品放入带有回流冷凝装置的反应器中并加入一定量的硫酸,反应进行一定时间之后,加入一定量的去离子水水煮30min,随后进行固液分离,采用络合滴定法分析浸出的Al3+含量。试验流程见图2。

试验过程中产生的滤渣主要富含氧化硅并伴有少量的氧化铝、氧化铁等杂质,利用碱熔法提取其中的二氧化硅;固液分离后的滤液富含硫酸铝、硫酸铁、硫酸钙等硫酸盐,加入氢氧化物利用其生成氢氧化物沉淀pH区间值不同进行除杂,并将沉淀分离,可以有效的提取氧化硅、氧化铝、氧化铁、氧化钙、氧化镁等。
2.4 反应模型的选择
在硫酸浸取煤矸石中氧化铝的过程中,主要的化学反应是:Al2O3+3H2SO4=Al2(SO4)3+3H2O。该反应可以认为是在煤矸石的固体表面开始并且逐渐深入到矿物内层的液—固非催化反应。
液—固非催化反应较为常见的模型有收缩未反应芯模型,该模型按照固相粒径在反应过程的变化分为粒径不变收缩芯模型和粒径缩小收缩芯模型。粒径缩小收缩芯模型的反应特点是在化学反应过程中没有固相层的产生。粒径缩小收缩芯模型按照化学反应过程对反应起主导作用的因素不同又分为:化学反应控制粒径缩小收缩芯模型、流体膜扩散控制粒径收缩芯模型。
其中化学反应控制粒径收缩芯反应模型的动力学方程表达式为[4-6]:

其中流体膜扩散控制粒径收缩芯模型的动力学方程表达式为:

上述两式中XB为反应物转化率,t为反应时间,tf为完全反应时间。
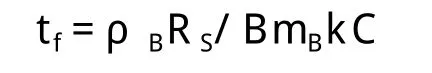
式中:ρB为固体反应物密度;RS为固体颗粒初始反应半径;B为固体反应物计量系数;mB为固体反应物分子量;k为反应速率常数;C为液体反应物的浓度。
对于一个固定的固—液相反应t f可以近似的认为是一常量,因此上述的表达式可以写作:

煤矸石和硫酸反应过程中有如下特点:煤矸石结构致密,硫酸和氧化铝的反应只能在煤矸石的表面进行,反应过程中伴随着水分的产生,生成的硫酸铝晶体伴随着生成的水分很快离开反应界面。所以可以用粒径缩小收缩芯模型来描述反应过程。在试验过程中发现在温度大于90℃时,煤矸石的溶出率有明显的加快,在温度小于90℃时,煤矸石的溶出率较小。这是由于在温度较低的情况下,煤矸石和硫酸反应速度较慢,而反应速度的快慢取决于生成的硫酸铝离开反应界面的速度,即反应速度由液膜扩散控制。当温度较高时,硫酸和煤矸石的反应较为剧烈并伴随着爆沸的产生,此时产物能比较容易的离开反应界面,相应的化学反应则成为反应快慢的主导。
由上面的分析,进行如下的预测:温度大于90℃时,反应的动力学模型为化学反应控制的粒径缩小收缩芯模型;当温度小于90℃时,反应的动力学模型为膜扩散控制的粒径缩小收缩芯模型。
2.5 酸浸取反应的条件控制
取预先磨制好的煤矸石样品1g和15mL的硫酸混合,将其放入到带冷凝回流装置的反应器中,采用40、60、80、90、100、110、120℃不同温度段进行加热反应。每个温度段采用30、60、90、120min不同的加热时间。试验结束之后,分析煤矸石样品中氧化铝的溶出率,见下表。

煤矸石在不同温度、时间的酸浸环境下Al2O3的溶出率
2.6 动力学模型的验证
动力学模型验证的基本思路是:如果硫酸浸取煤矸石中氧化铝的反应是按照先前假设的动力学模型进行的,即40、60、80℃三个温度段不同时间内Al2O3的溶出率的动力学方程是:1-(1-XB)2/3=kt;100、110、120℃三个温度段不同时间内Al2O3的溶出率的动力学方程:1-(1-XB)1/3=kt。1-(1-XB)2/3、1-(1-XB)1/3分别与t成线性关系,此关系反映在图形上是一系列直线。
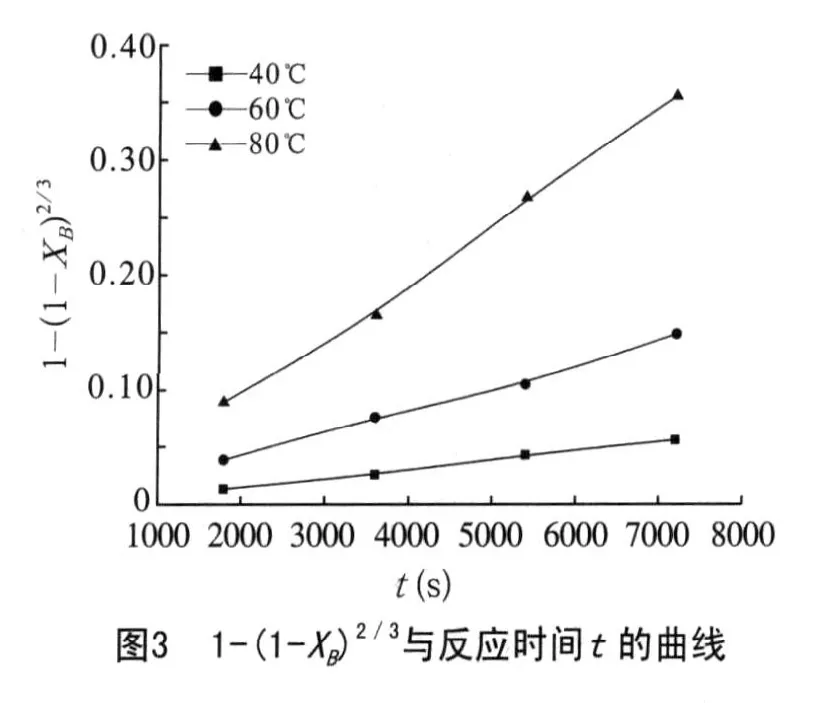
按照预先的推测,将煤矸石在40、60、80℃三个温度段不同时间内Al2O3的溶出率按照膜扩散控制的粒径缩小收缩芯模型的动力学方程:1-(1-XB)2/3=kt进行数据处理,并且作1-(1-XB)2/3与反应时间t的曲线,见图3。
同样按照预先预测,将煤矸石在100、110、120℃三个温度段不同时间内Al2O3的溶出率按照化学反应控制的粒径缩小收缩芯模型的动力学方程:1-(1-XB)1/3=kt进行数据处理,并且作1-(1-XB)1/3与反应时间t的曲线,见图4。

从图3、图4可以看出:
(1) 40、60、80℃三个温度段不同时间内Al2O3的溶出率按照膜扩散控制的粒径缩小收缩芯模型的动力学方程:1-(1-XB)2/3=kt进行数据处理后,1-(1-XB)2/3与反应时间t的曲线成较大的线性关系,而且随着温度的增加这种线性关系变得越来越不正规,这是由于随着温度的升高,动力学模型由膜扩散控制变为化学反应控制。
(2) 100、110、120℃三个温度段不同时间内Al2O3的溶出率按照化学反应控制的粒径缩小收缩芯模型的动力学方程:1-(1-XB)1/3=kt进行数据处理后,1-(1-XB)1/3与反应时间t的曲线成较大的线性关系,而且随着温度的增加这种线性关系变得越来越正规,这也是由于随着温度的升高,动力学模型由膜扩散控制变为化学反应控制所造成。
2.7 化学反应活化能
利用最小二乘数法求出图3、图4中每个直线的斜率即不同温度环境下的反应速度常数k,40、60、80、100、110、120℃下的k分别为:-11.83、-10.81、-10.91、-9.93、-9.66、-9.39。
利用阿雷尼乌斯公式[7]:
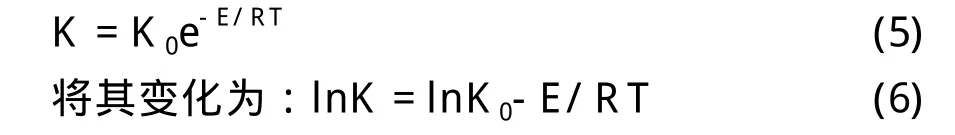
将由图3、图4求出的直线斜率K、作lnK和1/T关系图。40、60、80℃温度下lnK和1/T的关系见图5,100、110、120℃温度下lnK和1/T的关系见图6。
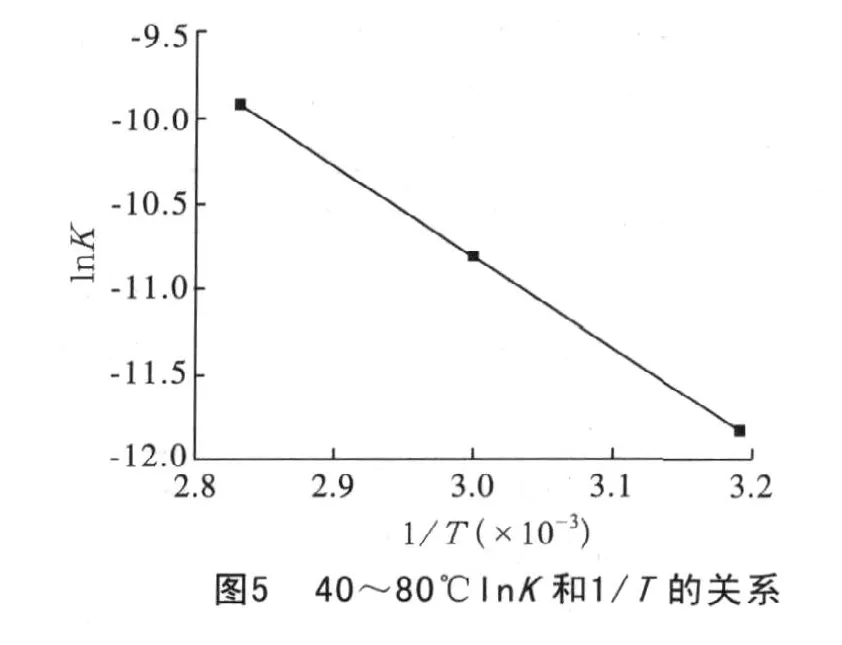

利用最小二乘数法求得上述两曲线的斜率和截距,即可求得K0和E。40、60、80℃温度下的K0和E分别是:159.6、4.4×103kJ/mol。100、110、120℃温度下的K0和E分别是:2.02、3.3×103kJ/mol。
3 结论
(1) 硫酸浸取煤矸石中氧化铝的化学反应符合粒径缩小收缩反应芯模型。只是在温度低于90℃时液膜扩散起主导作用,温度高于90℃时化学反应起主导作用。
(2) 温度低于90℃时该反应的动力学方程是:1-(1-XB)2/3=kt;温度高于90℃时该反应的动力学方程是:1-(1-XB)1/3=kt。
(3) 温度低于90℃时反应的K0和E分别是:159.6、4.4×103kJ/mol,温度高于90℃时反应的K0和E分别是:2.02、3.3×103kJ/mol。
[1]张萍平,孙传敏.我国煤矸石的综合利用现状及存在问题[J].国土资源科技管理,2004,(6):95-98.
[2]左鹏飞.煤矸石的综合利用方法[J].煤炭技术,2009,(1):186-189.
[3]韩红光,刘海龙,崔莉.煤矸石资源化利用关键问题分析[J].科技情报开发与经济,2007,(34):275-576.
[4]孙康.宏观动力学及其解析方法[M].北京:冶金工业出版社,1998.
[5]朱炳晨.化学反应工程[M].北京:化学工业出版社,1993.
[6]EDWARD O. Kietic study of the titanium dioxide in red mud:a kinetic study[J].Hydrometallurgy,1999,53:81-86.
[7]天津大学教研组.物理化学[M].北京:高教出版社,2000.
Dynamic Analysis on the Alumina in Coal Gangue With the Extraction Method of Acid Leaching
ZHOU Peng-peng, SHU Xin-qian, HE Di
(School of Chemical and Environmental Engineering, China University of Mining & Technology(Beijing),Beijing 100083, China)
Basing on coal gangue and sulfuric acid with some concentration as raw material, the study focus on the kinetic reaction on Al2O3in coal gangue with the extraction method of acid leaching, which is the a liquid-solid uncatalyzed reaction process, and the key point of which is dynamic model, which will has been forecasted and validated through the study, and the results of which show that this course of reaction corresponds with the model of reaction on without shrinking core, basing on which the study could establish kinetic equation by controlling the chemical reaction conditions.
coal gangue; Al2O3; reaction on without shrinking core; kinetic equation
TD984
A
1007-9386(2010)05-0040-03
2010-07-30

