超细NiO的制备及表征
王学彩,冯 颖
(1.河南煤化永煤碳纤维有限公司,河南 商丘 476000;2.中国神马集团有限责任公司,河南 平顶山 467000)
超细NiO的制备及表征
王学彩1,冯 颖2
(1.河南煤化永煤碳纤维有限公司,河南 商丘 476000;2.中国神马集团有限责任公司,河南 平顶山 467000)
以Ni(NO3)2·6H2O为原料,用KNO3-NaNO3混合熔盐法制备了超细NiO微粒。研究了不同焙烧温度及同一温度下采用不同原料配比对NiO微晶晶化过程的影响。用XRD、SEM对样品进行了表征。结果表明,混合熔盐法能制备出平均粒径为0.60μm的NiO微粒,以小颗粒立方晶粒为主要形态,晶形发育完好。
NiO;混合硝酸盐熔盐法;制备;表征
氧化镍是一种重要的金属氧化物,作为功能材料被广泛应用于催化剂、气体传感器、电池电极、电化学电容器、光电转化材料、磁性材料、陶瓷添加剂与玻璃染色剂等方面[1-5]。常见制备方法有沉淀法,微乳液法,水热法,Sol-gel法,有机配合物前驱体法,高分子网络絮凝法等[6-9]。虽然各种方法均可以得到理想的微细粉体,但普遍存在起始原料价格昂贵、过程复杂或反应条件要求苛刻等缺陷,难以工业化。WANG Y P等[10]用固相法Ni(OAc)2·4H2O和NaOH为原料合成了纳米氧化镍粉体,其他研究者[11-12]以Ni(OH)2或NiC2O4为前驱物,经固相反应得到6~30nmNiO微粒,但采用KNO3-NaNO3混合熔盐法进行固相反应制备NiO微晶还未见文献报道。本文采用KNO3-NaNO3混合熔盐法合成出晶体粒径小、发育完好的微晶NiO。并对产物结构、形貌进行了表征,探讨了混合熔盐法制备微晶NiO的反应条件及机理,以及熔盐条件和温度对晶体发育的影响。
熔盐反应分解硝酸盐是制备微细氧化物粉体的一种有效方法,本试验希望通过混合熔盐反应,使硝酸镍晶体受热分解,快速制备微细氧化镍。但是,硝酸镍通常含有6个结晶水,其熔点56.7℃,沸点136.7℃。相关资料记载[13],六水硝酸镍升温至110℃会溶于结晶水,在136.7℃沸腾,直接脱水分解则无法得到组成稳定、粒度均匀的氧化镍晶粒,与不含结晶水的硝酸镍差别较大。因而,通常情况下需要预先在惰性气氛中脱除结晶水再进行热分解。由于等摩尔的KNO3、NaNO3混合盐的熔点为225℃,本试验向六水硝酸镍中添加等摩尔的KNO3、NaNO3混合盐,避开脱水工序,直接进行熔盐反应制备微晶氧化镍。
1 试验部分
1.1 试剂与仪器
试验药品KNO3、NaNO3、Ni(NO3)2·6H2O和无水乙醇,均为分析纯,成都科龙化工试剂厂;日本理学D/MAX-C型X-射线粉晶衍射仪,Cu靶,管电压40kV,管电流 30mA;日本日立(HITACH)S530型扫描电子显微镜。
1.2 焙烧温度条件确定
(1) 为得到摩尔比Ni(NO3)2·6H2O∶KNO3∶NaNO3=1∶1∶1的混合物,先分别称量KNO37g、NaNO36g,均匀混合后放入烘箱,130℃烘干8h。按相同方法,制备混合硝酸盐4份。
(2) 称取4份Ni(NO3)2·6H2O,每份20g,分别混入上述烘干的硝酸盐中,反复研磨30min,使之充分混合。
(3) 把研磨好的混合物转入刚玉坩埚,置于马弗炉中,分别在250、300、350、400℃焙烧2h。
(4) 向焙烧样品中加入适量蒸馏水,在电炉上加热溶解,观察250、300、350℃焙烧的样品溶液的颜色为绿色,说明在250、300、350℃焙烧的Ni(NO3)2·6H2O混合盐没有完全分解;而400℃焙烧的样品溶液不显绿色,同时溶液底部有黑色沉淀出现,说明Ni(NO3)2·6H2O已完全分解,生成了黑色的NiO。由此可以确定Ni(NO3)2·6H2O的最低分解温度为350~400℃。于是,选定试验的焙烧温度条件在400℃以上。
1.3 超细NiO粉体的制备
(1) 按摩尔比Ni(NO3)2·6H2O∶KNO3∶NaNO3=1∶1∶1的比例,先分别称取KNO37g、NaNO36g,均匀混合,放入烘箱中在130℃烘干8h,再加入Ni(NO3)2·6H2O粉体20g,配成混合盐S1,按同样方法制备等量混合盐S2。
(2) 按摩尔比Ni(NO3)2·6H2O∶KNO3∶NaNO3=1∶5∶5的比例,先分别称取KNO335g、NaNO330g,均匀混合,放入烘箱中在130℃烘干8h,再加入Ni(NO3)2·6H2O粉体20g,配成混合盐S3。
分别将上述混合盐S1、S2、S3充分混合、研磨,S1、S3在400℃焙烧2h分别得到样品S1-1和S3-3;S2在600℃焙烧2h得到样品S2-2。3个样品均为固体粉末,其中S1-1 、S3-3为黑色, S2-2为浅绿色。
(3) 为了进行比较,分别在400、600℃条件下焙烧20g Ni(NO3)2·6H2O样品各一份,记为T400、T600。
(4) 向各焙烧样品中加入少量蒸馏水,加热溶解、洗涤,在5 000r/min下进行离心,除去上清液,用蒸馏水反复洗涤沉淀物,重复3次,再用无水乙醇洗涤3次,冷冻干燥,得到目标样品NiO。
各样品参数见表1。
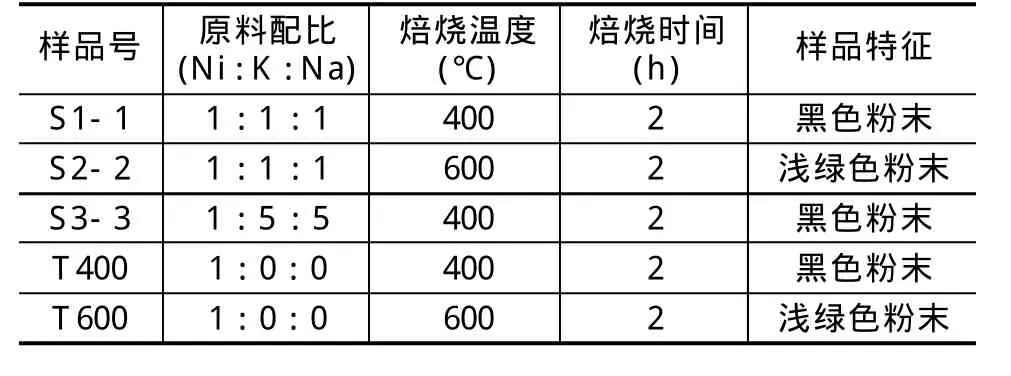
表1 样品参数
2 结果与讨论
2.1 X-射线衍射分析
图1、图2分别是样品S1-1和T400的XRD图谱。
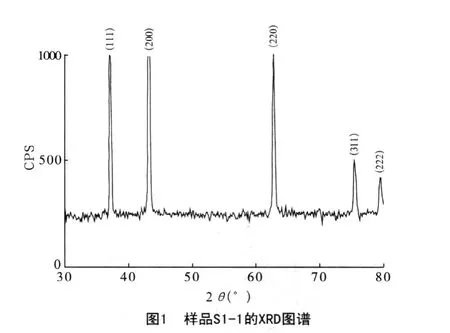
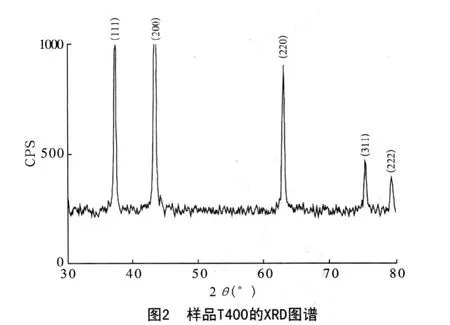
样品S1-1和T400与NiO的JCPDS标准卡片43-1002对照数据见表2。结合两样品的XRD图谱和表2可知,样品衍射峰同JCPDS标准卡片的衍射峰数据符合,未发现其他杂质衍射峰,说明所制备的目标样品为NiO,而且纯度很高。样品S1-1的衍射峰比样品T400更显尖锐,说明前者晶体发育更充分,在400℃焙烧2h条件下,混合熔盐反应比纯Ni(NO3)2·6H2O直接分解更有利于晶体生长,反应要求温度更低。通过Scherrer公式计算,两样品NiO颗粒的平均晶粒尺寸分别为0.57μm 和0.21μm。
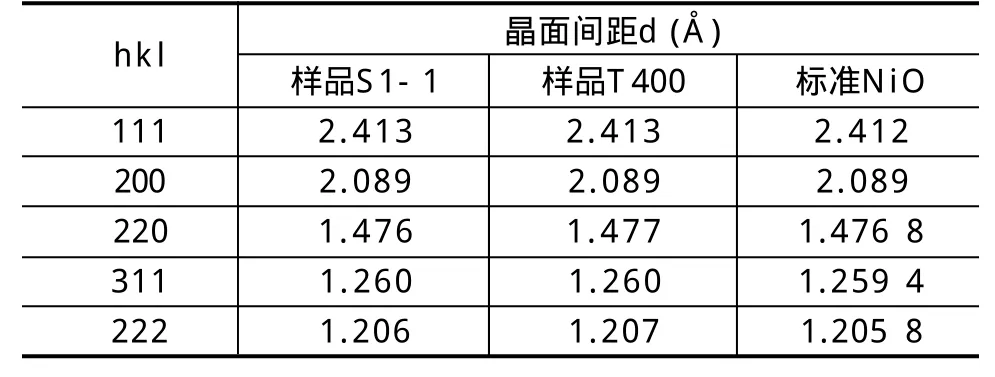
表2 样品NiO的XRD数据
2.2 扫描电子显微分析
图3为样品S1-1的扫描电子显微照片。由图可知,产物主要为微立方体二次晶粒,平均粒径为0.60μm。二次晶粒由大量粒径小于0.10μm的一次晶粒聚集形成。图4为样品T400的扫描电子显微照片。从图中可以看出,样品颗粒主要呈微球状,平均粒径约为0.22μm。NiO晶体主要以微球状的一次晶粒存在。这与XRD图中用Scherer公式计算的晶粒尺寸基本吻合。


图5为样品S3-3 的扫描电子显微照片。由图可见,产物主要为立方晶体,平均粒径为0.64μm,晶粒发育良好,有一定的团聚存在。图中微立方状晶粒已经是基本单元了,看不出内部有更小组成单元存在。这一特征明显区别于图3样品S1-1的情况,表明增大熔盐用量更有利于晶粒在熔盐中生长。

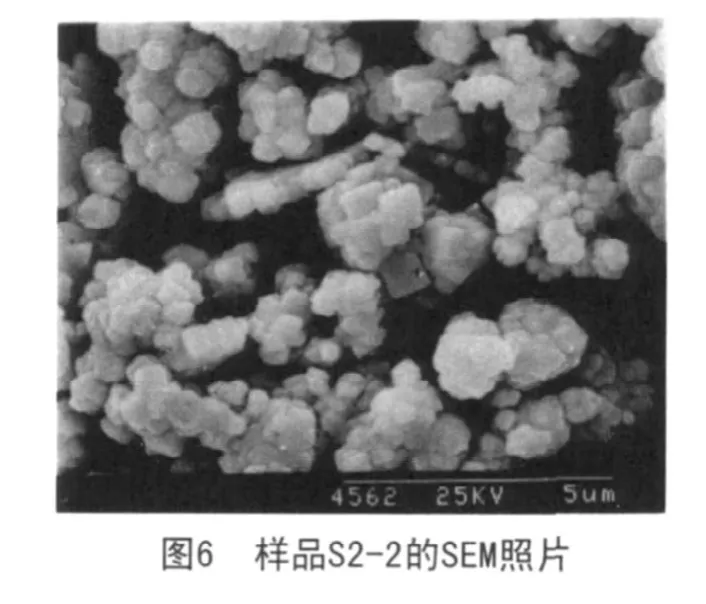
图6为样品S2-2的扫描电子显微照片。从图中可以看出,产物为微立方晶体,平均粒径约为0.70μm。各晶粒形状规则,发育良好,有一定的团聚现象存在。
2.3 讨论
综合以上4图可以得知,相同条件下400℃2h焙烧样品S1-1、T400、S3-3的晶粒形状差异较大。样品T400没有加入KNO3、NaNO3混合熔剂,它是由晶体Ni(NO3)2·6H2O直接焙烧的产物,主要为微球状固体,颗粒较小,粒度分布较宽。在KNO3、NaNO3混合熔剂存在下,经熔盐反应生成的S1-1、S3-3,晶粒主要呈微立方状,晶体发育完整。由此可知,混合熔剂KNO3、NaNO3的存在为NiO晶体的生长提供了一种有利的环境。NiO属于立方晶系,在有利于晶体生长的条件下,主要发育成立方体或八面体形状。从S1-1、S3-3发育完好的微立方体晶形可以判断,试验中熔体为传质提供了一种特殊的有利环境,使NiO晶体在熔体中取向生长,形成了棱角分明、形状规整的微细晶粒。从SEM图中还可得知,熔剂对NiO产物的晶形发育具有重要影响,熔体相的存在能加快离子扩散速率,有利于晶体的定向生长。
从样品S1-1、S3-3的SEM图可以观察样品S1-1的平均粒径为0.60μm,而样品S3-3的平均粒径为0.64μm。由此可知,随着熔盐相对用量的增加,所得产物颗粒的尺寸有增大的趋势,但是影响不是很明显。
对比样品S1-1和样品S2-2可知,二者都是在摩尔比(Ni∶K∶Na)为1∶1∶1的条件下进行反应,不同的是焙烧的温度不一样,样品S1-1焙烧温度400℃,而样品S2-2焙烧温度600℃,从各自的SEM图可知样品S1-1的平均粒径为0.60μm,而样品S2-2的为0.70μm。说明在相同用配料条件下,随着焙烧温度的升高,产物的晶粒度增大。
从表1可知,直接使用六水硝酸镍和熔盐反应分解六水硝酸镍,在400℃焙烧后得到的NiO均为黑色。而在600℃焙烧后得到的NiO为浅绿色。根据文献报道[14],在通过加热煅烧制备NiO超细粉体时,随着焙烧温度的升高,生成的NiO粉体的颜色变浅,经400℃2h焙烧后的粉体呈黑色,而经600℃2h处理后,生成的NiO粉体的颜色变成浅灰色,经700℃2h处理后得到的NiO粉体基本变为浅绿色。本试验经过600℃2h处理后得到的NiO粉体已经变为浅绿色,说明熔盐反应过程NiO非常活泼,有利于反应体系在较低温度下达到镍和氧的化学计量比例。对不同温度条件下生成的NiO出现颜色变化的现象,NEWMAN等[15]认为,在较低温度下生成黑色NiO,是因为NiO晶体中含有过量的氧原子,它是一种非化学计量比氧化物,过量氧会提高NiO在绿色“透明”区中的吸收系数,使NiO在整个可见光范围内趋于更均匀的吸收,呈现黑色;在较高温度下生成绿色NiO,是由于温度升高使镍和氧原子重新组合,构造成趋于稳定化学计量比的NiO,对红光和紫光的吸收很强,而对绿光的吸收较弱,使得NiO呈现绿色。
硝酸钠与硝酸钾的混合盐在600℃时不分解,不会阻碍硝酸镍反应,因此在熔盐反应中只发生了如下反应:

硝酸钠与硝酸钾的混合盐在整个反应中只是转变成熔体,降低了硝酸镍的反应温度,缩短了反应时间,使反应成分在液相中的流动性增强,扩散速率提高。此外,通过熔盐法可以控制粉体颗粒的形状,这可能与反应物的表面能和界面能有关[16]。而且,反应的熔剂硝酸盐可以从最终产品中洗涤回收,循环利用。
经过称量可知:从20g Ni(NO3)2·6H2O出发,通过熔盐反应后,可以得到大约4g的NiO,计算可知由该方法生成的NiO损失并不大。由于物质的量少,洗涤过程中难免有一定损失,如果扣除洗涤损失,则氧化镍的收率在85%以上。说明在熔盐反应过程中,六水硝酸镍在高于其沸腾温度的熔盐中虽有挥发,但挥发量很少。因此,采用熔盐法,由六水硝酸镍不经预脱水处理,快速制备微细氧化镍粉体,这一方案是可行的。
3 结论
(1) 采用混合熔盐法直接从六水硝酸镍快速制备出平均粒径为0.60μm的微立方状氧化镍颗粒,所使用的KNO3、NaNO3混合盐在整个工序中不参与化学反应,只起到熔剂的作用,该混合盐可循环利用。
(2) 研究发现,用熔盐法制备NiO微粒的最低温度为400℃。在相同条件下,随着焙烧温度的升高,NiO微粒的粒径增大;随着熔剂混合盐用量的相对增加,NiO微粒的粒径增大,但对NiO粉体的晶体形状几乎没有影响。
(3) 熔盐法的熔剂混合盐对NiO晶体的生长提供了有利的环境。由纯Ni(NO3)2·6H2O焙烧的产物主要为微球状细小晶粒。在KNO3、NaNO3混合盐熔剂存在下,焙烧得到的NiO产物晶粒主要呈微立方状。熔体为离子的扩散传质提供了非常有利的环境条件,NiO晶体在熔体中取向生长,形成了发育完整、形状规则的细小晶粒。相对于Ni(NO3)2·6H2O直接分解而言,混合熔盐反应更有利于晶体生长,对反应温度要求更低。
[1]HARUTA M, YAMADA N,KOBAYASHI T, et al. Gold catalysts prepared by coprecipitation for low-temperature oxidation of hydrogen and of carbon monoxide[J]. J Catal, 1989,115(2):301-309.
[2]LU P, TANG Z A, YU J, et al. Study on a micro-gas sensor with SnO2-NiO sensitive film for indoor form aldehyde detection[J].Sensors and Actuators B, 2008, 132:74-80.
[3]LEE C Y, CHANG C M, WANG Y H, et al. A self-heating gas sensor with integrated NiO thin- film for formaldehyde detection[J]. Sensors and Actuators B, 2007,122:503-510.
[4]LIU X, ZHANG X, FU S, et al. Preparation of urchinlike NiO nanostructures and their electro-chemical capacitive behaviors[J]. Materials Research Bulletin, 2006,41:620-627.
[5]上海大学.用于超级电容器的纳米氧化镍电极的制备方法[P].中国专利:1944276A,2006-10-19.
[6]DENG X Y, CHEN Z. Preparation of nano-NiO by ammonia precipitation and reaction in solution and competitive balance[J]. Materials Letters, 2004,58:276-280.
[7]DHANRMIARAJ N, PRABU P. Synthesis of nickel oxide nanoparticles using nickel acetate and poly (vinyl acetate)precursor[J]. Materials Science and Engineering B, 2006,128:111-114.
[8]THOTA S, KUMAR J. Sol-gel synthesis and anomalous magnetic behavior of NiO nanoparticles[J]. Journal of Physics and Chemistry of Solids, 2007, 68: 1951-1964.
[9]TIWARI S D, RAJEEV K P. Magnetic properties of NiO nanoparticles[J]. Thin Solid Films, 2006, 505:113-117.
[10]WANG Y P, ZHU J W. Preparation of NiO nanoparticles and their catalytic activity in the thermal decomposition of ammonium perchlorate[J]. Thermochimica Acta, 2005,437:106-109.
[11]李生英,高锦章,杨武,等.固相合成纳米NiO微粒[J].西北师范大学学报(自然科学版),2003,39(1):46-48.
[12]胡辉,高艳阳.低热固相法制备纳米氧化镍[J].应用化工,2003,32(5):30-32.
[13]《化学工程手册》编辑委员会.化学工程手册[M].北京:化学工业出版社,1989.
[14]朱诚意,刘中华,陈雯.溶胶转化—凝胶法制备NiO超细粉[J].有色金属,1999,51(4):57-62.
[15]NEWMAN R, CHRENKO R M. Optical properties of nickel oxide[J]. Physical Review.1995,114(6):1507-1511.
[16]宋煜昕,李承恩,晏海学.熔盐法合成SrBi2Ta2O9[J].无机材料学报,2002,17(1):145-148.
Preparation and Characterization of Superfine Nickel Oxide Powder
WANG Xue-cai1, FENG Ying2
(1.Henan Coal Chemical Industry Group Carbon Fiber Co.,Ltd.,Shangqiu 476000, China;2. China Shenma Group Company Limited, Pingdingshan 467000, China)
Superfine nickel oxide powders were prepared from Ni(NO3)2·6H2O by the KNO3/NaNO3flux method. The influence of calcination temperature and the ratio of nickel salt to flux on the crystallization process of nickel oxide crystallite was studied.The product was characterized by XRD and SEM. Well developed crystals of fine cubic shape were observed for the nickel oxide powder obtained from molten nitrates, with a mean particle size of 0.60μm.
NiO; molten KNO3/NaNO3flux method; chemical synthesis; characterization
TQ138.13
A
1007-9386(2010)05-0032-04
2010-07-14

