中性红与牛血清白蛋白相互作用特征研究
吴刚珂 李 杨,颜承农
(荆州市中心医院检验科,湖北 荆州 434020)(长江大学化学与环境工程学院,湖北 荆州 434020)
中性红与牛血清白蛋白相互作用特征研究
吴刚珂 李 杨,颜承农
(荆州市中心医院检验科,湖北 荆州 434020)(长江大学化学与环境工程学院,湖北 荆州 434020)
在模拟动物体生理条件和不同温度下,用荧光光谱、同步荧光光谱、三维荧光光谱和紫外可见吸收光谱法等研究了中性红(Neutral Red,NR)与牛血清白蛋白(bovine serum albumin,BSA)的相互作用,证实了NR有很强地猝灭BSA荧光强度的能力。分别用Stern-Volmer方程、Lineweaver-Burk双倒数方程和热力学方程等处理试验数据,得到在25~43℃度时相互作用的生成常数KLB(平均值为4.250×104kJ/mol)、热力学参数(ΔHθ、ΔGθ和ΔSθ的平均值分别为-6.432kJ/mol、-21.38kJ/mol和-48.68J/K)和结合位点数(平均值为1.155)。
中性红;牛血清白蛋白;荧光猝灭光谱;三维荧光光谱;紫外吸收光谱;热力学参数
蛋白质是由许多氨基酸聚合而成的生物大分子化合物,是生命的最基本物质之一,它与营养、发育、遗传、新陈代谢等生命活动等密切相关。白蛋白是主要的血清蛋白,它能和许多内源、外源性物质结合。一些小分子染料与蛋白质结合,可引起染料或蛋白质光谱特性的变化,因此应用这些小分子染料作为研究蛋白质的荧光探针,可以从分子水平上进一步了解在其他分子的作用下蛋白质分子构象的变化和相互作用的机理等[1,2]。NR(Netural Red,中性红)是一种稳定性比较好的有机染料。邓世星等研究了NR与BSA之间的相互作用,但其试验结果显得粗糙,对荧光猝灭性质的判断显得证据不足[3]。笔者在25~43℃温度范围和试验条件下,扫描NR作用于BSA的荧光猝灭光谱、同步荧光光谱、三维荧光光谱和紫外-可见吸收光谱,分别用Stern-Volmer方程和Lineweaver-Burk方程等处理试验数据,证实了在试验条件下,NR与BSA可相互作用形成具有一定结构的复合物,作用力主要是氢键作用力和范德华力,得到了相互作用常数和热力学参数,为研究NR的染色机理,探讨释放到环境中的NR产生的生物学效应和对蛋白质构象的影响等提供重要信息。
1 试验部分
1.1仪器与试剂
1)仪器 LS-55型荧光分光光度计(美国PE公司);TU-1901型紫外可见分光光度计(北京普析通用仪器有限责任公司);AY120电子天平(日本岛津公司);恒温水浴SYC-15型(南京桑力电子设备厂)。
2)试剂 NR (上海试剂三厂,分子式为C15H17N4Cl,摩尔质量288.79,中文名为2-甲基-3-氨基-6-二甲氨基二氮杂蒽盐酸盐)储备液:200μg/ml;NR工作液:30μg/ml;BSA(上海生物化学制剂厂)溶液:5.0×10-5mol/L;NaCl溶液:0.5mol/L;Tris-HCl缓冲溶液(pH=7.40)。所用试剂均为分析纯,水为二次去离子水,经检测均无荧光杂质。
1.2试验方法
在10ml比色管中依次加入2.0ml NaCl(0.5mol/L)溶液、2.0ml Tris-HCL缓冲溶液(pH=7.4)和2.0ml BSA(5.0×10-5mol/L)溶液及0~3.5ml NR溶液,以二次去离子水定容;在波长λex=285nm、狭缝宽度分别为15nm和2.5nm、常压、25、31、37和43℃下于250~500nm范围内扫描BSA的荧光猝灭光谱,在常压和25℃时测定了体系的同步荧光光谱,三维荧光光谱和紫外-可见吸收光谱;分别获得试验体系的相对荧光强度和吸光度等。
2 结果与讨论
2.1NR对BSA的荧光猝灭光谱
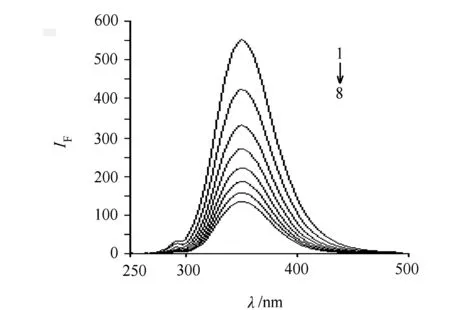
曲线1~8的cNR/×10-5:0,0.5195,1.039,1.559,2.078,2.598,3.117,3.637mol/L;cBSA=1.0×10-5mol/L;cNaCl=0.1mol/L。 图1 NR对BSA荧光猝灭光谱
1)荧光猝灭光谱 BSA分子中的色氨酸、酪氨酸和苯丙氨酸残基能够发射内源荧光。当激发光波长为285nm时,BSA荧光发射峰位置在347nm附近。随着NR浓度增加,BSA的荧光发射峰强度有规律地降低,表明NR分子能够与BSA发生相互作用进而猝灭BSA的内源性荧光。按试验方法分别扫描了25、31、37、43℃等温度下BSA和BSA- NR体系的荧光猝灭光谱,25℃的BSA的荧光光谱和在NR作用下BSA的荧光猝灭光谱见图1。
2)荧光猝灭作用描述 荧光猝灭作用可分为动态猝灭、静态猝灭和非辐射能量转移猝灭等。在一般情况下,动态猝灭作用和静态猝灭作用可用猝灭常数随温度的变化关系加以区分。对于动态猝灭作用,升高温度将增加分子间的有效碰撞和加剧电子的转移过程,荧光猝灭常数随着温度的升高而增大;对于静态猝灭作用,升高温度将降低复合物的稳定性,荧光猝灭常数随着温度的升高而减小。动态猝灭和静态猝灭作用还可以分别用Stern-Volmer方程[2]:

(1)
和Lineweaver-Burk方程[3]:
(2)

2.2荧光猝灭作用性质和相互作用力
1)相互作用的线性回归方程和热力学参数 由4个温度下荧光强度变化的试验数据分别作出Stern-Volmer 曲线和Lineweaver-Burk双倒数曲线,如图2所示。对试验数据线性拟合得到直线方程、相关系数等(见表1)。

图2 Stern-Volmer 曲线和Lineweaver-Burk曲线

温度/℃Stern-Volmer方 程RLineweaver-Burk方 程R25I0F/IF=0.7236+8.915×104cNR0.9957(I0F-IF)-1=1.49×10-3+3.230×10-8c-1NR0.999931I0F/IF=0.6912+9.088×104cNR0.9948(I0F-IF)-1=1.51×10-3+3.444×10-8c-1NR0.999937I0F/IF=0.6503+9.417×104cNR0.9939(I0F-IF)-1=1.47×10-3+3.509×10-8c-1NR0.999643I0F/IF=0.6586+9.546×104cNR0.9946(I0F-IF)-1=1.61×10-3+4.051×10-8c-1NR0.9994

图3 lnKLB~1/T图
当温度变化不大时,NR与BSA作用的焓变ΔH可看成一个常数,当溶液比较稀时,KSV可视为相互作用的标准平衡常数[7],根据式(1)和(2)可以求得相互作用的KSV、Kq和KLB,由Van’t Hoff等压方程的不定积分式作图可以求得ΔH(图3),由热力学方程可求ΔGθ和ΔSθ等,见表2。
2)荧光猝灭作用性质的判断 由图2和表1可以看出,NR对BSA作用的Lineweaver-Burk曲线的线性关系明显优于Stern-Volmer曲线的线性关系;KLB随着温度的升高而减小;动态猝灭作用的Kq值一般都小于2.0×1010L/(mol·s)。该试验体系的Kq值大于2.0×1010L/(mol·s);相互作用的吉布斯自由能小于零,荧光猝灭常数KLB的均值达到4.250×104mol/L,说明它们之间的相互作用能自发进行,且作用产物稳定性良好。

表2 NR对BSA作用常量和热力学参数
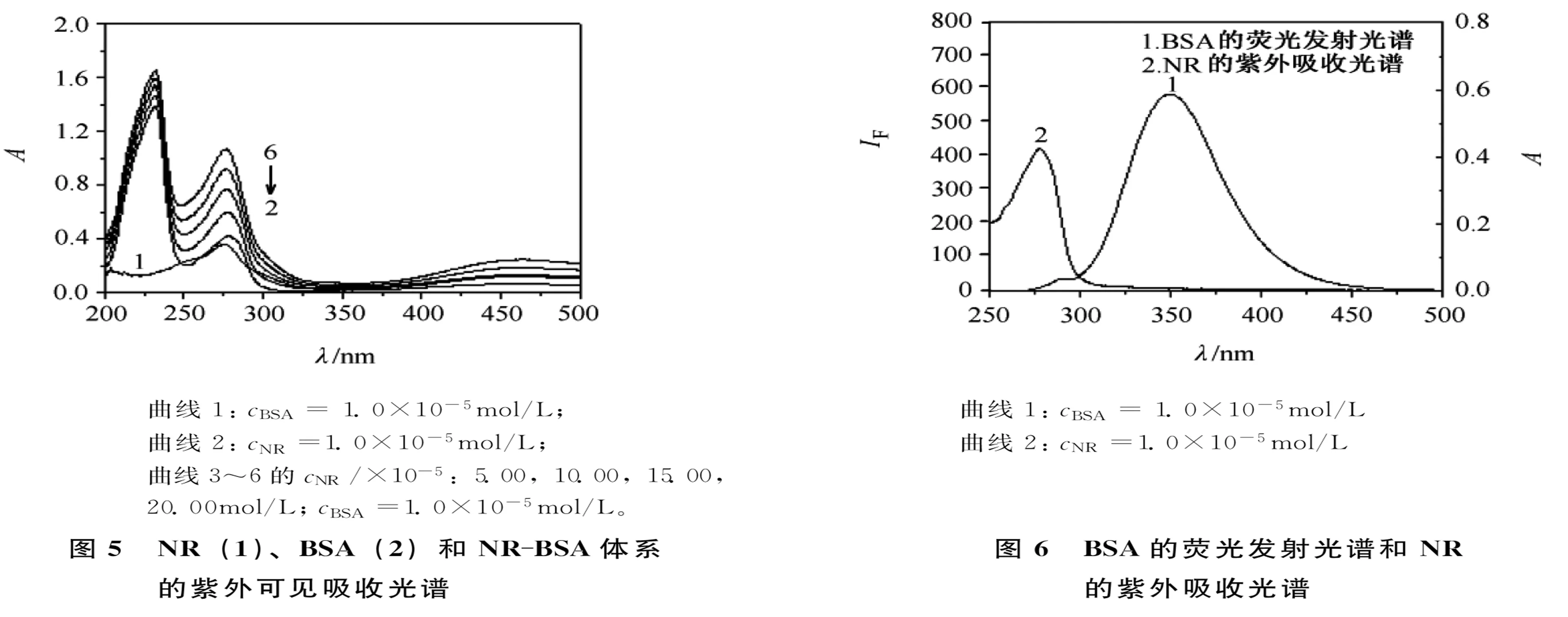
在波长差分别为60nm和15nm时的同步荧光光谱主要反映蛋白质中Trp和Tyr氨基酸残基的荧光光谱特征[5],按照试验方法分别测得Δλ=60nm和Δλ=15nm时,BSA和BSA与NR作用的同步荧光光谱,如图4(a)和4(b)。随着NR浓度的增加,Trp和Tyr的发射波长均发生红移;BSA、NR和BSA-NR体系的紫外-可见吸收光谱的吸收峰强度和吸收峰波长明显有别(图5);这些都是BSA与NR作用生成新复合物的佐证。由此可以判断NR对于BSA的荧光猝灭属于静态荧光猝灭作用。

曲线1~8的cNR/×10-5:0,0.5195,1.039,1.559,2.078,2.598,3.117,3.637mol/L;cBSA=1.0×10-5mol/L;cNaCl=0.1mol/L。图4 同步荧光光谱
3)相互作用力类型 小分子和蛋白质等生物大分子之间的结合力主要有疏水作用力、氢键作用力、范德华力和静电引力等。Ross等[6]根据大量的试验结果,总结出了判断生物大分子与小分子结合力类型和生物大分子自身结合力性质的热力学规律。根据此规律和表2所列数据,该试验体系的ΔSlt;0、ΔHlt;0,NR与BSA之间的作用力可能主要是氢键作用力和范德华力。
4)结合位点数n和结合位点 生物大分子与小分子相互作用的结合常数K、结合位点数n和猝灭剂浓度C之间满足:


根据偶极-偶极非辐射能量转移理论,当给能体与受能体之间的距离靠近约在7nm以内,即有可能发生能量转移现象[8]。能量转移效率和2个结合位点基团之间距离满足:

其中,E为能量转移效率;r为供能体和受能体之间的结合距离;R0为临界能量转移距离;φ为供能体荧光量子产率;J为供能体的荧光发射光谱与受能体吸收光谱的重叠积分。试验测得BSA的荧光发射光谱和NR的紫外-可见吸收光谱有较大程度的重叠(见图6)。由函数关系式求得BSA与NR分子之间的结合距离约为2.18nm。
2.3NR对BSA构象的影响
三维荧光光谱能为人们提供更多BSA构象变化的相关信息。在水溶液中,蛋白质分子中的疏水效应、各基团之间的氢键作用和静电作用力是稳定和维持其二、三级结构的重要因素。BSA主要由疏水作用力维持其空间结构和疏水腔,几乎所有的疏水性氨基酸残基都包埋在其圆筒形的疏水腔内,它所处的微环境变化直接影响氨基酸残基的最大荧光发射波长移位和荧光强度的强弱,导致其空间构象的变化[9,10]。

图8 BSA和BSA-NR体系的等荧光强度图
按照试验方法扫描了BSA和NR-BSA体系的三维荧光光谱(如图7),绘制了等荧光强度图(图8)。由图可比较NR作用BSA前后三维荧光光谱的变化,探讨NR对BSA微环境和构象的影响。在NR作用BSA后,在荧光发射光谱中BSA的Trp的峰位有明显红移;在图7(a)中,当BSA的浓度为5.0 ×10-5mol/L时,其峰顶的相对荧光强度和峰顶坐标(IF,λex/λem)为(516.1,280.0/348.5),在图7(b)中,当加入NR后,BSA峰顶的相对荧光强度和峰顶坐标(IF,λex/λem)为(283.2,280.0 /346.0),荧光强度降低了232.9,激发波长未移动,但发射波长蓝移了2.5nm。加入NR后,BSA的相对荧光强度明显减弱,峰坐标波长亦有变化,说明NR与BSA作用后,Trp所处微环境的极性有所削弱,而Tyr所处微环境的极性有所增强;随着NR浓度增大,BSA所处微环境的极性和疏水效应发生了变化,肽链松散度增加,有利于氢键的重组,加上范德华力的作用,导致BSA原有的α-螺旋结构可能部分或者大部转化为β-折叠结构,形成了一种新的无序结构[11,12]。
3 结 论
1) 由25~43℃温度范围内体系的荧光猝灭光谱数据,得到了NR和BSA相互作用的生成常数KLB的平均值为4.250×104L/mol,热力学参数ΔHθ、ΔGθ和ΔSθ的平均值分别为-6.432kJ/mol、-21.38kJ/mol和-48.68J/K,结合位点数的平均值为1.155,结合距离约为2.18nm。
2)荧光猝灭性质主要是静态猝灭,相互作用力主要是氢键力和范德华力,这有助于阐明NR的染色机理。
3)蛋白质分子中的疏水效应、各基团之间的氢键作用和静电作用力是稳定和维持其二、三级结构的重要因素。由同步荧光光谱和三维荧光光谱的特征可以看出,NR作用BSA后,BSA所处微环境的极性和疏水效应发生了变化,肽链松散度增加,有利于氢键的重组,加上范德华力的作用,导致BSA原有的α-螺旋结构可能部分或者大部转化为β-折叠结构。
[1]Mauricios B,Guilherme L I.Effect of BSA binging on photophysical and photochemical properties of triaylmethane dyes[J].J Phys Chem B,1998,102:4678~4688.
[2]杨曼曼,杨频,张立伟. 荧光法研究咖啡酸类药物与白蛋白的作用[J].科学通报,1994,39(1):31~35.
[3]邓世星,杨季东.荧光法研究牛血清白蛋白与中性红的相互作用[J].分析科学学报,2007,23(2):177~180.
[4]Yan Cheng-nong,Zhang Hua-xin,Mei Ping,etal.Study on Reaction between Flucytosin and Bovine Serrum Albumin[J].Chinene Journal Chemistry,2005,23:1151~1156.
[5]黄波,邹国林,杨天鸣.阿霉素与牛血清白蛋白结合作用的研究[J].化学学报,2002,60:1867~1871.
[6]Ross D P,Subramanian S. Themodynamics of Protein Association Reactions :Froces Contributing to Stability[J].Biochemistry,1981,20:3096.
[7]杨频,高飞.生物无机化学原理[M].北京:科学出版社,2005,57.
[8]Sauter K,Sheer H, Sauer P.Forster Transfer Calculation Based on Crystal Structure Isolated From Agenellum Quadruplicatum C-Phycocyanin[J].Photochem Potobio,1987,46:427~440.
[9]张宝林,王文清,白凤莲.蒽醌及黄酮类化合物与人血清百蛋白的结合反应研究[J].高等学校化学学报,1994,15(3):373~378.
[10]鄢远,许金钩,陈国珍.三维荧光光谱法研究蛋白质溶液构象[J].中国科学(B),1997,27(1):16~22.
[11]颜承农,张华新,鞠香,等.荧光光谱法研究钙试剂羧酸钠与牛血清白蛋白结合反应特征[J].分析化学,2005,33(6):759~762.
[12] 吴刚珂,颜承农,刘义.头孢呋辛酯与牛血清白蛋白相互作用特征研究[J].光谱学与光谱分析,2008,28(9):2139~2143.
[编辑] 洪云飞
O614
A
1673-1409(2009)03-N021-05
2009-05-13
湖北省自然科学基金项目(2005ABA067)。
吴刚珂(1962-),男,2004年大学毕业,技师,现主要从事医学检验方面的研究工作。

