胰腺癌肿瘤干细胞的悬浮培养法
张世能 峗淑莉 黄凤婷 钟娃 庄晓虹 梁爱心
·论著·
胰腺癌肿瘤干细胞的悬浮培养法
张世能 峗淑莉 黄凤婷 钟娃 庄晓虹 梁爱心
目的建立无血清悬浮培养分离人胰腺癌细胞系PANC1干细胞球的方法。方法采用无血清悬浮法培养PANC1细胞,显微镜下观察干细胞球形成率;流式细胞仪检测细胞CD133表达和细胞周期;以含10% FBS培养基诱导干细胞球细胞分化,荧光显微镜下观察细胞形态及CK18的表达;干细胞球细胞接种NOD/SCID小鼠皮下,观察其成瘤能力。结果在无血清悬浮培养条件下存活的PANC1细胞形成干细胞球,体外连续传代培养20代始终保持4‰~5‰的干细胞球形成率。干细胞球细胞CD133表达率(5.91±0.7)%,G0/G1期细胞占(80.99±2.60)%,与原代PANC1细胞的(1.44±0.52) %和(69.01±5.03)%相差显著(Plt;0.05)。将干细胞球细胞置含血清培养基中培养,细胞逐渐恢复原代细胞形态,并表达上皮标志蛋白CK18,2×103的干细胞即在NOD/SCID小鼠皮下成瘤。结论无血清悬浮法培养PANC1细胞可分离出肿瘤干细胞,其具有自我更新、多向分化和成瘤能力。
胰腺肿瘤; 干细胞; 培养基,无血清; 悬浮法
越来越多的研究资料显示,肿瘤组织和细胞系中存在着一群比例极少的干细胞,其具有自我更新、多向分化潜能和高致瘤性,对放疗和化疗天然耐受,被认为是肿瘤生成、生长、转移、复发和耐药的基础[1]。迄今,已证实在白血病、脑肿瘤和乳腺癌等多种类型肿瘤中存在干细胞[2-4]。我们前期从胰腺癌细胞系SW1990中成功分离干细胞样的侧群细胞[5]。本研究采用无血清悬浮培养法从人胰腺癌PANC1细胞中分离干细胞,并进一步分析其特征。
材料与方法
一、干细胞球培养
收集对数生长期PANC 1细胞,用无血清DMEM-F12培养基(0.4%BSA、EGF20 ng/ml、胰岛素5 μg/ml、B27 50×、青霉素100 U/ml、链霉素100 μg/ml)重悬,调整细胞密度至103/ml。取10 ml细胞悬液置于直立的25 ml培养瓶中常规培养12 d左右,收集细胞吹打成单细胞悬液,接种于无血清DMEM-F12培养基传代。
二、干细胞球形成率实验
收集原代PANC1细胞系及传代的PANC1干细胞球,各取1000个细胞分别接种于含5 ml DMEM-F12培养基的6孔板中培养15 d,光镜下计数干细胞球形成数,干细胞球数/接种细胞数的百分率即为干细胞球形成率。
三、细胞CD133表达的检测
取生长12 d的PANC1干细胞球和对数生长期PANC1细胞,加入FITC标记的CD133,4℃避光孵育30 min,PBS洗后加入1 ml流式固定液,上流式细胞仪检测CD133的表达。
四、细胞周期检测
取上述细胞加入2 ml预冷的70%乙醇固定18 h,加入RNase(50 μg/ml),加PI染液(50 μg/ml),37℃孵育30 min,流式细胞仪分析。
五、细胞成瘤实验
取PANC1干细胞球,用PBS重悬,分别接种2×102、2×103和2×104/200 μl至NOD/SCID小鼠背部皮下,每组3只。当肿瘤长度和宽度约1~2 cm时,处死小鼠,取出皮下肿瘤,常规病理检查。
六、细胞诱导分化及形态学观察
取PANC1干细胞球,用10%血清的RPMI1640培养基培养,光学显微镜下动态观察其形态学改变,采用免疫荧光方法检测诱导分化3 d和10 d时细胞的CK18表达。
七、统计学处理

结 果
一、胰腺癌干细胞球的形成
在无血清培养基中悬浮培养4~5 d开始形成干细胞球,折光性好,中间密度高(图1A),培养至10 d(图1B)和15 d(图1C),细胞球逐渐增大,中心密度更高。培养12 d左右后传代,能继续形成干细胞球,以后每7~9 d传代,连续传20代。原代PANC1的干细胞球形成率为(5.8±1.7)‰;第一代干细胞球的形成率为(5.5±1.3)‰;第四代为(4.5±1.3)‰,无显著差异(Pgt;0.05)。
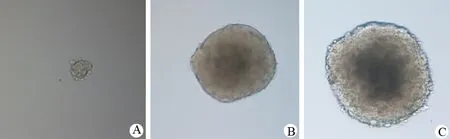
图1 胰腺癌干细胞球的形成
二、干细胞球中细胞的CD133表达和周期分布
原代PANC1细胞CD133表达为(1.44±0.52)%(图2B),第一代干细胞球为(5.91±0.7)%(图2A),两者相差显著(Plt;0.05)。原代PANC1的G0/G1期细胞占(69.01±5.03)%(图2D);第一代干细胞球为(80.99±2.60)%(图2C),两者相差显著(Plt;0.05)。
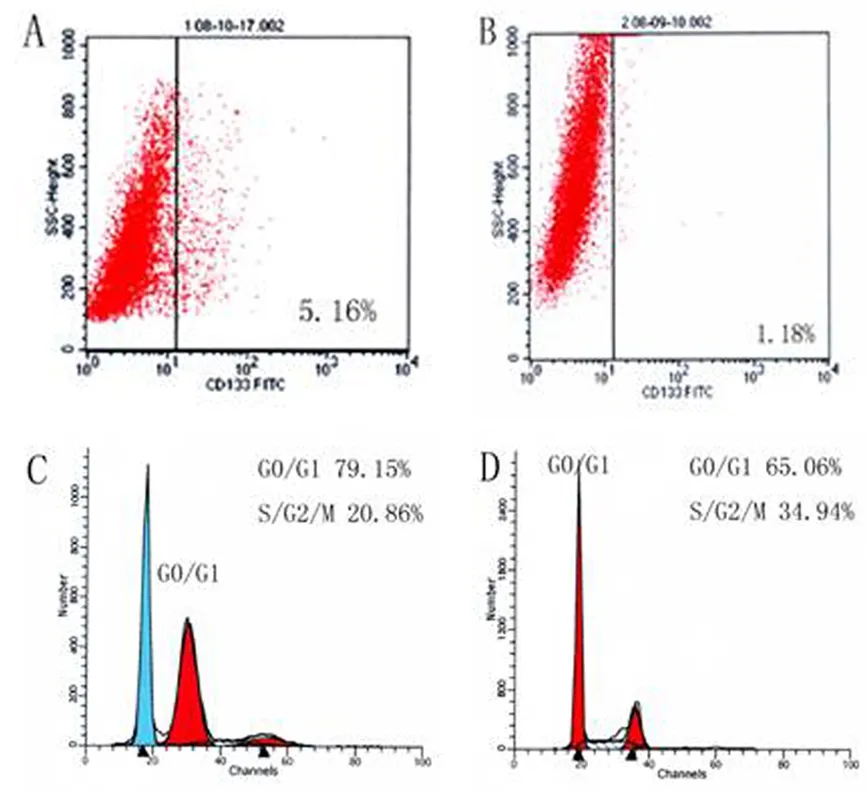
图2 CD133的表达和细胞周期分布
三、NOD/SCID小鼠成瘤情况
PANC1干细胞球细胞接种至小鼠背部皮下第11周时,2×103组3只小鼠中有1只、2×104组3只小鼠均可观察肿瘤的形成(图3A),病理学检查显示种植瘤具有与原代细胞一样的核分裂、核异型的表现(图3B)。2×102组无小鼠成瘤。
四、细胞克隆的诱导分化
第一代干细胞球细胞置含血清培养基培养8 h后开始贴壁,伸出突起,24 h完全贴壁,细胞呈棱形、多角形和星形等(图4A),在含血清培养基中培养的时间越长,细胞的形态与原代细胞的形态越相似。培养3 d后,少部分细胞表达CK18,10 d后,大部分细胞都表达CK18(图4B)。
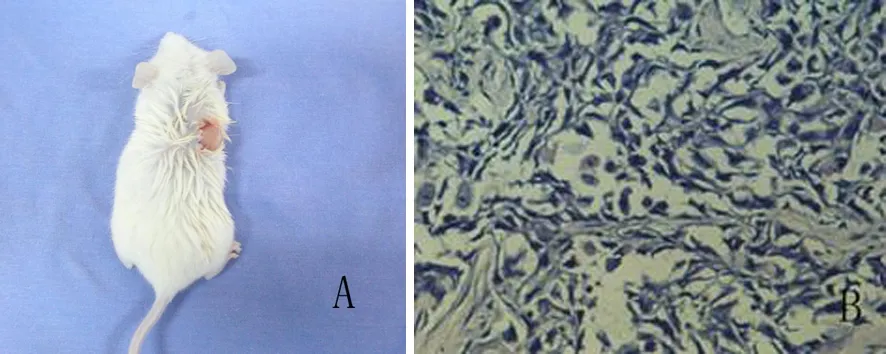
图3荷瘤NOD/SCID小鼠(A)及瘤组织的病理改变(HE ×200)
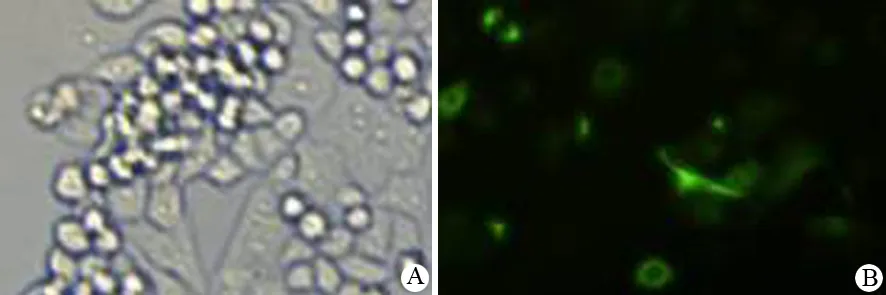
图4第一代PANC1干细胞球用含血清培养剂培养3 d后的细胞形态(A)和CK18表达(B)
讨 论
胰腺癌的早期诊断率低,耐药率高,复发及转移率高,临床治疗效果一直不理想,这可能缘于存在一群为数极少的胰腺癌肿瘤干细胞所致。因此,研究胰腺癌肿瘤干细胞的特性,将为胰腺癌的临床诊断和治疗提供新的思路和策略,而分离和纯化胰腺癌干细胞是首要解决的关键问题[6]。
目前分离肿瘤干细胞的方法有3种:第一种为流式细胞分选法,Li等[7]用此方法分离出CD44+CD24+ESA+的胰腺癌干细胞,Hermann等[8]分离出CD133+的胰腺癌干细胞;第二种为侧群细胞分选法,我们前期已有报道[5];第三种则为无血清悬浮培养法,已分离出脑、乳腺和结肠肿瘤的干细胞[3-4,9],但对胰腺癌尚未见报道。
由于肿瘤干细胞尚无公认的特异性表面标志物,因此鉴定干细胞主要依据细胞是否具有自我更新、多向分化潜能和高致瘤性。本文采用无血清悬浮培养法从PANC1中分离出干细胞球,且在体外连续传代20代始终保持一定的干细胞球形成率,当转换成血清培养时,干细胞球细胞能贴壁生长,且表达CK18;2000个干细胞能在NOD/SCID小鼠中成瘤,符合上述3种特性,可以认为这些细胞是肿瘤干细胞。
CD133为造血干细胞的表面标志物,也被认为是脑、结肠肿瘤干细胞的表面标志物。Hermann等[8]分离的CD133+的胰腺癌细胞,500个就能使NOD/SCID小鼠成瘤。本实验采用无血清悬浮培养法分离的干细胞球细胞也高表达CD133,提示该培养方法能富集CD133表型的胰腺癌干细胞,可作为研究胰腺癌干细胞较为理想的模型。
[1] Croker AK,Allan AL.Cancer stem cells: implications for the progression and treatment of metastastic disease.J Cell Mol Med,2008,12:374-390.
[2] Bonnet D,Dick JE.Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell.Nat Med,1997,3:730-737.
[3] Inagaki A,Soeda A,Oka N,et al.Long-term maintenance of brain tumor stem cell properties under at non-adherent and adherent culture conditions.Biochem Biophy Res Commun,2007,361:586-592.
[4] Ponti D,Costa A,Zaffaroni N,et al.Isolation and in vitro propagation of tumorigenic breast cancer cells with stem/progenitor cell properties.Cancer Res,2005,65:5506-5511.
[5] 黄凤婷,张世能,黄奕俊,等.人胰腺癌细胞系SW1990中肿瘤干细胞样侧群细胞的分离及生物学特性研究.中华胰腺病杂志,2008,8:376-379.
[6] Lee CJ,Dosch J,Simeone DM.Pancreatic cancer stem cells.J Clin Oncol,2008,26:2806-2812.
[7] Li C,Heidt DG,Dalerba P,et al.Identification of pancreatic cancer stem cells.Cancer Res,2007,67:1030-1037.
[8] Hermann PC,Huber SL,Herrler T,et al.Distinct populations of cancer stem cells determine tumor growth and metastatic activity in human pancreatic cancer.Cell Stem Cell,2007,1:313-323.
[9] Ricci-Vitiani L,Lombardi DG,Pilozzi E,et al.Identification and expansion of human colon-cancer-initiating cells.Nature,2007,445:111-115.
2008-12-26)
(本文编辑:吕芳萍)
Suspensioncultureofhumanpancreaticcancerstemcells
ZHANG Shi-neng,WEI Shu-li,HUANG Feng-ting,ZHONG Wa,ZHUANG Xiao-hong,Liang Ai-xin.
Department of Gastroenterology,Sun Yat-sen Memorial Hospital,Sun Yat-sen University,Guangzhou 510120,China
ZHANGShi-neng,Emailshinengz@hotmail.com
ObjectiveTo establish the method of suspension culture for stem cells from human pancreatic cancer cell line PANC1.MethodsPANC1 cells were cultured in serum-free medium under floating-culture system. Tumor cell spheres were observed by optical microscope. Expression of CD133and cell cycle were detected by flow cytometry. Cancer stem cells were induced to differentiate with 10% FBS, and expression of CK18, was evaluated with immunofluorescence microscope. Spheres cells were injected into the subcutaneous space of NOD/SCID rat and tumor formation was monitored weekly.ResultsPANC1 cells could form the stem cells spheres, and the rate of sphere formation was stable between 4‰ and 5‰ after 20 passages in vitro. The expression of CD133(5.91±0.7%) and proportion of G0/G1phase cell (80.99±2.60%) was significantly increased in spheres cells compared with parental PANC1 cells (1.44±0.52% and 69.01±5.03%), and the difference was statistically significant (Plt;0.05). When these spheres cells were cultured in media with serum, these cells gradually returned to the status of parental cells and expressed CK18, 2×103sphere cells injection could initiate tumor formation in NOD/SCID rat.ConclusionsTumor spheres stem cells could be generated under serum-free floating-culture system. The sphere cells possessed the capacities of self renew, differentiation, and tumorigenic potential.
Pancreatic neoplasms; Stem cells; Culture media, Serum-free; Floating-culturel system
10.3760/cma.j.issn.1674-1935.2009.05.009
广东省自然科学基金(8151008901000139)
510120 广州,中山大学孙逸仙纪念医院消化内科
张世能,Email:shinengz@hotmail.com

