欧洲花楸的组织培养和快速繁殖试验研究
黄立华 王占龙 于 欣
摘要:春季采取欧洲花楸品种1(Sorbus aucuparia European Mounain) 和品种2“太阳神”(Sorbus aucuparia Titan)的尚未萌动的1年生带侧芽茎段为试材,用0.1%Hgcl2分别用不同的时间进行处植体表面消毒。结果表明这两个品种的1年生带侧芽茎段灭菌时间为15min效果较好;而在分化增殖阶段,培养基MS+6-BA0.8mgL-1(以下单位同)+NAA0.4+肌醇15的分化苗较为粗壮,增殖系数大于9。而在同一个生根培养基1/2MS+IBA0.5+NAA0.05中培养生根苗时,光照时间为14 小时,发根情况好,苗健壮,移栽易成活。
关键词:欧洲花楸;组织培养;繁殖试验
欧洲花楸(Sorbus aucuparia ),属蔷薇科、花楸属。原产欧洲和亚洲西部。欧洲花楸为喜光和半耐荫先锋树种,耐旱性强,耐寒力强,栽培性状优良,既可耐冷湿环境,也能耐干燥瘠薄土壤,可用于荒山绿化。欧洲花楸属落叶小乔木,春天花朵为白色,复伞房花序,花朵密集,繁花似锦,叶片春夏季为深绿色,秋季为鲜艳的紫红色,有光泽,整个冬季至翌年2月橘红色的果实宿存于枝头,与瑞雪互映,这在东北一般园林花木中是不可多得的。欧洲花楸在欧洲已被广泛应用于园林绿化中。果实可用于加工天然实用色素、食品、功能性饮料、药品。可以说欧洲花楸是集食用、园林和生态价值于一身的珍贵树种。
为了加快推广速度,满足市场的苗木需求,我们自2004年开始通过组培快繁大量获得欧洲花楸组培苗,快繁组培苗已达到每年约50000株已形成规模化生产。期望本文能对欧洲花楸规模化栽培提供一条可能有效的途径。
1试验材料
1.1植物名称a.欧洲花楸(Sorbus aucuparia European Mounain)
b.欧洲花楸“太阳神”(Sorbus aucuparia Titan)。
1.2 材料类别1年生带侧芽茎段
1.3 取材时间4月份芽尚未萌动前。
1.4 取材地点辽宁省干旱地区造林研究所的欧洲花楸试验园。
2 试验材料的处理与消毒
将品种a.(Sorbus aucuparia European Mounain)和品种b.太阳神(Sorbus aucuparia Titan)的外植体材料流水冲洗30min。放入肥皂液中用毛刷轻轻刷去植物表面的泥土,清水冲洗干净。将外植体剪成15cm左右的茎段,用自来水冲洗2~3h后将材料置于超净工作台上,先用75%酒精消毒1min,再用无菌水冲洗3次,继而以0.1%的Hgcl2分别对两个品种的外植体表面消毒10 min、15min、20min(灭菌效果见表1),无菌水冲洗5次,取出一根茎段将其放在已经过高温灭菌的吸水纸上,吸干表面水分后,在无菌纸上将外植体切成1~2cm左右带腋芽的茎段,接种在芽诱导培养基中培养,每瓶为一个带芽茎段。启动培养成功后,再将启动培养萌动的嫩梢转入增殖培养基中继续进行增殖培养。
3 培养条件
3.1培养基
芽诱导培养基:MS+6-BA1.0mgL-1(单位下同)+NAA0.2。
分化增殖培养基:
MS+6-BA0.8+NAA0.4(1)
MS+6-BA0.8+NAA0.4+肌醇15(2)
MS+6-BA0.8+NAA0.1(3)
MS+6-BA0.4+NAA0.4(4)
MS+6-BA1.5+NAA0.4(5)
生根培养基:1/2MS+IBA0+NAA0.05
本试验以MS为基本培养基。培养基中均附加3%蔗糖和0.6%琼脂,PH5.8,培养室温为23~28℃,光照度为1500~2000Lx,启动培养和分化增殖培养的光照时间为12hd-1,生根培养的光照时间为12hd-1、14hd-1、16hd-1。
4 无菌培养
4.1 芽的诱导与丛生芽培养
芽在诱导培养基MS+6-BA1.0mgL-1+NAA0.2中培养20d后开始萌动,伸长成无菌苗。培养超过30d后,长成3~6cm高的大量丛生芽。将无菌绿苗剪切成2cm左右的茎段,转接到激素含量不同的增殖培养基中培养,生长增殖结果见表2。
4.2 根的诱导
继代增殖培养的2~5cm高的无根幼苗切成单株后转入生根培养基+6-BA0.2+NAA0,生根培养的光照时间为12hd-1、14hd-1、16hd-1。培养7d后在不定芽的基部开始有不定根突起,15d后大部分不定芽均有根长出,生根率达90%~100%,30d左右每个小芽可发根4~8条形成幼苗,生根情况见表3
5 炼苗与移栽
生根苗培养30d后,苗长到5cm高时,把瓶盖揭开一半,往瓶里倒少许自来水,以防培养基抽干,驯化3d后,再把瓶盖全部揭开,再驯化一周之后,取出生根苗,用水洗去全部培养基,移栽到营养杯中,营养杯中的营养基质为肥沃熟表土+草炭土+铁矿尾砂,比例为:4:3:3。将营养基质用高锰酸钾消毒。培养苗移栽至培养杯后浇透定根水,上搭遮阴网,栽培环境温度控制在17℃~27℃,相对湿度为90%,1周喷1/2MS大量元素营养液1次。30d后,苗的成活率可达97%。
6 结果与分析
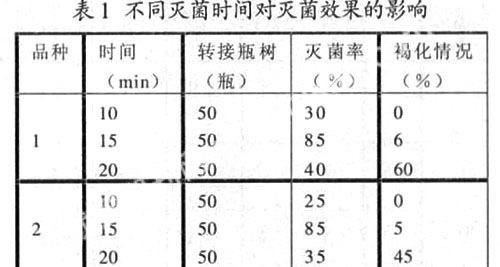
6.1 不同灭菌时间对灭菌效果的影响
用0.1Hgcl2对两个试验品种的外植体进行10min、15min、20min的灭菌,结果见表1。

从表1 可以看出,这两个品种的1年生茎段的灭菌时间15min效果较好,灭菌率在80%以上。试验中发现,灭菌时间短,杂菌不能全部杀死就会造成污染,而灭菌时间超过15min,两个品种的茎段及腋芽除污染外,大部分褐化,虽培养了较长时间也未见萌动。
6.2不同培养基对芽的分化增殖的影响
将诱导成功的无菌绿苗剪切成2cm左右的茎段转接到激素含量、营养物质不同不同的培养基中进行增殖培养,生长、增殖情况见表2。
由表2可以看出,1号培养基MS+6-BA0.8+NAA0.4和2号培养基MS+6-BA0.8+NAA0.4+肌醇15中培养的无菌苗增殖系数高,并且无菌苗长得较为粗壮。尤其是2号培养基,自2005年10月对无菌苗进行大量增殖培养后,用2号培养基重复继代培养2005年春季的诱导分化成功的无菌苗,苗的增殖系数始终保持在9.0 以上,生长状况稳定,未见发生变异,生根状况良好。与每年新诱导分化成功的新的无菌苗的增殖生长情况无差异。而未加肌醇的培养基中的无菌苗,随着继代次数的增加,组培苗的分化系数呈下降趋势,长势弱于2号培养基中的组培苗。这说明肌醇有利于欧洲花楸的组培苗增殖。5号培养基MS+6-BA1.5+NAA0.04虽然分化系数最高,但丛生苗过于细弱,幼苗生长无力,试管苗有玻璃化现象。3号培养基MS+6-BA0.8+NAA0.1中苗生长无力,叶色发黄、落叶。4号培养基MS+6-BA0.4+NAA0.4中无菌苗的增殖系数低,不利于增殖分化。可见,6-BA浓度低时,增殖系数低,而6-BA浓度高时,增殖系数高,但容易形成大量弱丛生苗,不能用于下一步的分化、生根培养;6-BA浓度过高时,茎基部会产生大量愈伤组织,试管苗发生玻璃化现象,影响分化。所以说,2号培养基MS+6-BA0.8+NAA0.4+肌醇15是欧洲花楸增殖分化的最适培养基。
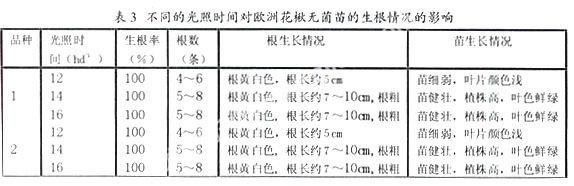
6.3不同光照时间对欧洲花楸无菌苗生根的影响
2~5cm高的丛芽切成单株后转入生根培养基1/2MS+IBA0.5+NAA0.05中,生根培养的光照时间为12hd-1、14hd-1、16hd-1培养,无菌苗的生根情况见表3。
由表3可以看出,在相同的生根培养基中,光照时间在14小时以上,生根苗的根系生长好,植株长高,健壮、叶色鲜绿(见图片二),移栽成活率超过90%。光照14hd-1与光照16hd-1的生长情况无差异,从节约能源角度出发,生根时的光照时间为14hd-1即可。
7 结论
7.1 对1年生、尚未萌动的带侧芽茎段消毒的时间以15min较好,灭菌率在80%以上。
7.2 激素浓度与营养物质影响芽的分化率与增殖系数,每千克激素浓度相同的培养基中加入15g肌醇可使经过多次继代培养的无菌苗的增殖系数仍保持在9以上。初步筛选出芽分化增殖阶段的最适培养基为MS+6-BA0.8+NAA0.4+肌醇15;
7.3 在生根培养基诱导生根培养阶段光照时间在14小时以上,有利于根系的生长。苗壮,苗移栽成活率高。
通过四年的欧洲花楸组培扩繁试验,虽然获得了一些有成效的经验,为加快欧洲花楸组培扩繁和推广速度具有一定的参考意义。但仍有需要完善和进一步探索的地方,如:在增殖分化培养基中加入肌醇对增加增殖系数的最佳量及作用机理还需做深入的探索、研究。
参考文献
[1]曹孜义刘国民 实用植物组织培养技术教程(1996)。
[2]周丹宿宗艳 欧洲花楸应用价值的探 讨中国林副特产,90(5):83.
[3]马东菁叶景峰 贴梗海棠组织培养技术研究初报辽宁林业科技,213(4):51.
[4]韩文忠马兴华 欧洲花楸组织培养与快速繁殖试验研究中国林副特产,82(3)21.

