接种量对泔脚发酵产氢余物甲烷化的强化研究*
蒲贵兵,王胜军,孙可伟
(1.重庆市市政设计研究院,重庆 400020;2.昆明理工大学固体废弃物资源化国家工程研究中心,云南 昆明 650033)
近年来,有机物的发酵制氢技术得到了众多研究者的青睐。然而,即使通过人工强化技术也难以突破30%的COD能量转化效率[1]。因此,发酵产氢结束后,原料中的有机质大多仍然残留在发酵产氢余物中。泔脚的发酵产氢过程会产生大量的VFA,这些酸又可以被光合细菌利用而产生Hz或被产甲烷菌利用产生CH4,从而提高生物制氢系统的能源化能力。然而,相对产甲烷过程,光合产氢过程由于需要光能而难于控制。另外,利用厌氧生境中产氢菌与嗜氢菌的互营协作关系[2]实现VFA的沼气化利用,似乎更具现实意义。Gomez等[3]对以有机固体废弃物及屠宰场废弃物为发酵底物的二阶段(产氢、产甲烷)生物制氢进行了研究(高温活性污泥为接种物):发酵产氢过程中产生的发酵液被后面的产甲烷过程稳定,发酵液被甲烷化而进一步分解。
接种量是指移入的接种物液体体积(或质量)和接种后发酵液体积(或质量)的百分比[4]。在厌氧消化中,接种量对消化过程会产生极大的影响[4-5]。Yadvika等[6]研究表明:当VFA(以乙酸计)浓度超过2 000 mg/L时,就会对产甲烷菌产生毒性抑制,导致产气量下降。以泔脚发酵产氢余物为沼气发酵的底物,由于其特殊性(余物中含有大量的产氢菌及VFA),接种量对其沼气化过程的影响就表现的有其特殊性。接种量过小,产甲烷菌成为体系优势菌群所需要的时间较长,而导致发酵起始时间延长,且VFA会对甲烷化过程产生剧烈的抑制作用,故小接种量有可能会导致发酵启动的失败;接种量过大,反应器利用率过低,且微生物生长的营养物不充分。适宜的接种量有利于微生物的生长,使产气加快[7]。因此,在泔脚发酵产氢余物的沼气化中,每批料都要进行接种,在工艺上要确定最佳接种量。本文以厌氧消化污泥为接种物,对泔脚发酵产氢余物的批式发酵产甲烷进行研究,旨在探讨不同接种量对泔脚发酵产氢余物甲烷化的影响。
1 实验材料与方法
1.1 实验材料
实验原料泔脚发酵产氢余物来自昆明理工大学固体废弃物资源化国家工程研究中心城市生活垃圾厌氧消化实验室。接种物为实验室培养成熟、在常温下已静置2月的城市生活垃圾厌氧消化污泥(表1)。
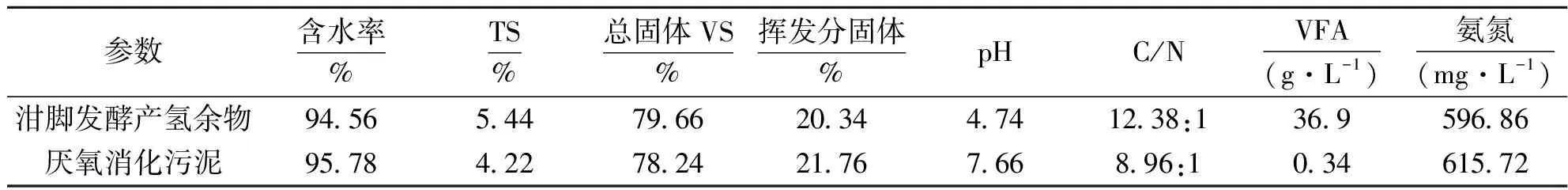
表1 泔脚发酵产氢余物及厌氧消化污泥的基本性质
1.2 实验装置
泔脚发酵产氢余物甲烷化实验采用有效容积为2 000 mL的放水瓶作为反应器。恒温水浴加热,温度控制仪(TFD型,上海仪川仪表厂)控制温度(温度波动范围为36±1 ℃),如图1。采用排水法收集气体,集气筒外表有刻度线,其有效容积为3 200 mL。气体收集装置的水为5%稀硫酸酸化的饱和NaCl溶液(约pH3.5),其主要功能为:截留生物气中大部分水蒸气、降低CO2的溶解度、保持厌氧反应器的稳定压力、水封作用。实验中根据集气筒浮出液面的刻度读数,乘以集气筒的横截面积,就可以得到发酵产生的生物气的体积。
1.3 实验方案
将泔脚发酵产氢余物与接种物按15%(500.0mL产氢余物+88.0mL接种物)、30%(500.0mL产氢余物+214.3mL接种物)、45%(500.0mL产氢余物+409.1mL接种物)、60%(500.0mL产氢余物+750.0mL接种物)的接种量进行配料,与4个反应器中进行中温(36±1℃)批式发酵产甲烷。实验过程中每天摇瓶搅拌一次,共2min。另作2组平行实验,数据取其平均值。
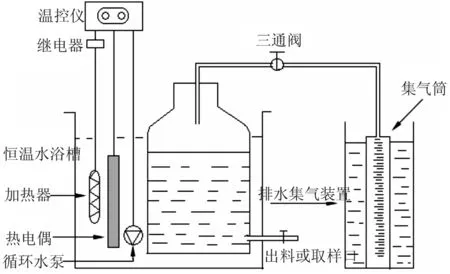
图1 发酵产氢余物发酵产甲烷实验装置
1.4 分析方法
TS、VS的测定采用烘干法[4]。pH值采用PHB-5型笔式数字pH计测定,每次使用前利用标准溶液进行校正。
生物气(Biogas)成分的测定采用QF-1904型气体分析仪(上海申立玻璃仪器有限公司)和气相色谱仪(TCD检测器,不锈钢色谱柱,载气N2,流速为90 mL/min,生物气产量少时采用气相色谱法测定)测定。
总挥发性脂肪酸(VFA)采用蒸馏滴定法[4](以乙酸计)测定;VFA组分如乙酸、丙酸、丁酸等采用气相色谱仪(FID检测器,不锈钢色谱柱,载气N2,流速为40 mL/min)测定。
1.5 数据处理
(1)累积产气量和产气速率的计算。 实验采用排水集气法收集气体,实验中累积产气体积为:
VB,i=VB,i-1+(VG,i-VG,i-1)
(1)
式中,VB,i、VB,i-1为第i次和(i-1)次测气时累积产气的体积(mL);VG,i、VG,i-1为第i次和第(i-1)次测气时的排水的体积(mL)。
产气速率=(VB,i-VB,i-1/(t1-ti-1)
(2)
式中,ti、ti-1为第i次和(i-1)次测气时的时间(h)。
(2)累积产甲烷体积的计算[8]。
VH,i=VH,i-1+GH,i(VG,i-VG,i-1)+
VH(CH,i-CH,i-1)
(3)
式中,VH,i、VH,i-1为第i次和(i-1)次测气时累积甲烷的体积(mL);VH为反应器的顶空体积(mL);CH,i、CH,i-1为第i次和(i-1)次测气时甲烷的体积浓度(%)。
(3)产甲烷数学模型及数据处理方法。对实验结果用改进的Gompertz模型[9]进行非线性拟合(公式(4))并对产气数据进行式⑸-⑺的计算。用CurveExpert1.3软件,进行非线性回归,求得Gompertz模型的动力学参数。
(4)
式中,H为累计产甲烷量(mL);P为 最大甲烷量(mL);Rm为最大产甲烷速率(mL/h);λ为细菌产甲烷的延迟时间(h);e为自然对数。
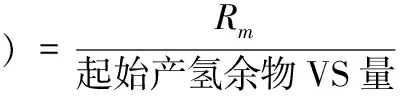
(5)

(6)
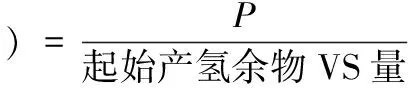
(7)
公式(5)-(7)中的甲烷产出量均以挥发分的产出量来度量,以下均同。
2 结果与讨论
2.1 不同接种量对发酵产氢余物沼气化产气的影响
图2和3分别为不同接种量下泔脚发酵产氢余物沼气化的累积产气量、产气速率的变化曲线。由图2及3可知:①在本实验条件下,随着接种量的增加,泔脚发酵产氢余物沼气化过程的累积产气量及产气速率也随之增大。②在15%的接种量下,产沼过程失败,这可能是低接种量下体系过高的VFA浓度使产甲烷菌中毒所致。③在30%及45%的接种量下,尽管体系具有一定的产沼能力,但却需要较长的延迟时间产气才能顺利启动。④在60%的接种量下,体系具有较好的产气能力。下面对60%的接种量下的产气进行详细的分析。
在该实验的60%的接种量下(图2),由于接种污泥有一个活性恢复和对底物的适应过程,因此其累积产气量曲线出现了一个适应期,之后,体系迅速产气,在第9天即达到稳定,以后的消化时间内产气量变化已趋于平稳,不再快速变化,累积产气量稳定增加,在第14天左右时,累积产气量增加较少,说明60%接种量下的厌氧消化在前14天基本完成。同时,还可以看出,沼气化过程可以分成与微生物生长相一致的四个阶段:延迟期、沼气指数增长期、产沼稳定期、产沼衰减期[10]。
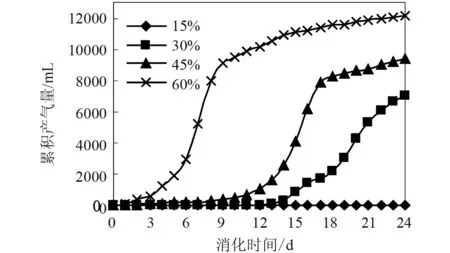
图2 不同接种量下的累积产气曲线
从图3的产气速率曲线可以看出:①在本实验条件下,产气速率先迅速增加(第8天左右出现峰值),而后降低,最后趋于稳定。②各阶段的时间划分并不是很明显,原料进入反应器后,在不产甲烷菌的作用下完成进一步的酸化过程(大约需4天),产气速率开始缓慢增加,并进入产甲烷阶段,并有峰值的出现,说明此时产甲烷菌是优势菌。此后,产气开始下降而趋于停止。这个消化过程说明消化体系中各微生物之间存在着相互协调、相互制约的关系[11]。
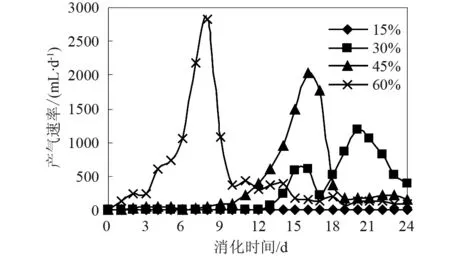
图3 不同接种量下的产气速率
2.2 不同接种量对泔脚发酵产氢余物沼气化产甲烷的影响
不同接种量对泔脚发酵产氢余物沼气化产甲烷的影响见图4-6。由图可以看出,在本实验条件下,① 15%的接种量不能启动产沼过程,而30%、45%、60%的接种量均能启动厌氧消化过程。② 然而,30%、45%的接种量却表现出较低的产沼潜力。接种量过低时(OLR过高),一方面,发酵体系内的絮凝体颗粒内物质的传质速率并无发生明显变化,造成底物转化不完全。另一方面,接种量过低也引起细菌细胞内总有机酸积累,从而抑制产甲烷菌的产甲烷能力。③ 较高的接种量(60%)表现出较大的产甲烷促进作用。④ 生物气中甲烷的最高体积含量分别为:0%、79.4%、79.4%、80.4%。在顺利启动产甲烷过程下,生物气中甲烷的最高体积含量高于传统厌氧消化甲烷的最高体积含量(75%[4]),这可能是如下原因综合作用的结果:① 本实验的消化底物为泔脚发酵产氢余物,含有大量的VFA,从而具有较高的产甲烷潜力;② 随着消化过程的进行,VFA被大量消耗,反应所产生的CO2溶入液相补充体系由于VFA的消耗而损失的部分酸度,这可由后面的表3得到验证;③ 接种物中含有的碱性物质中和部分CO2。
从图5可以看出:沼气中CH4含量的变化可以分成与产甲烷菌生长相一致的四个阶段:延迟期、沼气指数增长期、产沼稳定期、产沼衰减期[11]。在消化前期,沼气中甲烷的体积含量迅速增加,其原因可能为:① 消化初期,营养充足,产甲烷菌的活性较强,且产甲烷菌的数量随着VFA的消耗而大大增加[12]。相对图6可知:在第8天时,产甲烷菌的增长速率达到最大值。② 反应生成的挥发性酸(乙酸)及NH3、CO2等溶入液相,而CH4难溶。③ 发酵底物的固含率(TS)较大,液相浓度高,而使CH4进入液相的比例更小。
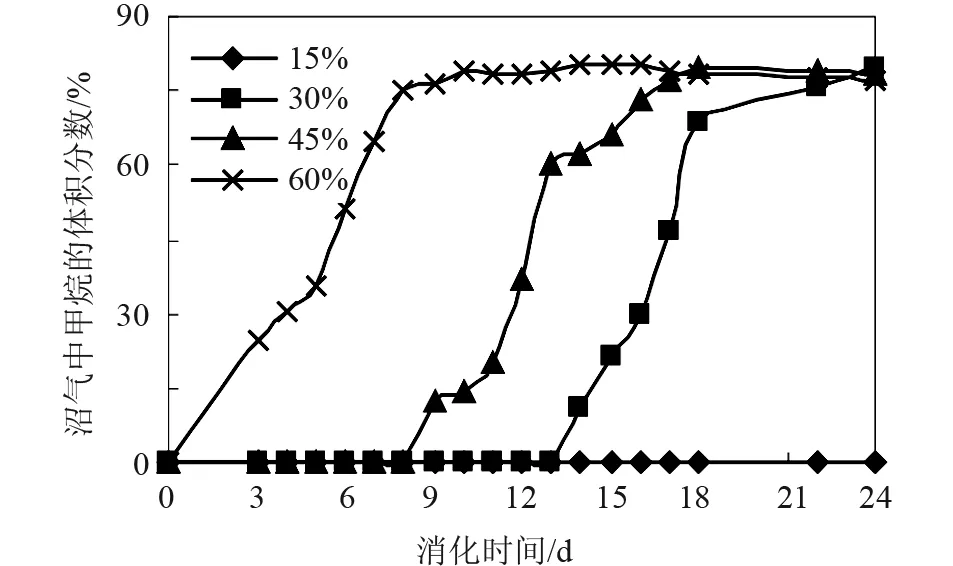
图4 不同接种量下的生物气中甲烷的体积含量
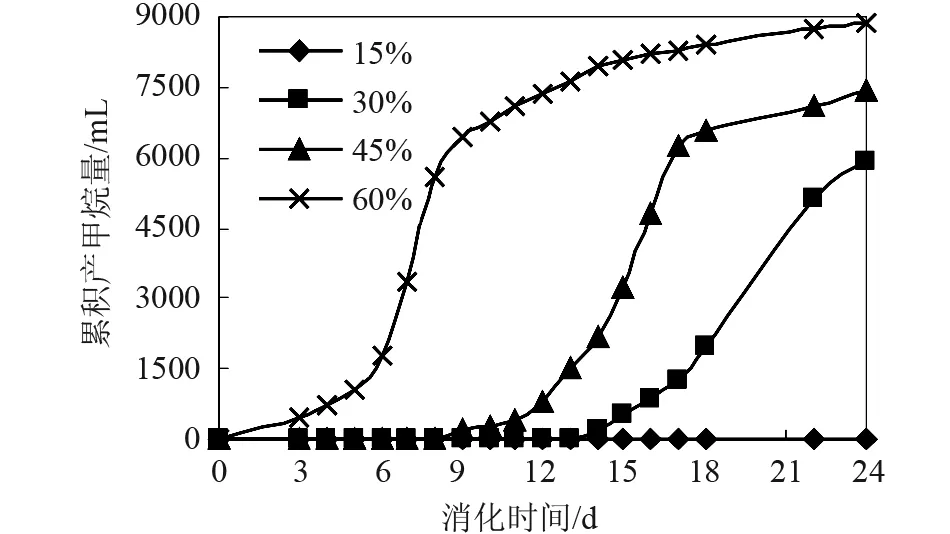
图5 不同接种量下的累积产甲烷量
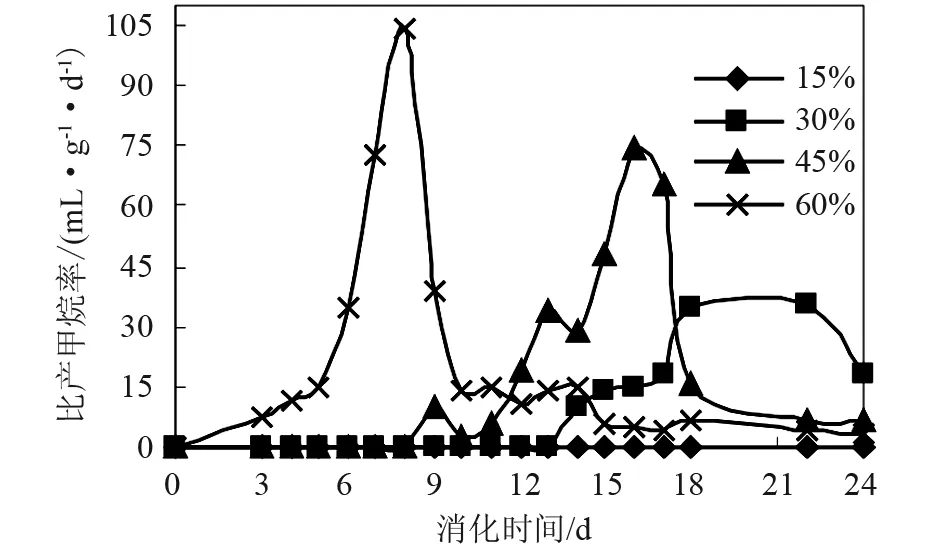
图6 不同接种量下的比产甲烷率
然而,在消化后期,甲烷的体积含量却有所下降,其原因可能为:① 在消化后期,由于有机物被降解使产甲烷菌的营养物不足而进入死亡期,从而使产气量(CH4)下降;② 产CH4量的下降,使体系的气液平衡被破坏,而使残留的NH3、CO2等进入气相,使沼气中CH4的含量进一步降低;③ 在消化后期,随着底物的降解,发酵底物的TS变小,液相浓度降低,而使CH4进入液相的比例增大。④ 消化底物中的难降解有机物(如脂类等)缓慢降解而产生一定量的甲烷。
对图5用CurveExpert1.3软件,进行非线性回归,可求得Gompertz模型的动力学参数如表2所示。
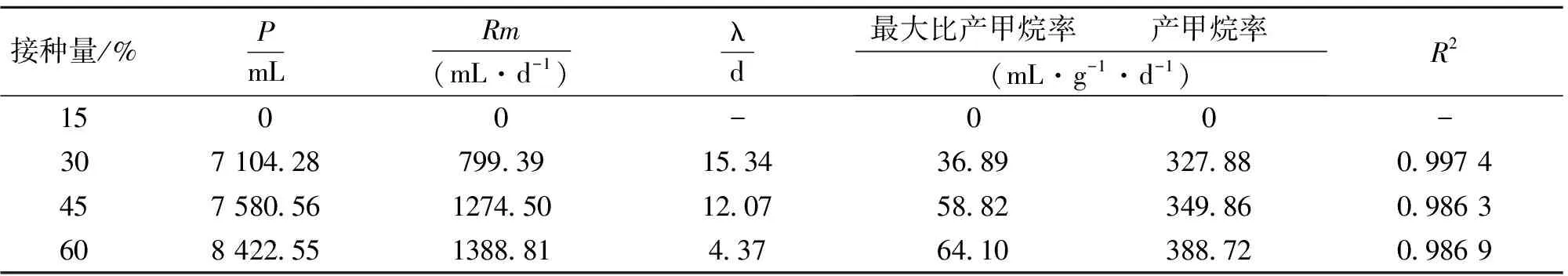
表2 不同接种量下的发酵产甲烷动力学参数
由图2-6及表2可以看出:
(1)过低的接种量(15%)下产沼过程不能顺利进行。这可能是由于小接种量(或OLR过大)下,产甲烷菌受体系VFA的强烈抑制所致。
(2)在接种量为30%、45%、60%下,30%的接种量表现出较差的产甲烷能力,而45%、60%的接种量则表现出较大的促进作用。这可能是由于大接种量下接种物中含有大量的水解酶,且还可以缩短反应器中微生物到达产气高峰所需要的时间,使底物降解速度加快;并且,大接种量下,体系所含有的碱度对VFA有一定的中和能力,不需要pH值调节就可以使反应顺利进行[13]。
(3)从最大产甲烷量P或产甲烷率来讲,接种量为60%的P分别比接种量为30%、45%的提高了18.56%、11.11%。
(4)从延迟时间λ来讲,接种量为60%的λ比接种量为30%、45%的分别缩短了71.51%、63.79%。这可能是由于各反应器的接种量不同,产甲烷菌的数量和活性存在着较大的差异,因而它们适应环境的能力也不尽相同,从而它们的λ也不同。
(5)从最大产甲烷速率(Rm)或最大比产甲烷率来讲,接种量为60%的Rm比接种量为30%、45%的分别提高了73.73%、8.97%。然而,本实验结果(60%接种量)下的产甲烷率却比Dawei等[14]的研究结果低,这可能是消化底物及发酵条件的差异性所致。
从实验结果看,接种量为60%的效果最好。此时,尽管接种量已经超过发酵底物的量,但消化过程并非共消化过程。这是由于本实验所用接种物为实验室培养成熟的在常温下已经静置了2个月的城市生活垃圾厌氧消化污泥,其本身已经不再具备产甲烷潜力。故本实验条件下的产沼量可以理解为泔脚发酵产氢余物的单独贡献。
2.3 沼气化前后的pH值变化
表3为不同接种量下泔脚发酵产氢余物沼气化前后的pH值变化。由表3可以看出:① 尽管在15%接种量下,产沼过程失败了,然而,发酵液的pH值却有较大幅度的上升,这可能是在发酵过程中,接种物中所含有的特殊微生物将VFA等较强酸转化成了酸性更弱的酸(如乳酸、聚乳酸等)或者发生了更为复杂的反应,但这还有待进一步的研究。② 在成功启动沼气化的30%、45%、60%的接种量下,沼气化结束后,厌氧消化余物的pH值在6.70~7.00之间,在甲烷发酵的最佳pH值范围(6.8~7.4[4])内,具有较大的相似性。从表1的数据可以看出,厌氧消化污泥的pH值达7.66,而泔脚发酵产氢余物的pH值却为4.74,当两者按60%的接种量混合时,尽管大接种量可以对泔脚发酵产氢余物进行pH调节,提高其pH值,但其pH调节效果并不是很明显,经理论计算混合后体系的pH也只有5.2左右。而发酵结束后(60%接种量),体系的pH却上升到了6.86,这也说明了本实验下的产甲烷过程是体系VFA消耗的结果。然而,接种物中含有大量的碱性物质(表1),体系VFA的消耗并未使消化液显碱性,这说明了消化反应所产生的CO2部分溶入液相补充了体系由于VFA的消耗而损失的部分酸度,这也为沼气中甲烷的高体积含量提供了证据。
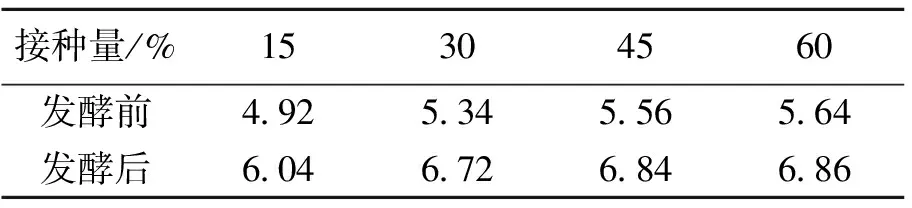
表3 不同接种量下泔脚发酵产氢余物沼气化前后的pH值
2.4 接种量影响泔脚发酵产氢余物甲烷化的理论分析
假设消化反应器内发酵底物完全混合,则此时甲烷的产量为[15]:
(8)
式中,Y为甲烷的生成速率(mL·d-1);R为理想气体常数(=8.314J/(mol·K));T为反应器中的温度(K);V为反应器的体积(mL);
Yc为产甲烷菌的产率系数(g·g-1);μ为产甲烷菌的比增值速率(d-1);X为反应器内产甲烷菌的质量浓度(g·mL-1)。
而比增值速率μ为[16]:
μ=μmaxS/(KS+S)
(9)
式中,μmax为产甲烷菌的最大比增值速率(d-1),常数;S为残留限制性基质浓度(g·mL-1);Ks为半速系数,表示基质被生物同化的程度。
由式(8)、(9)可得:
(10)
在实验条件一定时,式(10)中R、T、V、Yc、KS、μmax均为常数。故甲烷的生成速率Y仅与反应器内产甲烷菌的质量浓度及基质浓度有关。在泔脚发酵产氢余物的甲烷化中:一方面随着接种量的增大,反应器内产甲烷菌的质量浓度也随之增大;另一方面,接种量越大,同等条件下,发酵的底物就越少,基质浓度也就越小。因此,随着接种量的增大,甲烷的生成速率也随之增大。本实验中,以60%接种量下甲烷的生成速率最大(图6)。
3 结 论
不同接种量对泔脚发酵产氢余物沼气化的影响实验表明:
⑴ 过低的接种量(15%)不能顺利启动泔脚发酵产氢余物的沼气化过程;而较高的接种量(30%、45%、60%)均能启动产沼过程,且产沼能力随着接种量的增大而增强。
⑵ Gompertz模型拟合结果表明:接种量为30%、45%、60%的泔脚发酵产氢余物沼气化的延迟时间λ、最大比产甲烷率、产甲烷率、生物气中甲烷的最高体积含量分别为:15.34、12.07、4.37 d,36.89、58.82、64.10 mL/(g·d),327.88、349.86、388.72 mL/g,79.4%、79.4%、80.4%。故60%的接种量表现出更大的产甲烷优越性。
⑶ 消化结束后,除产沼过程失败的15%接种量以外,厌氧消化余物的pH值在 6.70~7.00之间,这主要是由于消化反应所产生的CO2部分溶入液相补充了体系由于VFA的消耗而损失的部分酸度所致,这也为沼气中甲烷的高体积含量提供了证据。
参考文献:
[1] 郝晓地,可持续污水-废物处理技术[M].北京:中国建筑工业出版社,2006.
[2] 彭晶,王爱杰,任南琪,硫酸盐还原过程中氢分压的平衡与调节[J].哈尔滨工业大学学报,2004,36(10):1288-1291.
PENG Jing,WANG Aijie,REN Nanqi,et al. Balance and control of partial hydrogen pressure in the course of sulfate reduction[J]. Journal of Harbin Institute of Technology, 2004,36(10):1288-1291.
[3] GOMEZ X,MORAN A,CUETOS M J,et al. The production of hydrogen by dark fermentation of municipal solid wastes and slaughterhouse waste: A two-phase process[J].J P Sour,2006,157:727-732.
[4] 张记市.城市生活垃圾厌氧消化的关键生态因子强化研究[D].昆明:昆明理工大学,2007.
[5] VEEKEN A,HAMELERS B. Effect of temperature on hydrolysis date of selected biowaste components[J].Biores Technol,1999,69(3):249-254.
[6] YADVIKA,S,SREEKRISHNAN T R.Evnhancement of biogas production from solid substrates using different techniques-A review[J].Biores Technol,2004,95(1):1-10.
[7] 潘云霞,李文哲,接种物浓度对厌氧发酵产气特性影响研究[J].农机化研究,2004(1):187-189.
PAN Yunxia,LI Wenzhe.The effect of different inoculum's properties on the capability of biogas production[J].Journal of Agricultural Mechanization Research, 2004(1):187-189.
[8] LOGAN B E,OH S E I,KIM S,et al.,Biological hydrogen production measures in batch anaerobic pespirometes[J].Environ Sci Technol,2002,36:2530-2535.
[9] LAY J J,LI Y Y,NOIKE T.The influence of pH and ammonia concedtration on the methane production in high-solids digestion processes[J].Water Environ Res,1998,70(5):1075-1082.
[10] 蒲贵兵,甑卫东,张记市等,城市生活垃圾厌氧消化中甲烷产量的生物动力学研究[J].化学与生物工程,2007,24(7):55-59.
PU Guibing,ZHEN Weidong,ZHANG Jishi,et al. study on methane output in biologic dynamics during anaerobic digestion of municipal solid waste[J]. Chemistry & Bioengineering,2007,24(7):55-59.
[11] 胡纪萃,周孟津,左剑恶,等.废水厌氧生物处理理论与技术[M].北京:中国建筑工业出版社,2003.
[12] McMAHON K D, STROOT P G, MACKIE R I, et al. Anaerobic codigestion of municipal solid waste and biosolids under various mixing conditions—Ⅱ:microbial population dynamics[J]. Wat Res,2001,35(7):1817-1827.
[13] 李刚,杨立中,欧阳峰,厌氧消化过程控制因素及pH和Eh的控制分析[J].西安交通大学学报,2001,36(5):518-521.
LI Gang, YANG Lizhong, OU Yangfeng. Control factors of anaerobic digestion and effect of pH and Eh[J]. Journal of Southwest Jiaotong University,2001,36(5):518-521.
[14] LIU D W LIU D P, ZENG R J,et al.Hydrogen and methane production from household solid waste in the two-stage fermentation process[J].Wat Res,2006,40:2230-2236.
[15] 左剑恶,凌雪峰,王妍春,等.EGSB反应器的动力学模型研究(1)——模型的建立[J].中国沼气,2003,21(1):3-7.
ZUO Jiane,LING Xuefeng,WANG Yahchun,et al. A study on dynamic model of an EGSB reactor——Ⅰ: Modeling[J]. China Biogas,2003,21(1):3-7.
[16] 沈萍.微生物学[M].北京:高等教育出版社,2004.

