广州古廖涌生物修复的指示藻类*
李开明,谢丹平,陈晓宏,江 栋
(1. 武汉大学水利水电学院,湖北 武汉 430072;2.中山大学地理科学与规划学院,广东 广州 510275;3.环境保护部华南环境科学研究所,广东 广州 510655)
城市污染物的排放导致了城市河道的污染日益严重。尤其是沿海城市的感潮河道,水环境容量小、水体交换周期长,受富含有机物的生活污水和工业废水的污染后,水体COD、氮磷污染物浓度超标,底泥厌氧腐化,水体发黑发臭。城市河道的污染已严重影响了城市的形象和居民的健康生活。
目前,国内已逐步重视和开展了城市污染河道的治理工程和研究,并取得大量的成果,如广州、上海、北京等城市都采用不同技术进行了城市河道的治理工程[1-3]。目前所普遍采用的治理措施主要有截污、底泥疏浚、引水冲污、人工增氧、湿地处理、底泥生物修复、水体生物修复、生态化工程[4-5]等。在城市污染河涌的治理研究中,我们联合应用氧化塘和河道原位生物修复(包括底泥生物修复、水体人工增氧、生态恢复等)技术,从生物修复和生态恢复两个层面对广州市古廖涌进行了成功治理[1]。在治理工程中,发现随着河涌水体的逐步修复,污染物得到去除,水体透明度提高,由黑色变为黄绿色,生物多样性增加,形成稳定的好氧生态系统。
为对重污染城市河道治理过程中水生生态系统的变化进行研究,确定污染河道治理净化过程中水生生态结构的演变规律,确定反应不同河道治理程度的水生生态结构特征和指示生物,我们在对广州古廖涌进行有效治理的基础上,对不同治理阶段的河道水体进行污染物指标的化学监测和浮游藻类的定性定量观测,研究分析了河道水体生物修复过程中藻类群落结构、种类结构及优势种的变化规律,及其与水体污染程度的对应关系。
1 材料与方法
1.1 氧化塘修复
氧化塘采用古廖涌岸侧的鱼塘改造而成,由曝气塘、生化处理塘、生态塘三个塘串联组成。氧化塘处理规模4 320 m3/d,COD容积负荷0.11 kg/(d·m3),水力停留时间为1.4 d,曝气增氧量为26.4 kg/h。将古廖涌污水泵入曝气塘,经强化氧化后自流入生化处理塘,处理出水在塘中心沉淀区沉淀,上清液自流进入生态塘处理排放。氧化塘主要设备包括1台表面曝气机,6台水车增氧机。氧化塘平面图如图1所示。

图1 氧化塘平面布置示意图
1.2 河道生物修复
河道原位生物修复在模拟河道进行,河道分三格,每格长15 m,宽0.70 m,深1.20 m,底部铺0.10 m厚古廖涌底泥,有效水深0.80 m,每格河道水流量为6.0 m3·d-1,水力停留时间2 d。
河道原位生物修复处理措施:将氧化塘处理出水流(泵)入河道,对河道底泥进行生物强化氧化修复和水体生物修复,并对河道水体进行曝气增氧。
1.3 水样、生物样采集
分别对未修复处理的古廖涌水体、氧化塘处理出水、河道生物修复上游和下游水体等四个不同修复阶段的水体进行水样和生物样的采集,采样方法按照文献[6]方法操作。采样时间:11月2-22日;水温:22~23 ℃;天气:晴。
1.4 浮游藻类分析方法
对采集的生物样用φ=5%福尔马林固定,沉淀浓缩后在光学显微镜下进行定量和定性分析。
1.5 水质分析方法
根据文献[7]对水样CODcr、BOD5、NH3-N、TP、DO、透明度等水质指标进行监测。
1.6 生物多样性指数与均匀性指数计算
生物多样性指数(H)按Shannon-Wiener公式计算:
式中,S为种数;Pi为样品中第i个种的个体比。
均匀性指数E计算公式为:
E=H/log2S
2 结果与讨论
2.1 河涌污染修复的水质变化
对河涌水体各修复阶段的水质监测结果如表1所示,由表1可见,经过改造氧化塘—河道原位生物修复处理,河涌水体水质得到显著提高,水体有机污染大幅度降低,CODcr、BOD5去除率达到82.2%和74.3%,河道下游的CODcr、BOD5指标达到地表水Ⅴ类水质标准,氮磷也得到有效的去除,水体表观状况得到大大的改善,由黑色变为黄绿色。对河涌污染水体的修复措施,我们已经对利用废弃鱼塘改造成氧化塘进行处理的技术进行了研究和成功的应用[8],在此基础上,结合氧化塘处理,在河道下游对氧化塘出水采用底泥生物氧化、水体生物修复、水体增氧等措施进行河道原位生物修复,可达到进一步、显著的河道水质净化作用,由此可见,采用氧化塘+河道原位生物修复的技术对城市重污染河道进行治理是一项行之有效的方法,原位生物修复技术措施有待进一步的研究和报道。

表1 河道水体生物修复过程水质变化
2.2 河涌水体修复过程中藻类变化
水环境受污染后,必然影响水体中藻类固有的生物种群的数量和物种组成,因此,水体中藻类的群落结构、数量等的变化是反应水质状况的一项重要指标[9]。而水体受污染程度的不同,藻类的群落结构、种类的组成和数量、优势种都会表现出不同的特征。据此,对不同修复阶段河道水体的浮游藻类群落、种群结构、种类组成和优势种进行对比分析,确定反应河道不同修复程度的浮游藻类结构特征和指示种。
2.2.1 藻类群落、种类组成 在对不同修复阶段水体的藻类观测中,共发现浮游藻类6门92个种,其中蓝藻门(Cyanophyta)13种,绿藻门(Chlorophyta)56种,硅藻门(Bacillariophyta)10种,裸藻门(Euglenophyta)11种,隐藻门(Cryptophyta)和甲藻门(Pyrrophyta)各1种。
对藻类观测结果进行统计,统计计算结果如表2所示。由观测结果分析可知,随着水体的逐渐修复和污染程度的降低,浮游藻类的种类组成发生显著变化,在修复前,藻类群落有4门55个种,经氧化塘修复后出现6门63个种,河道修复上游5门54个种,河道修复下游共5门38个种;在四个不同修复阶段,绿藻种类数量相对最大,为藻类群落中的优势藻类,但随着水体修复程度的提高,蓝藻和绿藻的种类数量大大减少,而裸藻种类显著增加,硅藻种类维持在6种。以上变化的主要原因是在水体修复后,水体有机污染程度降低,耐重污染的种类减少,而适于在修复后水体中生长的裸藻种类逐渐增加,观测结果也表明,水华微囊藻(Microcystisflos-aquae)、铜绿微囊藻(Microcystisaeruginosa)、假鱼腥藻(Pseudoanabaena)、平裂藻(Merismopedia)、色球藻(Chroococcus)、油泥颤藻(Microcytismarginata)、纤维藻(Ankistrodesmus)、栅藻属(Scenedesmus)、鼓藻(Cosmarium)、四星藻(Tetrastrum)等耐污染藻类随着水体的修复而逐步消失。

表2 不同修复程度水体浮游藻类种类组成
2.2.2 藻类数量变化及优势种 对各藻类门的藻类数量进行统计计算,结果见表3。由表3分析可知,修复前河涌黑臭水体藻类主要为蓝藻和绿藻,其中蓝藻为绝对优势种群,有少量的硅藻和裸藻生长;随着水体的修复,藻类的群落结构发生演变,形成以裸藻为优势种群,绿藻、硅藻为次优势种群,蓝藻数量稀少的群落结构。在水体修复完成后,裸藻细胞密度达到藻类总细胞密度的40.2%,蓝藻降至7.8%,绿藻始终维持在30%~40%。由此可见,在河涌污染水体的修复过程中,敏感藻类为裸藻和蓝藻,其藻类细胞密度在藻类群落总密度中的组成比例很大程度上反应了水体的修复效果。
随水体的逐渐修复,藻类总密度逐渐减少,由修复前的2×107cell/L减少到3.0×106cell/L,这主要是因为水体修复后,水体有机污染程度降低,耐污染藻类数量大大减少,这与有关研究结论类似[10];同时,在河道生物修复过程中,河道水体中的浮游动物大量生长,出现大型的浮游动物(如微型裸腹蚤Moinamicrura),浮游动物的摄食也是导致藻类密度下降的原因之一。
对观测结果中各藻类种的密度变化分析可知,在水体修复前和氧化塘修复后藻类优势种均为平裂藻和小球藻(Chlorellavulgaris),河道生物修复上游优势种为绿色裸藻(Euglenaviridis)、小环藻(Cyclotella)、囊裸藻(Trachelomonas)、小球藻、棒胶藻(Rhabdogloea),河道修复下游为小环藻、绿色裸藻、囊裸藻、扁裸藻(Phacus)。
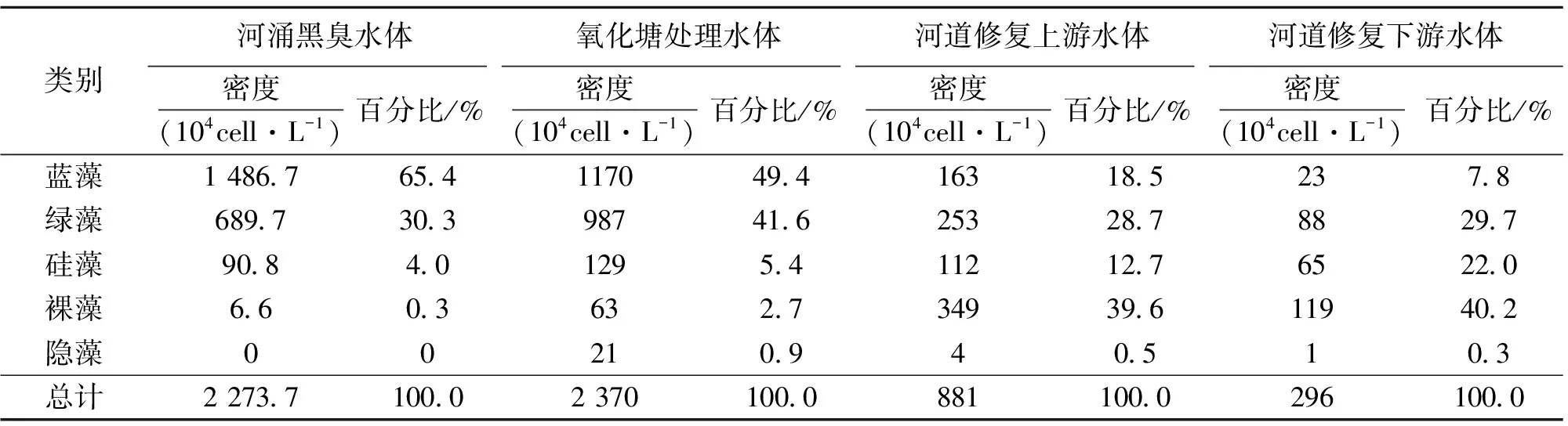
表3 不同修复程度水体浮游藻类数量变化
2.2.3 藻类群落生物多样性变化 采用Shannon-Wiener和均匀度指数对不同修复阶段水体的藻类群落生物多样性和均匀度进行分析,计算结果表明,河涌黑臭水体多样性指数为2.71,均匀性指数0.51,经过氧化塘、河道上游和河道下游修复后,水体多样性指数分别为3.56、3.94和3.84,均匀性指数分别为0.67、0.76和0.82。显然,水体得到修复后,藻类群落生物多样性提高,均匀度也增加,这与众多的研究成果相符合,水体污染程度越高,藻类群落生物多样性低,藻类种类单一,反之,群落多样性高,生物种类分布均匀。在水体修复前,水体中的藻类主要为耐污染的蓝藻和绿藻,水体修复后,硅藻、裸藻等其他藻类门种类和适应轻污染程度水体的藻类种及其密度增加。
2.3 河涌水体修复的藻类群落结构特征变化
浮游藻类群落结构特征指数的变化可在一定程度上反映环境的变化,并可作为评价水体水质的依据之一[11],通过分析确定不同修复程度河涌水体的藻类群落结构特征和种群结构特征,将为以浮游藻类作为河涌污染水体修复的监测手段提供理论依据。
根据以上对河涌水体不同修复阶段藻类观测结果的统计计算和分析表明,在不同修复阶段浮游藻类群落结构发生显著变化,随着水体水质的提高,藻类群落结构呈现有规律的变化和演替,群落结构由蓝藻型逐渐转变为蓝藻-绿藻型,最后形成裸藻型的群落结构特征,各藻类门的数量由修复前的高度单一逐渐变的均匀。
随着水体的逐渐修复,藻类的种群组成及其细胞密度也表现出明显的特征变化,蓝藻优势种由平裂藻转变为棒胶藻,细胞密度由107cell/L下降至105cell/L,种类大大减少;绿藻始终以小球藻为优势种,种类减少,但均匀度逐渐提高;硅藻相对细胞密度逐步增加,以小环藻为优势种;裸藻细胞密度大大提高,由105cell/L达到106cell/L,种类也由稀少增加至9种,优势种增加,由单一的绿色裸藻转变为绿色裸藻、扁裸藻、囊裸藻等多个优势种。
2.4 河涌水体修复指示藻类分析
根据藻类观测结果分析,在水体修复过程中,一些藻类种群的密度出现有规律的变化,在修复前,水体有机污染严重,出现大量的耐有机物污染种,水体修复中期耐污染种减少,出现中污染指示种类,修复完成后,水体开始出现轻污染指示种类。根据同类研究成果[10,12-13]以及在水体修复过程中细胞密度变化显著情况,确定河涌污染水体修复的指示种为:污染严重的河涌水体指示藻类主要有平裂藻、假鱼腥藻、具缘微囊藻(Microcystismarginata)、棒胶藻、小球藻、鼓藻、二形栅藻(Scenedesmusdimorphus)、四尾栅藻(Scenedesmusquadricauda)、二角盘星藻(Chlamydomonas)、四星藻、衣藻(Chlamydomonas)、小环藻、颗粒直链藻(Melosiragranulate)、菱形藻(Nitzschia)、蹄形藻(Kirchneeriella)、美丽胶网藻(Dictyosphaeriumpulchellum)、多芒藻(Golenkinia)、微芒藻(Micractinium);水体经过氧化塘修复后出现的主要指示藻类为色球藻、油泥颤藻、纤维藻、斜生栅藻(Scenedesmusobliquus)、蹄形藻、美丽胶网藻、多芒藻、微芒藻、四集藻(Palmella)、韦斯藻(Westellabotryoides)、四足十字藻(Crucigeniatetrapedia)、小桩藻(Characium)、链丝藻(Hormidiumflaccidum)、集星藻(Actinastrum)、针杆藻(Synedra)、绿色裸藻等藻类;水体经过河道生物修复进一步净化后,主要指示种为纺锤藻、绿色裸藻、梭形裸藻(Euglenaacus)、尖尾裸藻(Euglenaoxyuris)、囊裸藻、扁裸藻、鳞孔藻(Lepocinclis)。
3 结 论
(1)采用氧化塘—河道原位生物修复技术对河涌重污染水体进行修复后,可有效的去除水体污染物。修复后的水体有机污染程度显著降低,CODcr、BOD5去除率达到82.2%和74.3%,氮磷也得到有效去除,水体透明度大大提高,水体由黑色变为黄绿色,臭味消失。
(2)随着水体的修复,藻类的群落结构特征发生显著变化。在修复前和氧化塘处理出水等有机污染严重的水体中,以蓝藻和绿藻为优势藻类,裸藻、硅藻数量稀少;经过河道原位生物修复后,河涌水体水质大大改善,形成以裸藻、硅藻、绿藻为优势藻类的群落结构特征。
(3)水体修复后,藻类生物多样性和均匀度显著提高。藻类优势种由蓝藻门、绿藻门的平裂藻和小球藻转变为硅藻门和裸藻门的小环藻、绿色裸藻、囊裸藻、扁裸藻,耐有机污染和重污染种类减少,耐中、轻污染种类增加。
(4)通过河涌水体修复的指示藻类统计分析,确定了修复前、经过氧化塘修复、河道原位生物修复上游和下游等重污染河涌水体各个不同修复阶段的指示藻类。
参考文献:
[1] 李开明,刘军,江栋,等.古廖涌黑臭水体生物修复及维护试验[J].应用与环境生物学报,2005,11(6):742-746.
LI K M, LIU J, JIANG D, et al. Bioremediation and management of the Guliao river [J]. Chinese Journal of Applied and Environmental Biology, 2005, 11(6): 742-746.
[2] 黄燕,黄民生,徐亚同,等.上海城市河道治理工程简介[J].环境工程,2007,25(2):85-88.
HUANG Y, HUANG M S, XU Y T, et al. Brief introduction to urban river pollution purification and ecological restoration in Shanghai [J]. Environmental Engineering, 2007, 25(2):85-88.
[3] 申欢,孙亚军,胡洪营,等.滞留型城市景观河道的污染治理[J].中国给水排水,2006,22(20):66-68.
SHEN H, SUN Y, HU H, et al. Pollution control of detention landscape urban river [J]. China Water & Wastewater, 2006, 22(20): 66-68.
[4] 张捷鑫,吴纯德,陈维平,等.污染河道治理技术研究进展[J].生态科学,2005,24(2):178-181.
ZHANG J X, WU C D, CHEN W P, et al. Recent advances of the technology for polluted river treatment [J], Ecologic Science, 2005, 24(2): 178-181.
[5] HE S B, LI Y, KONG H N, et al. Treatment efficiencies of constructed wetlands for eutrophic landscape river water [J]. Pedosphere, 2007, 17(4): 522-528.
[6] 张志杰.环境生物监测[M].北京:冶金工业出版社,1990:132-151.
[7] 国家环境保护总局《水和废水监测分析方法》编委会,水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:200-285.
[8] 江栋,刘军,李开明,等.黑臭河道生物修复中氧化塘应用研究[J].生态环境,2005,14(6):822-826.
JIANG D, LIU J, LI K M, et al. The application of lagoon in the bioremediation of black-odor river [J]. Ecology and Environment, 2005, 14(6): 822-826.
[9] INÉS O, RUBEN J L, PAULA T P, et al. The assessment of water quality in the lower Luján river (Buenos Aires, Argentina): phytoplankton and algal bioassays [J]. Environmental Pollution, 2002, 120(2): 207-218.
[10] 高远,苏宇祥,亓树财.沂河流域浮游植物与水质评价[J].湖泊科学,2008,20(4):544-548.
GAO Y, SU Y X, YUAN S C. Phytoplankton and evaluation of water quality in Yi River watershed[J], Journal of Lake Sciences, 2008, 20(4): 544-548.
[11] CYNTHIA A G, JORGE A H. Variations of phytoplankton community structure related to water quality trends in a tropical karstic coastal zone [J]. Marine Pollution Bulletin,2006, 52(1): 48-60.
[12] 吴波,陈德辉,徐英洪,等.苏州河浮游植物群落结构及其对水环境的指示作用[J].上海师范大学学报:自然科学版,2006,35(5):64-70.
WU B, CHEN D H, XU Y H, et al. Phytoplankton community in Suzhou Creek and its role as water quality monitor [J]. Journal of Shanghai Normal University: Natural Sciences, 2006, 35(5): 64-70.
[13] 王新华,纪炳纯,李明德,等.引滦工程上游浮游植物及其水质评价[J].环境科学研究,2004,17(4):18-24.
WANG X H, JI B C, LI M D, et al. Phytoplankton and bio-assessment of water quality in upper waters of Yinluan project [J]. Research of Environmental Sciences, 2004, 17(4): 18-24.

