英红1号、英红9号和祁门茶树芽叶中嘌呤生物碱和茶多酚的HPLC-DAD-MS/MS分析*
卢嘉丽,王冬梅,苗爱清,杨得坡,陈建萍
(1. 中山大学药学院,广东 广州 510080;2. 广东省农业科学院茶叶研究所,广东 英德 513000;3. 香港大学中医药学院,香港)
嘌呤生物碱和茶多酚是茶Camelliasinensis叶中的主要活性成分,嘌呤生物碱主要是咖啡碱,一般占茶叶干质量的2%~4%;茶多酚则包括儿茶素类(黄烷醇类)、黄酮及黄酮醇类、花青素类及酚酸化合物等几大类,质量分数高达茶叶干质量的18%~36%[1],其中儿茶素类约为茶多酚总量的70%~80%。高效液相色谱法(HPLC)是茶多酚分离分析最常用的方法之一,但由于儿茶素类化合物结构相似,使用二级管阵列检测器(DAD)并不能准确有效地鉴定出各个成分,若连接质谱(MS)则能提供丰富的结构信息。英红1号、英红9号是广东省农科院茶叶研究所培育的适制红茶的大叶种优良茶树品种,祁门红茶为小叶种红茶品种,以其高香形秀享誉国内外。本文选取这3个红茶品种作为研究对象,采用HPLC-DAD-MS/MS技术对其芽叶中的嘌呤生物碱和茶多酚进行了定性和定量分析,从而比较这3个茶树品种在相同生长环境下芽叶中化学成分的组成特征。
1 材料与方法
1.1 材料
英红1号、英红9号和祁门红茶的芽叶均采自广东省农业科学院茶叶研究所茶园,按一芽三叶采摘后隔水蒸青5 min,80 ℃烘干,粉碎过40目筛,置于干燥器中贮存备用。
2种嘌呤生物碱对照品咖啡碱(CAF)和可可碱(TB)购自Sigma公司;8种儿茶素对照品(-)-没食子儿茶素(GC)、(-)-表没食子儿茶素(EGC)、(+)-儿茶素(C)、(-)-表儿茶素(EC)、(-)-表没食子儿茶素没食子酸酯(EGCG)、(-)-没食子儿茶素没食子酸酯(GCG)、(-)-表儿茶素没食子酸酯(ECG)、(-)-儿茶素没食子酸酯(CG)购自Nacalai Tesque Inc.(Kyoto, Japan),纯度均大于98%。超纯水(Millipore,USA),乙腈为色谱纯溶剂(TEDIA,USA),甲酸为市售国产分析纯试剂。
1.2 HPLC-DAD-MS/MS分析条件
Waters 600E高效液相色谱仪,配备Waters 600E四元梯度输送泵系统,Waters 717plus 自动进样器,Waters 2996光电二极管阵列检测器。Thermo Finnigan TSQ Quantum液相色谱-质谱联用仪,Surveyor光电二极管阵列检测器,Surveyor自动进样器,ESI/APCI离子源。
液相色谱条件:色谱柱Phenomenex Gemini C18(250 × 4.6 mm i.d., 5 μm),保护柱Phenomenex C18(4 × 3.0 mm i.d., 5 μm);流动相为乙腈(A)和φ=1%甲酸水溶液(B),A∶B的组成比从4∶96(0 min)线形上升为25∶75(60 min);进样量:10 μL;流速:1 mL/min;柱温:室温;DAD扫描波长范围:200~700 nm。
质谱条件:ESI离子化,正负离子同时检测;离子化电压:4 kV;喷雾电压:3.5 kV;鞘气压力:35 Arb;辅助气压力:11 Arb;毛细管温度:350 ℃;毛细管电压:35 V;m/z扫描范围:150~1 500 amu;MS2碰撞能量:35 eV。
1.3 供试品溶液、对照品溶液的配制及标准曲线的制定
取0.5 g茶样,精密加入50 mL乙腈-水(1∶1,体积比),室温下超声提取20 min,0.2 μm微孔滤膜过滤后备用。
精密称取对照品适量,用水溶解后定容,得到对照品混合溶液中TB、GC、EGC、CAF、C、EC、EGCG、GCG、ECG的质量浓度分别为0.04、0.04、1.02、0.53、0.05、0.48、3.05、0.04、0.46 mg/mL;将上述混合溶液继续稀释1.25、2.5、5、10、20倍,得到6个不同质量浓度的对照品溶液,每个质量浓度分别进样3次,以质量浓度(X)为横坐标,平均峰面积(Y)为纵坐标,绘制标准曲线,得到回归方程、相关系数及线性范围见表1,结果表明各化合物在测定范围内呈良好的线性关系。对此测定方法进行方法学考察,精密度、稳定性和重复性均在合格范围,各成分的平均加样回收率在97.11%~105.36%之间,RSD不大于3.11%。
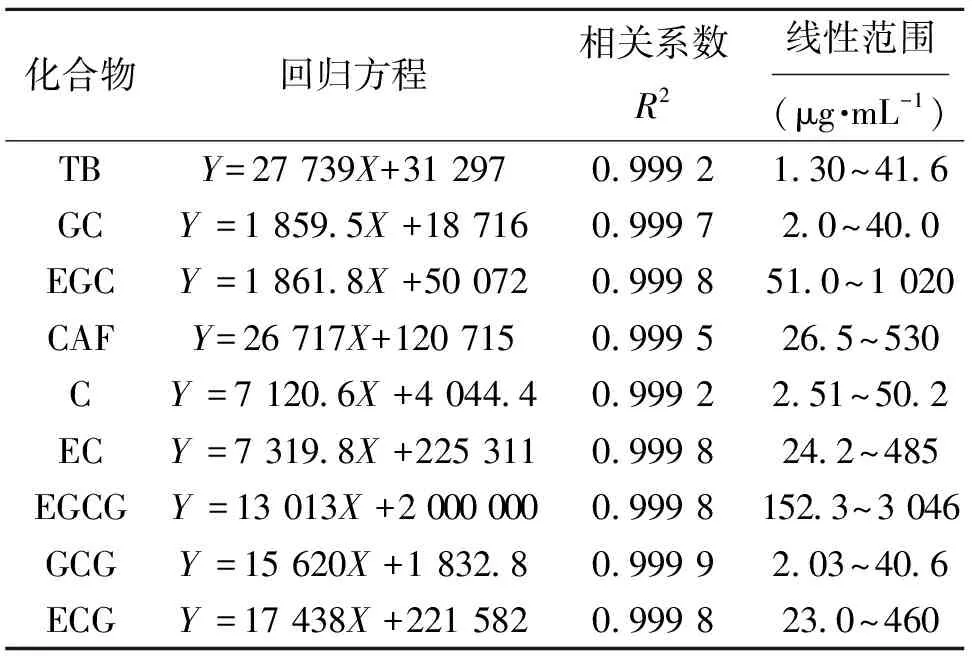
表1 嘌呤生物碱和儿茶素类化合物定量分析的回归方程、相关系数和线性范围
2 结 果
2.1 英红9号芽叶中嘌呤生物碱和茶多酚的定性分析
以英红9号为例,HPLC色谱图(275 nm)和正、负离子总离子流色谱图,儿茶素混合对照品的HPLC色谱图(275 nm)如图1所示。通过与对照品的保留时间、紫外吸收光谱以及质谱信息进行比较,并参考相关文献[2-5],鉴定出11个化合物,列于表2中,包括2种嘌呤生物碱可可碱和咖啡碱,7种儿茶素类化合物GC、EGC、C、EC、EGCG、GCG、ECG。此外,还鉴定出5-没食子酰奎宁酸酯(5-galloylquinic acid)和山柰酚-3-芸香糖苷(kaempferol-3-rutinoside)2种非儿茶素类茶多酚。
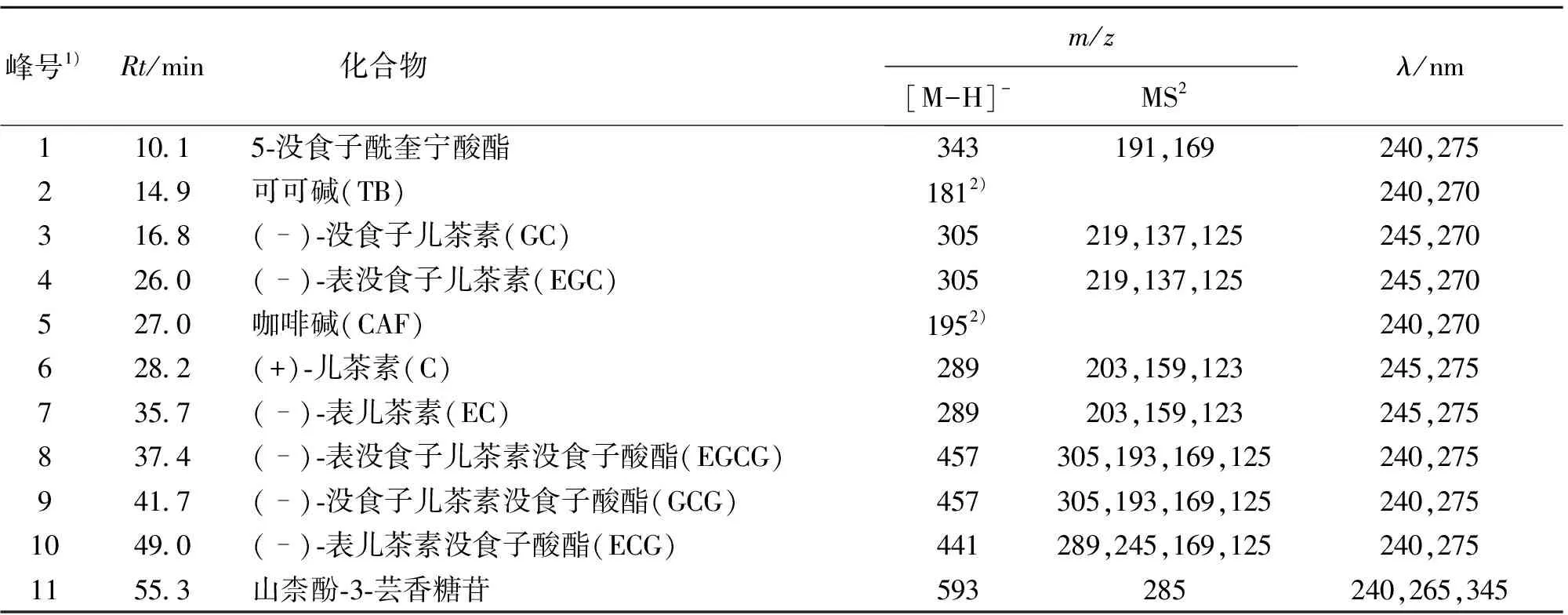
表2 英红9号芽叶中多酚类化合物和嘌呤生物碱的保留时间、紫外吸收及质谱特征
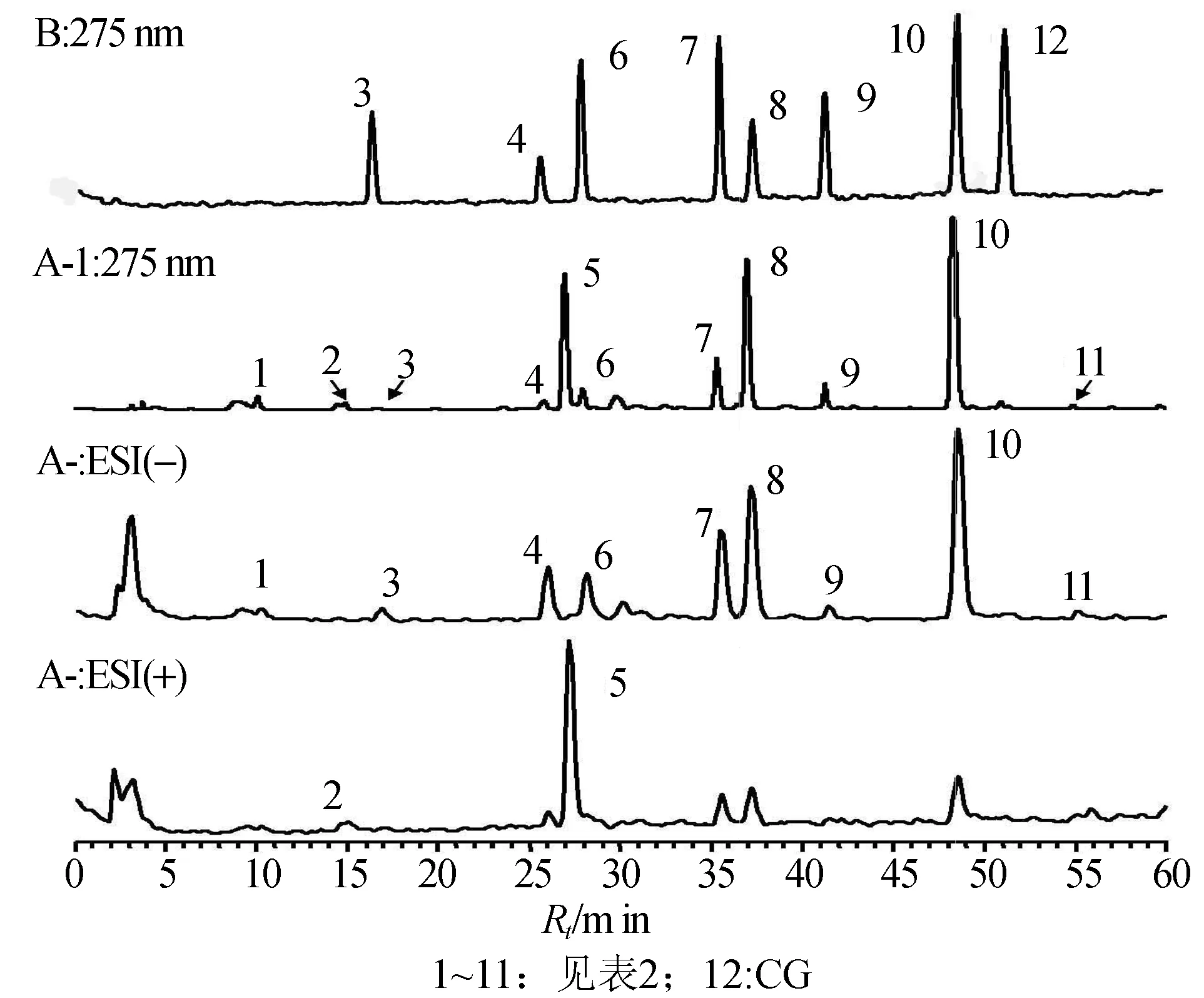
图1 英红9号芽叶(A-1~A-3)和儿茶素混合对照品(B)的HPLC-UV-MS色谱图
2.2 英红1号、英红9号和祁门茶树芽叶中嘌呤生物碱和儿茶素类成分质量分数的比较
英红1号、英红9号和祁门茶树芽叶的HPLC色谱图(275 nm)见图2,2个嘌呤生物碱和7个儿茶素类化合物的定量结果列于表3。英红1号、英红9号和祁门茶树芽叶中的嘌呤生物碱质量分数基本相近,可可碱约为0.2%,咖啡碱约为3%。这3个茶树品种的儿茶素类总量均大于20%,但相同儿茶素类化合物在不同品种之间的质量分数却有较大差异,其中英红1号和祁门比较接近,EGCG质量分数最高,分别为14.53%、10.64%。英红9号的儿茶素类成分组成比例较特殊,质量分数最高的不是EGCG(4.68%),而是ECG(8.65%);而且C(1.55%)、EC(3.4%)的质量分数也远远高于英红1号和祁门。
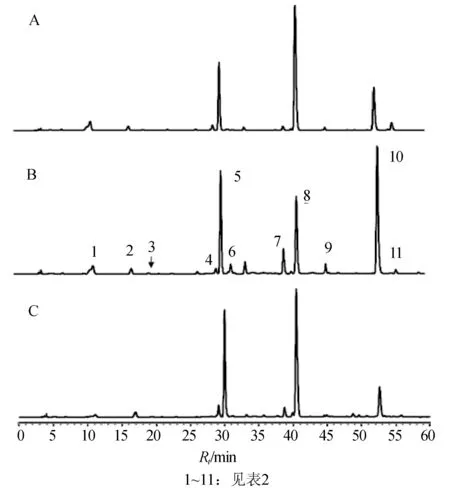
图2 英红1号(A)、英红9号(B)和祁门茶树(C)芽叶的HPLC色谱图(275 nm)
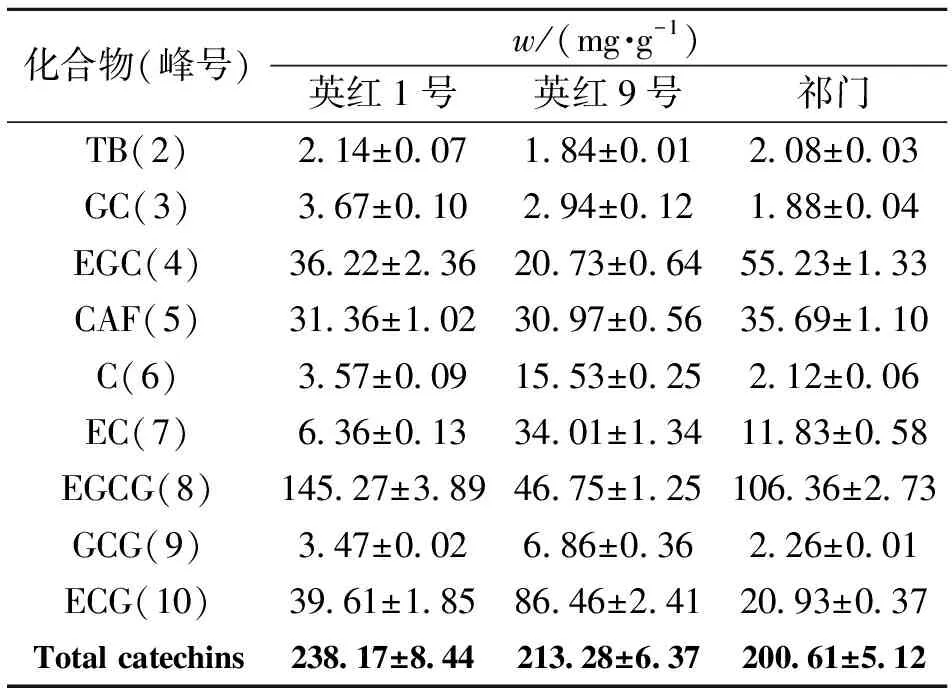
表3 英红1号、英红9号和祁门茶树芽叶中嘌呤生物碱和儿茶素类化合物的质量分数(n=3)
3 讨 论
通过HPLC-DAD-MS/MS分析,在英红1号、英红9号和祁门茶树芽叶中准确有效地鉴定出了2种嘌呤生物碱,7种儿茶素类化合物以及2种非儿茶素类茶多酚。英红1号是由阿萨姆种子经单株选育而成的无性系品种,英红9号是在云南大叶种有性后代中经单株选育而成的无性系品种,两者均是广东省农科院茶叶研究所选育而成的高产优质大叶红茶品种;祁门红茶品种原产地为安徽省祁门县。这3个红茶茶树品种虽然在同一个茶园环境下种植生长,但是芽叶中儿茶素类成分的质量分数和组成仍然反映出这3个品种的生化特性差异。英红1号和英红9号是大叶种C.sinensisvar.assamica,由于叶面积大,接受光照多,利于糖代谢,转化成多酚类也丰富[1],因此儿茶素类总质量分数均比小叶种C.sinensisvar.sinensis的祁门红茶品种较高。一般来说,茶叶中儿茶素类化合物的组成中以EGCG质量分数最高,远高于其它儿茶素类化合物,其次是ECG和EGC,但在云南大叶种中ECG的质量分数却高于EGCG,而且EC的质量分数也高于EGC[6-7]。茶叶中儿茶素的生物合成首先形成的是EC和C等非酯型儿茶素,再经过羟基化或没食子酰基化,才形成了没食子儿茶素和儿茶素没食子酸酯[1]。被认为保持了原始特性的云南大叶种因此含有较多的EC、C和ECG。本研究中英红9号的儿茶素类成分的组成也充分反映了云南大叶种的这一特性。
参考文献:
[1] 杨贤强, 王岳飞, 陈留记, 等. 茶多酚化学[M]. 上海:上海科学技术出版社, 2003.
YANG Xianqiang, WANG Yuefei, CHEN Liuji, et al. Chemistry of tea polyphenols[M]. Shanghai: Shanghai Scientific & Technical Publishers, 2003.
[2] ZHU Xiaolan, CHEN Bo, MA Ming, et al. Simultaneous analysis of theanine, chlorogenic acid, purine alkaloids and catechins in tea samples with the help of multi-dimension information of on-line high performance liquid chromatography/electrospray-mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2004, 34: 695-704.
[3] MIKETOVA P, SCHRAM K H, WHITNEY J, et al. Tandem mass spectrometry studies of green tea catechins. Identification of three minor components in the polyphenolic extract of green tea[J]. Journal of Mass Spectrometry, 2000, 35: 860-869.
[4] RIO D D, STEWART A J, MULLEN W, et al. HPLC-MSn analysis of phenolic compounds and purine alkaloids in green and black tea[J]. Journal of Agricultural and Food Chemistry, 2004, 52: 2807-2815.
[5] PELILLO M, BONOLI M, BIGUZZI B, et al. An investigation in the use of HPLC with UV and MS-electrospray detection for the quantification of tea catechins[J]. Food Chemistry, 2004, 87: 465-470.
[6] SAIJO R, KATO M, TAKETA Y. Compositions and contents of catechins in various kinds of fresh tea leaves—comparisons between Assam variety and China variety[M]. In Food Flavors and Chemistry, 274; The Royal Society of Chemistry, 2001: 183-196.
[7] 徐仲溪, 刘仲华, 王坤波, 等. 绿茶多酚和儿茶素提取与原料品质关系的研究[J]. 湖南农业大学学报:自然科学版, 2004, 3(3): 257-260.
XU Zhongxi, LIU Zhonghua, WANG Kunbo, et al. On relationship between green tea polyphenols and catechins and green tea raw materials [J]. Journal of Hunan Agricultural University:Natural Sciences , 2004, 3(3): 257-260.
——霜冻芽叶产品研发思路与实践
——基于全民健身视角*

