他莫昔芬对人肝癌细胞增殖及凋亡的影响
林 松 江 平 乔建国
(武汉大学 中南医院,湖北 武汉 430071)お
摘 要:目的:研究他莫昔芬对人肝癌细胞Hep3B增殖、凋亡以及雌激素受体(ER)表达的影响。方法:按他莫昔芬浓度分别为7.5、15、30mol/L分为3组,对照组为空白培养基,每组设10个平行孔,每孔加入细胞浓度为1×105个/mL的细胞悬液0.1mL,分别培养24、48及72h。采用MTT法测定OD值,计算细胞增殖抑制率;用RT-PCR方法在mRNA水平检测p21WAF1以及流式细胞术来观察细胞凋亡情况;用免疫组化方法观察他莫昔芬对Hep3B细胞雌激素受体表达的影响。结果:他莫昔芬抑制人肝癌细胞Hep3B增殖(P<0.05),并随其浓度及处理时间的增加而抑制率增加;他莫昔芬提高细胞凋亡率;他莫昔芬抑制雌激素受体的表达(P<0.05),促进p21WAF的表达。结论:他莫昔芬通过影响肝癌细胞ER和p21WAF的表达抑制肝癌细胞增殖。
关键词:肝癌;他莫昔芬;雌激素受体;凋亡;p21WAF
中图分类号:R735.7文献标识码:A文章编号:1673-2197(2009)03-0007-03
他莫昔芬(tamoxifen,TAM)又称为三苯氧胺,为非甾体类雌激素受体拮抗剂,此前主要应用于成人乳腺癌的预防及治疗,在肝癌的治疗上有一定的疗效,但存在很多争议[1]。本课题通过观察人肝癌细胞Hep3B细胞在他莫昔芬作用前后增殖活性和细胞凋亡情况的变化,雌激素受体(ER)阳性表达以及细胞周期蛋白依赖性激酶抑制物(CKI)之一p21WAF基因水平表达的变化,来研究他莫昔芬在肝癌治疗中的可行性及可能的作用机制。
1 材料及方法
1.1 材料
人肝癌细胞Hep3B由武汉大学基础医学院病毒学研究所提供;RPMI1640培养基购自美国Gibco公司;试验用他莫昔芬,即用型鼠抗人ER单克隆抗体及MTT购自美国Sigma公司,胎牛血清购自杭州四季青公司;青霉素购自华北制药公司;RT-PCR试验引物由上海生工合成,SP试剂盒及联苯二胺显色剂购自福州迈新生物技术公司。
1.2 方法
(1)细胞培养。将人肝癌细胞Hep3B细胞株常规培养于RPMI1640培养基中(加入10%胎牛血清及浓度为100U/mL的青霉素),置于37℃、5%CO2培养箱中。
(2)分组。按他莫昔芬浓度为7.5、15、30μmol/L分为3组,对照组不加入他莫昔芬,每组设10个平行孔。
(3)MTT试验。取培养稳定的对数生长期Hep3B细胞,用1640培养基调节细胞浓度为1×105个/mL,加入96孔培养板,每孔加入0.1mL,置入37℃、5%CO2培养箱中24h,镜下观察细胞大部分贴壁后,弃去培养液分别加入含不同浓度他莫昔芬的培养液每孔各0.1mL,继续培养24、48及72h,然后每孔加入MTT10μL,继续培养4h,弃去培养液,每孔加入二甲基亚砜(DMSO)150μL,振荡约15min,于492nm读取OD值,并计算抑制率。抑制率(%)=(1-试验孔OD值/对照孔OD值)×100%。
(4)ER免疫组化染色。将盖玻片置入六孔板的培养孔,取对数生长期的细胞传代后加入培养孔中,加入含不同浓度他莫昔芬的培养液,置入37℃、5%CO2培养箱中培养24、48、72h后,将盖玻片放入4℃甲醇∶丙酮(1∶1)中约20min固定,用PBS液清洗玻片3×3min,甩干后于每张盖玻片上滴加50μL的非免疫性动物血清封闭,置入37℃温箱孵育30min。用SP法进行免疫组化染色,每张盖玻片上滴加50μL即用型鼠抗人雌激素受体单克隆抗体,4℃过夜,然后每孔加入50μL生物素标记的二抗,37℃孵育1h,每孔加入50μL链亲和素-过氧化物酶也即三抗,37℃孵育40min,每孔加入联苯二胺100μL显色,苏木素复染,1%盐酸乙醇分色,梯度浓度的乙醇液脱水干燥,二甲苯透明处理,最后用中性树胶封片。
(5)流式细胞仪检测。使用武汉大学基础医学院Beckmann流式细胞仪对样品进行检测。收集经不同浓度他莫昔芬作用24、48、72h的细胞,常规用胰蛋白酶消化,离心收集后用预冷的浓度为70%的乙醇液固定,-20℃过夜,100μLRNA酶(100mg/L)消化,常规PI(50mg/L)染色,4℃避光30min后上机检测,激发波长为488nm,分析结果后计算凋亡率。
(6)RT-PCR检测P21WAF1。收集经不同浓度他莫昔芬作用不同时间的细胞,经异硫氰酸胍-酚-氯仿一步法提取细胞总RNA。Oligo(dT)18为引物,逆转录合成cDNA,然后以合成的cDNA为模板,用P21基因及β-actin内参照进行半定量PCR扩增。实验条件为:变性94℃ 60s,退火60℃ 60s,延伸72℃ 60s,30个循环,P21基因扩增带为316bp,β-actin扩增带为500bp。引物序列:P21上游引物5-CCACATGGTCTTCCTCTGCTG-3,下游引物5-GATGTCCGTCAGAACCCATG-3;β-actin上游引物5-GTGGGGCGCCCCAGGCACCA-3,下游引物5-CTCCTTAATGCACGCACGATTTC-3。
2 结果
2.1 他莫昔芬对人肝癌细胞增殖的影响
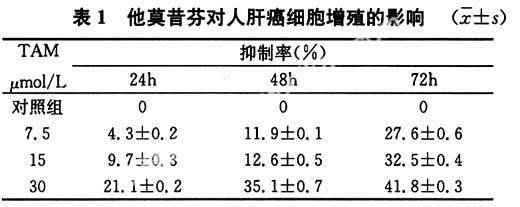
TAM对人肝癌细胞Hep3B的抑制作用随作用时间延长而不断增强,24、48、72h组之间相比差异均有统计学意义(P<0.05);随TAM浓度增加作用也增强,不同浓度TAM组肝癌细胞抑制率均较对照组高(P<0.05),30μmol/L组72h抑制率最高,如表1所示。
2.2 他莫昔芬对人肝癌细胞ER阳性表达的影响
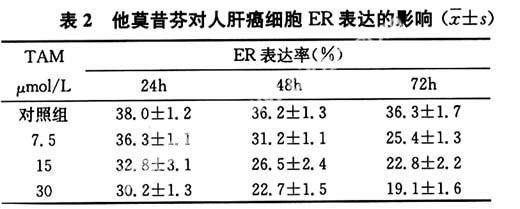
TAM对人肝癌细胞ER阳性表达的抑制作用随作用时间延长而不断增强,24、48、72h组ER阳性率下降并有统计学意义(P<0.05);不同浓度TAM对ER阳性表达均有抑制作用,且随浓度增加抑制作用增强,各组肝癌细胞ER阳性率均较对照组明显降低(P<0.05),30μmol/L组72hER阳性率最低,如表2所示。
2.3 他莫昔芬对人肝癌细胞凋亡的影响
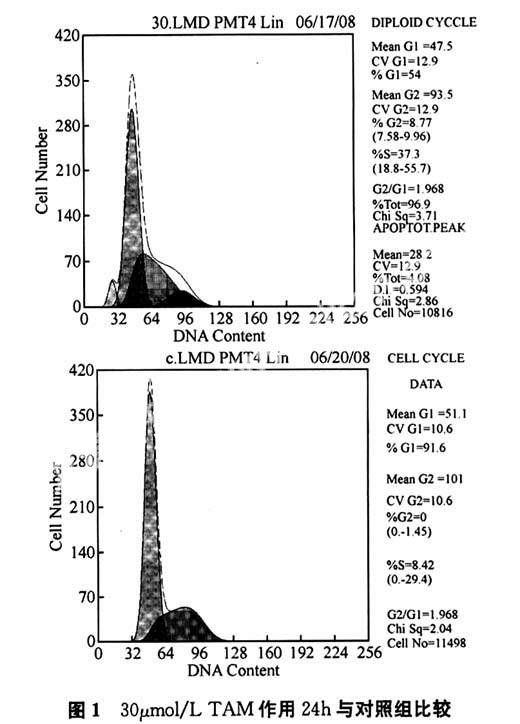
(1)流式细胞仪检测结果。肝癌细胞的凋亡率随TAM浓度的增加和作用时间的延长而提高。肝癌细胞生长阻滞于细胞周期的G0/G1期,S期比例减少,细胞增殖指数下降。与对照组比较各组均有统计学意义(P<0.05),如图1所示。
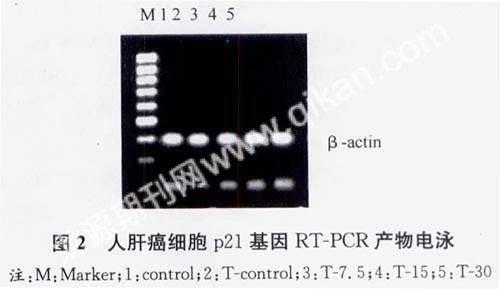
(2)RT-PCR检测结果。P21基因mRNA的表达在TAM作用24h后与对照组比较即有增加,并随TAM浓度的增高及作用时间的延长而表达进一步增高,30μmol/L组作用72h最为明显,与肝癌细胞凋亡过程基本一致,如图2所示。
3 讨论
肝癌是一种雌激素依赖型肿瘤,相关研究表明,雌激素水平的上调可导致肝癌发病率升高[2]。人肝细胞表达高亲和性的ER,而肝癌细胞ER表达较正常肝细胞更高[3],雌激素通过ER介导的信号通路来诱导肝细胞基因转录水平的变化,从而诱导肝癌的发生[4]。此外雌激素尚可通过激活蛋白激酶C来促进人肝癌细胞的增殖[5]。
TAM为一种非甾体抗雌激素类药物,其化学结构与雌激素相似,故可在雌激素作用的各人体靶器官内与雌激素竞争ER,减少胞浆内的ER含量,阻止细胞核内雌激素生成基因的转录和ER的再合成。TAM还通过作用于信号传导MAPK通路,阻断蛋白激酶C,从而激活TGF-β、p21、p27等的表达来抑制肿瘤细胞的生长[6],目前已广泛应用于临床乳腺癌的预防及治疗。
然而将TAM应用于临床肝癌治疗目前尚存在争议。体外实验发现TAM对肝癌细胞增殖有抑制作用,呈时间-浓度依赖性[7]。本研究发现,随着TAM浓度的增加和作用时间的延长,其对肝癌细胞Hep3B增殖的抑制作用不断增强,以浓度为30μmol/L的TAM作用72h的抑制作用最强,ER的阳性表达率最低,流式细胞仪检测显示细胞增殖指数最低,RT-PCR产物电泳显示p21基因mRNA表达水平最高。实验的结果说明TAM可以抑制肝癌细胞生长,它通过与雌激素竞争性结合ER,阻断蛋白激酶C,降低端粒酶活性[8],上调p21、p27的表达[9],影响Ca2+通路[10]等来抑制肝癌细胞的增殖及促进其凋亡。
综上所述,相关研究证明,TAM对人肝癌细胞的增殖有抑制作用,这为TAM应用于临床肝癌的内分泌治疗提供了理论依据,而且因TAM价格较低,易于推广,故显示出了很好的应用前景。而雌激素水平对于TAM抑制肝癌细胞增殖的影响尚待进一步研究。
参考文献:
[1] CHOW PK, TAI BC, TAN CK, et al.High-dose tamoxifen in the treatment of inoperable hepatocellular carcinoma: A multicenter randomized controlled trial[J].Hepatology,2002, 36(5):1221-6.
[2] CASTRO-RIVERA E, SAFE S. 17 beta-estradiol and 4-hydroxyta- moxifen-induced transactivation in breast, endometrial and liver cancer cells is dependent on ER- subtype, cell and pro-moter context [J]. Steroid Biochem Mol Biol, 2003, 84(1): 23231.
[3] HAMAZAKI K, MIURA H, SAKAI H,et al. Estrogen and androgen receptors in hepatocellular carcinoma and in noncancerous liver tissue[J].Gan No Rinsho. 1989, 35(10):1109-13.
[4] WAALKES MP, LIU J, CHEN H, et al. Estrogen signaling in livers of male mice with hepatocellular carcinoma induced by exposure to arsenic in utero [J]. J Natl Cancer Inst, 2004, 96 (6):4662474.
[5] MARINO M, DISTEFANO E, CAPORALI S, et al. Beta-estradiol stimulation of DNA synthesis requires different PKC isoforms in HepG2 and MCF7 cells [J]. J Cell Physiol, 2001, 188 (2):1702177.
[6] LIANG Y, HOU M, KALLAB AM. Induction of antiproliferation and apoptosis in estrogen receptor negative MDA2231 human breast cancer cells by mifepristone and 4-hydroxytamoxifen combination therapy: a role for TGF2beta1[J]. Int J Oncol, 2003, 23(2):3692380.
[7] BRANDT S, HELLER H, SCHUSTER KD, et al. Tamoxifen induces suppression of cell viability and apoptosis in the human hep-atobl astoma cell line HepG2 via down2regulation of telomer2 ase activity[J]. Liver Int, 2004, 24(1):46254.
[8] BRANDT S, HELLER H, SCHUSTER KD, et al. The tamoxifen-in- duced suppression of telomerase activity in the human hepa- toblastoma cell line HepG2: a result of post-translational regulation[J]. J Cancer Res Clin Oncol, 2005,131(2):1202128.
[9] CEHN J, WILLINGHAM T, SHUFORD M, et al. Effect of ectopic overexpression of p21 (WAF1/CIP1) on aneuploidy and the m alignant phenotype of human brain tumor cells[J]. Oncogene, 1996,13: 1395-1403.
[10] KIM JA, KANG YS, JUNG MW, et al. Involvement of Ca2+influx in the mechanism of tamoxifen-induced apoptosis in HepG2 human hepatoblastoma cells[J]. Cancer Lett, 1999, 147 (122):1152123.
(责任编辑:陈涌涛)

