离心运动对细胞外基质蛋白含量及膜完整性的影响
马新东 高前进 李俊平
摘要:以雄性Wistar大鼠为研究对象,进行“一次性大强度离心运动”,一次性离心运动实验为16°下坡跑台跑,定量大负荷间歇性运动,跑速为26.8 m/min,运动5 min×10组,组间歇1 min。离心运动后不同时段取大鼠后肢腓肠肌外侧头进行分析大强度离心运动后大鼠骨骼肌细胞骨架蛋白含量的变化特点;与延迟性骨骼肌损伤时血清酶升高的关系;探讨细胞骨架蛋白在骨骼肌纤维中存在的特点和作用。
关键词:离心运动;细胞外基质蛋白;骨骼肌微损伤;膜完整性
中图分类号:G804.7文献标识码:A文章编号:1007-3612(2008)05-0618-05
骨骼肌细胞膜连接了细胞内骨架与细胞外基质(ECM),在维持骨骼肌细胞的结构和功能中发挥了重要作用。在骨骼肌中基膜(细胞外基质)—肌细胞膜—细胞骨架中的一些连接蛋白的缺失导致了骨骼肌疾病从而使人们对它们连接的重要生物作用有了认识[1]。细胞外基质(ECM)决定组织的形态和结构,ECM不同成分之间相互作用形成立体骨架结构,对细胞起着支持作用。细胞只有通过ECM连接才构成组织,ECM决定组织的牵张强度。细胞外基质蛋白在维持肌细胞的结构以及力的传导过程中发挥了重要作用。
对于运动后骨骼肌微损伤的发生及恢复过程中肌细胞的细胞内骨架、肌细胞膜在结构、功能方面的变化的研究已经相对比较成熟,但对于骨骼肌细胞外基质在运动后结构、功能方面变化的研究目前还较少,因此本研究的目的是探讨运动后骨骼肌微损伤后ECM中的重要蛋白laminin-2,collagenIV蛋白含量的异同及离心方式运动对其影响;探讨损伤发生过程中基质蛋白laminin-2基因表达的变化特征,为今后能够更加深入全面的研究运动后骨骼肌微损伤发生的机制提供理论基础和依据。
1研究方法
1.1实验对象与分组雄性Wistar大鼠42只,分为7组,每组6只,体重300~360 g,由北京维通过利华实验动物技术有限公司提供,国家标准啮齿类动物饲料,分笼饲养,自由饮食,室温17~23℃,相对湿度60%~75%,保持12 h光照。
正式实验前3 d,所有动物进行5~10 min跑台运动,以熟悉跑台,速度为5~10 m/min,坡度为0°。大鼠跑台为杭州段氏制作BCPT-98型。
一次性离心运动的实验大鼠采用Armstrong(1983)[2]、田野[3]所设计的-16°下坡跑台跑,模型略有改进,以更适合模拟离心方式运动造成的损伤。定量大负荷间歇性运动,跑速为26.8 m/min,相当于最大摄氧量的80%~90%[4],运动5 min,间歇1 min,共进行10组。给以少量声、光、电刺激,以激励大鼠运动。
实验组在一次性离心运动后即刻、运动后4 h、12 h、24 h、48 h、72 h,取材为每组6只,分别取大鼠后肢腓肠肌外侧头进行分析。安静对照组取材与实验组相同部位。
1.2测试样本的采集与处理1) 大鼠血清的采集:大鼠称重后,用20%的乌来糖(或称乌拉坦)按0.01 mL/g体重腹腔注射麻醉,心脏取血置于离心管中,倾斜静置2~3 h后进行常规血清分离(2 000转/min,15 min),-20℃冰箱保存待测。
2) 用于匀浆的样本采集:取血后速取左侧腓肠肌外侧头,切约为4 min×4 min×4 mm3,用锡纸包好、标记后放入液氮中冰冻保存,留做匀浆用。
3) 用于冷冻切片的样本采集:大鼠称重后,颈椎脱位法处死,取血后小心剪取约3 min×3 min×5 mm的腓肠肌(切勿牵拉)投入用液氮预冷的装有正已烷(-70℃)的小烧杯中速冻,之后用锡纸包好放入液氮中保存,用于冷冻切片。
4) 组织匀浆总蛋白测试:10%匀浆,总蛋白(TP)的测试采用Bradford法[5](即考马斯亮蓝法)法。
5) 血清CK、LDH的测试方法:测试采用酶动力法,试剂盒购自北京北控中生生物科技股份有限公司,测试严格按照操作步骤进行,仪器为MD-100半自动生化分析仪。
6) 羟脯氨酸(hydroxyproline)测试。原理:羟脯氨酸在胶元蛋白中占13.4%,在弹性蛋白中占极少量,其他蛋白中均不存在,因此羟脯氨酸能反映胶元代谢情况。羟脯氨酸在氧化剂的作用下所产生的氧化产物与二甲氨基苯甲醛作用呈现紫红色,根据其呈色的深浅可推算出其含量。
试剂盒购自南京建成生物制品公司,测试严格按照操作步骤进行,仪器为721分光光度计。
7) laminin-2原位杂交测试。大鼠Laminin-2基因的寡核苷酸探针序列设计参考Maher,J.J等[6],用Blast在NCBI的RGD(Rat Genome Database)中验证其定位,使用Oligo 6.0验证其不含稳定的二聚体和发夹结构。其序列为: 5' AGGAGGTTGTCAGCAACAGCGGTCTTGACATGGACAACGA 3' ,由北京奥科生物技术有限公司合成,3'端地高辛标记。
8) 组织切片的图像分析。组织切片染色后,显微镜观察,通过Panasonic WV-CP410/G摄像头和BOSER BS602A图像采集卡进行图像采集,之后用Scion Image (National Institutes of Health, USA)进行分析。用Scion Image分别测量不同类型肌细胞膜染色的光密度,以此反映其含量。每样本测量上、下、左、右、中部5个视野。
9) 肌肉匀浆方法:秤取腓肠肌肉样品,迅速剪碎后放入玻璃匀浆器中,以1:10的比例加入匀浆液进行匀浆。
10) 冷冻切片:在SLEE冷冻切片机上进行切片,厚度为15μm,切片恒温-20℃。将实验组贴于一张切片上,以便于比较[7]。
1.3指标测试与方法11) 肌肉匀浆测SOD、MDA方法:SOD的测试采用黄嘌呤氧化酶法,MDA的测试采用硫代巴比妥酸(TBA)法,试剂盒均购自南京建成生物制品公司,测试严格按照操作步骤进行,仪器为721分光光度计。
冷冻切片。固定:切片自然干燥,浸入新鲜配制的4%多聚甲醛中2 min。消化:胃蛋白酶,一般使用浓度为0.4%,消化时间为37℃、30~180 min,主要用于细胞间质抗原的显示,如:Laminin(层粘蛋白),Collagen IV(IV型胶原)等。
1.4数据统计方法对观察分析结果用统计学分析软件SPSS11.5进行ANOVA单因素方差分析。
2结果
2.1离心方式运动后血清CK、LDH 以及羟脯氨酸的变化┎馐越峁见表1。

血清CK、LDH的变化呈现相似的趋势,在离心运动后即刻最高随后呈现下降的趋势到12 h后达到最底点,然后呈现上升的趋势到48 h后又呈现下降趋势(图1)。ANOVA分析表明:运动后即刻CK与其它各时段均有非常显著性差异,玃<0.01;LDH除24 h外的各时段和即刻组均有显著性差异,玃<0.05;CK 4 h组高于12 h组、72 h组,差异显著,玃<0.05;12 h最低,与除24 h外的各段均有显著差异,玃<0.05;肌组织中SOD值从离心运动后即刻开始升高,到12 h达最高,48 h又有一次高峰,随后下降。运动后肌组织SOD含量,在12 h显著高于安静对照、72 h含量,玃<0.05(表2)。

肌组织中MDA变化规律与SOD相似(表2,图3),在运动后即刻开始升高,12 h达最高,在48 h又有一次高峰趋势,其后下降。其中12 h肌组织MDA含量与安静对照、运动后48 h、72 h差异显著,玃<0.05。图3,肌组织MDA扩大十倍显示。
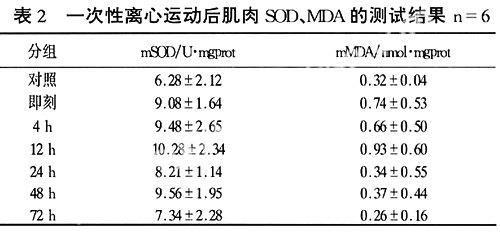
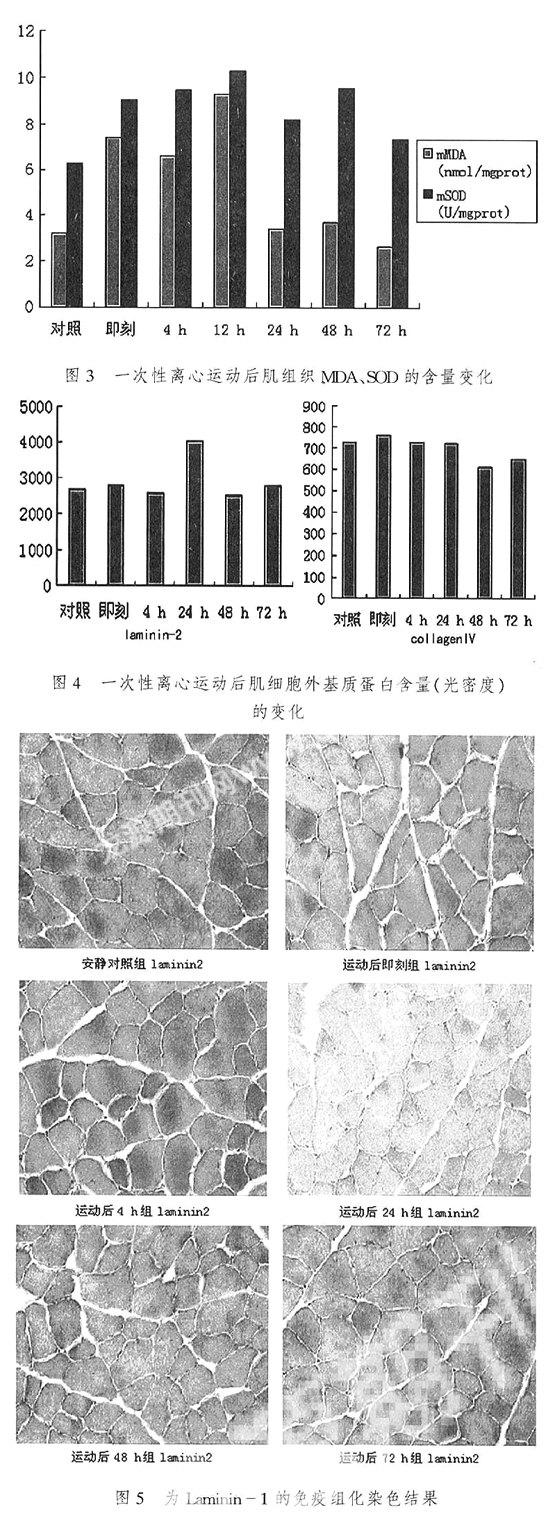
2.2运动后细胞外基质蛋白含量变化与骨骼肌内容物泄漏及自由基代谢变化的相关分析(表3,图4)。

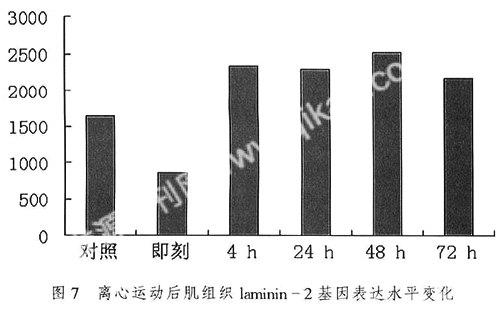
图5,图6。测量每张切片中5个视野(左上、左下、中、右上、右下)的蓝紫色颗粒的光密度值,结果见表4和图7。
离心运动即刻laminin-2基因表达水平明显下降与对照组差异显著,玃<0.05;随后逐渐升高,在48 h达到最大,在4 h后直至72 h均处于较高水平,对照组与4 h组至72 h组差异显著玃<0.05(图7);

腓肠肌外侧头,冷冻切片,15 μm厚;寡核苷酸探针,地高辛标记,碱性磷酸酶系统显色,杂交阳性信号为蓝紫色颗粒(图8)。
腓肠肌外侧头,冷冻切片,15μm厚;寡核苷酸探针,地高辛标记,碱性磷酸酶系统显色,杂交阳性信号为蓝紫色颗粒(图9)。

3分析与讨论
3.1离心运动后大鼠肌纤维中细胞外基质蛋白laminin-2,cllagenIV含量的变化根据对腓肠肌组织切片的观察来看,我们观察到离心运动后腓肠肌更为明显。ECM的量受到身体活动的影响,一定形式的慢性负荷练习可以增加胶元的含量,只不过是胶元合成的类型以及胶元合成的程度情况不同。这些变化可以改变组织的粘弹性以及机械特性,使组织更易抗拉。[8-9]在laminin-2基因缺失大鼠的研究中发现[10-11],伴随着laminin-2的减少而CollagenIV含量呈增加趋势,而本研究却发现离心运动后laminin-2含量增加伴随着CollagenIV含量的减少,laminin-2蛋白和CollagenIV之间是否存在着动态平衡,二者之间的增加和减少是否存在着因果关系?需要进一步研究的证实。
3.2运动后骨骼肌内容物泄漏、羟脯氨酸、自由基代谢变化以及骨架蛋白含量变化的相关分析羟脯氨酸是胶元蛋白的一种主要氨基酸,是反映体内胶元代谢的生化标志物,在胶元蛋白中占13.4%,在弹性蛋白中占极少量,其他蛋白中均不存在,因此羟脯氨酸能反映胶元代谢情况。血清羟脯氨酸与血清LDH呈负相关;而血清羟脯氨酸与collagenIV没有相关性,可能和collagenIV本身的特殊性有关系,collagenIV作为细胞外基质蛋白的一种,在细胞外基质中含量很少并且是基膜的框架结构,也是基膜特有的胶原,在组织中细胞排列和骨骼肌中维持力的稳定性中发挥着重要的作用[12-13],在运动过程中可能没有对胶元的代谢产物羟脯氨酸的增加作出贡献有关,本研究证实了这一点,即羟脯氨酸虽然是胶元的代谢产物但主要是I、III型胶元的代谢产物,也有相关文献报道羟脯氨酸主要是I、III型胶元的代谢产物[14];肌组织中MDA水平与SOD水平相关;肌组织中SOD与血清LDH水平负相关;
本研究发现细胞外基质蛋白collagenIV与血清CK呈正相关;而Mackey, Donnell y(2004)[15]在以人为研究对象进行一次性离心运动后也同样发现了collagenIV与血清CK的明显的相关关系提示可能骨骼肌的离心收缩影响了IV型胶元的代谢更新。

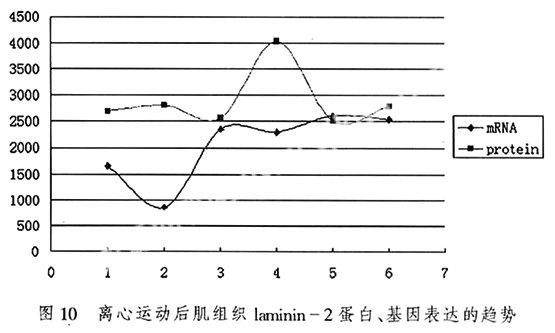
3.3研究骨骼肌在损伤过程中laminin-2基因表达的变化特征细胞外基质蛋白laminin-2基因mRNA的原位杂交结果代表了laminin-2基因表达水平。如图10所示,离心运动即刻laminin-2基因表达水平明显下降与对照组差异显著玃<0.05,随后逐渐升高,在48 h达到最大,在4 h后直至72 h均处于较高水平,对照组与4 h组至72 h组差异显著;本研究观察到了即刻laminin-2基因水平的降低但是没有观察到蛋白水平的下降,可能和实际蛋白水平有下降的趋势但是没有设置相应的时相观察到相应的实验结果,也有可能离心运动后即刻laminin-2基因表达水平的下降激活了laminin-2基因的调控过程使得laminini-2基因表达水平提高从而增加laminin-2蛋白的合成,laminin-2蛋白的升高也有可能和其本身就有较强的修复能力有关,从图11我们可以看到laminin-2基因和蛋白变化有大致相同的趋势。
4结论
1) 离心运动后基质蛋白laminin-2在24 h处于最高水平,24 h与其它各组组差异显著,其它组间的变化无显著性差异,说明了laminin-2是有较强调整和修复能力的蛋白,其变化有可能是因为其相邻蛋白的减少而代偿性的增加以维持机体的功能。
2) 本实验发现肌细胞外基质蛋白含量collagenIV的变化与血清CK相关,提示可能骨骼肌的离心收缩影响了collagenIV的代谢更新;
3) 离心运动即刻laminin-2基因表达水平明显下降与对照组差异显著;随后逐渐升高,在48 h达到最大,laminin-2基因和蛋白的表现了基本相同的变化趋势。
参考文献:
[1] Kevin P. Campbell Skeletal Muscle BasementMembrane-Sarcolemma-Cytoskeleton Interaction Minireview Series Published, JBC Papers in Press, January 29, 2003, DOI 10.1074/jbc.R300005200.
[2] Armstrong RB. Eccentric exercise-induced injury to rat skeletal muscle. J.Appl.Physio,1983,54:80-93.
[3] 田野.运动性线粒体钙聚积、细胞脂质过氧化对骨骼肌结构、机能的影响. 北京体育大学博土毕业论文,1991.
[4] Pica AJ, Brooks GA. Effects of training and age on VO2max in laboratory rats. Med Sci Sports Exerc,1982,14(3):249-252.
[5] Bedfood, T.G. Maximum oxygen consumption of rats and its changes with various experimental procedures in identically trained young and old rats. J. Appl. Physiol,1979,17:1278-1283.
[6] Maher,J.J. and Tzagarakis,CPartial cloning of the M subunit of laminin from adult rat lipocytes: expression of the M subunit by cells isolated from normal and injured liver. Hepatology,1994,19(3):764-70.
[7] F. 奥斯伯等著,颜子颖、王海林译. 精编分子生物学实验指南. 北京:科学出版社,2001:332.
[8] Koskinen SO, Wang W, Acute exercise induced changes in rat skeletal muscle mRNAs and proteins regulating type IV collagen 2002 EXERCISE AND MUSCLE COLLAGEN REMODELINGJ Appl Physiol on December 25, 2005 content. Am J Physiol Regul Integr Comp Physiol 280: R1292–R1300,2001.
[9] Michael Kjaer Role of Extracelluar Matrix in adaptation of tendon and skeletal muscle to mechanical loading Physiol Rev,2004,84:649-698.
[10] Maher,J.J. and Mc Guire RF Extracellular matrix gene expressionincreasespreferentially in rat lipocytes and sinusoidal endothelial cells during hepatic fibrosis in vivo.J Clin Invest,1990,86(5):1641-8.
[11] Gullberg D,Tiger CF,and Velling T.laminin during muscle development and in muscle dystrophies.Cell Mol Life Sci,1999,56:442-460.
[12] Imanaka-YoshidaK,Enomoto-Iwamoto M,Yoshida T,and Sakakura T,Vinculin,talin,integrin a6B1 and laminin can serve as components of attachment complex mediating contraction force transmission from cardiomyocytes to extracelluar matrix Cell motil Cytoskeleton,1999,42:1-11.
[13] Alnaqeeb MA,ZaidNS,Goldspink G Connective tissue changes and Physical properities of developing and aging skeletal muscle. J Anat,1976,139:677-689.
[14] Abigail L. MackeySkeletal muscle collagen content in humans after high-force eccentric contractions,Journal of Applied Physiology,2004,27(2):197-203.
[15] Alan E. Donnelly. Exercise induced damage: effect of light exercise on damage muscle. Eur J Appl Physiol, 1992,64:350-353.

