间歇运动对大鼠骨骼肌凋亡基因Bax、Bcl-2及相关因素的影响
陈德权 邓树勋 彭峰林
摘要:通过比较间歇运动中不同类型骨骼肌中氧自由基,线粒体Ca2+含量代谢情况,Bax,Bcl-2凋亡基因表达的差异,来探讨间歇运动导致骨骼肌细胞凋亡的可能机制。24只SD大鼠,随机分为安静对照组(8只),一次间歇运动组(8只),长期间歇训练组(8只)。运动后24 h取比目鱼肌和胫骨前肌,采用RT-PCR方法检测Bax,Bcl-2基因表达情况,并测定组织中SOD活性、MDA含量和线粒体钙含量。结果表明:1) 一次间歇运动组胫骨前肌中Bax/Bcl-2比值显著升高(P<0.05),且Bcl-2表达显著低于长期间歇训练组(P<0.05)。2) 运动后,胫骨前肌和比目鱼肌中SOD活性均升高了,但仅一次间歇运动后胫骨前肌SOD活性较安静时增加具有显著性(增加48%,P<0.05)。3) 一次间歇运动和长期间歇训练后胫骨前肌中MDA含量均非常显著性高于安静对照组(P<0.01)。4) 一次间歇运动后,胫骨前肌线粒体Ca2+含量较安静时增加100%,差异非常显著(P<0.01),同时也显著性高于比目鱼肌中线粒体Ca2+含量(P<0.05)。结论:1) 一次高强度的间歇运动可能主要通过快肌中Bax表达增强,Bcl-2表达减弱,氧自由基的升高,粒体内钙超载,共同致运动能力下降。2) 长期间歇训练可能通过增强抗氧化能力,增强抗凋亡基因表达来增强运动能力。间歇训练后,快慢肌应对细胞内Ca2+升高的能力增强,这可能是间歇训练增强运动能力的另一细胞内信息转导机制。
关键词:间歇运动;Bax,Bcl-2;氧自由基;线粒体钙
中图分类号:G804.7文献标识码:A文章编号:1007-3612(2008)07-0922-04
细胞凋亡是细胞死亡的一种形式,研究细胞凋亡具有重要的生物学及生物医学价值。Bcl-2作为一种抑制细胞凋亡的基因,它的表达可以抑制细胞凋亡;Bax是Bcl-2家族的另外一种促进细胞凋亡的基因,它的过表达可以拮抗Bcl-2的保护效应而使细胞趋于凋亡。Bax/Bcl-2的比值决定了细胞是否凋亡的命运[1]。线粒体途径是介导细胞凋亡的一个重要途径。线粒体中可产生大量的氧自由基,攻击细胞膜造成脂质过氧化,引发细胞凋亡;也可以由于线粒体内钙超载或线粒体膜电位的改变引发细胞凋亡。本研究以间歇运动为运动模型,通过检测骨骼肌中Bax和Bcl-2的表达情况,同时测定反映骨骼肌组织内氧化损伤的SOD活性和自由基水平的MDA含量,以及线粒体钙含量来反映组织内氧化损伤,线粒体钙超载与细胞凋亡基因表达的关系,期望揭示高强度间歇运动导致细胞凋亡的机制,为运动训练提供科学的理论依据。
1研究对象与方法
1.1研究对象与运动模型
1.1.1研究对象与分组三月龄清洁级雌性SD大鼠24只,购自中山大学医学院动物实验中心。体重(180.5±19.7)g。分笼饲养。将24只大鼠随机分为3组:安静对照组(n=8);一次间歇运动组(n=8);长期间歇运动训练组(n=8)。
1.1.2运动方式(改良于Bowles,D.K等[2])安静对照组:平时不进行训练,笼内自由饮食,自由活动,最后同运动组一起处死并取材。
一次间歇运动组:训练前进行一周适应跑台训练,速度逐渐递增,但是到一周末时速度不能超过20 m/min。正式运动时采用16 m/min 和50 m/min各2 min。 5%grade的间歇运动,重复10次,45 min/d(包括5 min热身运动),运动一次。
长期间歇训练组:在进行一周适应训练后,进行运动方式同一次间歇运动组的训练方式相同,每周训练5 d,周三和周日休息,正式训练共7周。
1.2动物取材与标本制备
1.2.1动物取材两运动组大鼠在末次运动后24 h,同安静组大鼠一起称重,麻醉后,取后肢两侧比目鱼肌和右侧胫骨前肌,于生理盐水中洗净后,用吸水纸吸干水分。将胫骨前肌分成两块,一块用于生化指标的检测,一块用于分子生物学实验;左侧比目鱼肌用于生化指标的检测,右侧比目鱼肌用于分子生物学实验。所有的骨骼肌组织在分装好后迅速置于液氮中冷冻保存。
1.3主要实验仪器与试剂
1)智能型热循环仪:PTC-200,美国;2)水平电泳仪(APOLLO),美国;3)全自动凝胶数码成像系统及分析系统(SynGene GeneGenius ),美国;4)RT-PCR试剂盒,购于宝生物工程(TaKaRa)(大连)有限公司。5)琼脂糖,西班牙。6)SOD活性检测试剂盒,MDA含量检测试剂盒,钙测定试剂盒,考马斯亮蓝蛋白定量检测试剂盒均购自南京建成生物工程研究所。
1.4指标检测
1.4.1Bax、Bcl-2基因表达情况的检测(RT-PCR方法)
1.4.1.1引物设计由Invitrogen(上海分部)设计与合成,设计的引物序列为:Bax引物序列(331bp):引物上游5'-GGCG AATT GGAG ATGA ACTG-3' 引物下游 5'-GTCA CTGT CTGC CATG TGGG-3';Bcl-2引物序列(550bp):引物上游 5'-GTGG GATA CTGG AGAT GAAG ACT -3' ,引物下游5'- CAGC CAGG AGAA ATCA AACA G-3';内参照GAPDH引物序列(453bp):引物上游5'-ACCA CAGT CCAT GCCA TCAC-3',引物下游5'-TCCA CCAC CCTG TTGC TGTA-3'
1.4.1.2RNA的提取与目的基因的扩增取100 mg左右的骨骼肌组织采用Trizol 法抽提总RNA,在鉴定RNA的质量后再按照RT-PCR试剂盒说明书上进行cDNA的合成和目的基因的扩增,其中Bax基因退火温度为55℃,Bcl-2的退火温度为53℃,GAPDH的退火温度为57℃。采用1%的琼脂糖凝胶电泳后,拍照并保存待日后分析。
1.4.2SOD活性,MDA含量测定骨骼肌中SOD活性,MDA含量,线粒体钙含量测定均按照试剂盒说明书进行操作。
1.5统计学分析实验数据采用SPSS14.0进行统计学分析。所有数据均以平均数±标准差表示。数据的组间差异采用单因素方差分析,并用Tukey(图凯法)进行多重比较,数据组内差异采用配对样本T检验,显著性水平为P<0.05,非常显著为P<0.01。
2实验结果
2.1运动对骨骼肌中Bax和Bcl-2基因表达的影响

一次间歇运动后,胫骨前肌和比目鱼肌Bax表达均较安静时升高,而Bcl-2表达低于安静对照组,两者均无显著性差异;同时,胫骨前肌中Bax表达的增幅和Bcl-2降低的幅度较比目鱼肌大,且Bax/Bcl-2的比值显著性高于安静对照组。长期间歇训练后,胫骨前肌中Bax表达增幅较比目鱼肌中大,而比目鱼肌中Bax中表达增幅较小;Bcl-2的表达于胫骨前肌和比目鱼肌中较安静时均有升高,但同样均无显著性;Bax/Bcl-2比值在长期间歇训练后于胫骨前肌和比目鱼肌均有所升高,但均无显著性差异。两运动组之间相比较,仅发现一次间歇运动后胫骨前肌中Bcl-2表达显著低于长期间歇训练后的值(P<0.05)。
2.2运动对骨骼肌组织中SOD活性和MDA含量的影响安静状态下,大鼠比目鱼肌中SOD活性高于胫骨前肌,差异显著(P<0.05);而胫骨前肌中MDA含量又显著性高于比目鱼肌(P<0.05)。经过运动后,比目鱼肌和胫骨前肌中SOD活性均升高了,比目鱼肌中SOD活性增幅较小;胫骨前肌中SOD活性增幅则较大,其中一次间歇运动组增加48%(P<0.05),长期间歇训练组增加24%(P>0.05)。而经过两种方式的运动后,比目鱼肌中MDA含量基本无变化,而胫骨前肌中MDA含量均较运动前大幅增加:一次间歇运动增加66%(P<0.01);长期间歇训练组增加43%(P<0.01),差异均非常显著。经过两种方式的运动后,胫骨前肌与比目鱼肌中MDA含量的差异比安静时更大了,差异非常显著(P<0.01)。

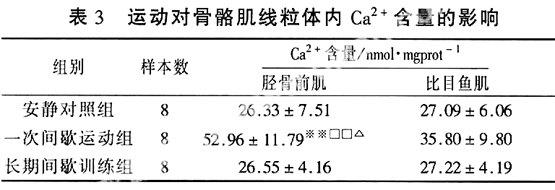
2.3运动对骨骼肌线粒体内Ca2+含量的影响一次间歇运动后,胫骨前肌线粒体中Ca2+浓度较安静时增加了100%,差异非常显著(P<0.01),并且高于比目鱼肌中Ca2+含量,差异显著(P<0.05)。长期间歇训练后,快肌和慢肌中Ca2+含量与安静时相持平,差异不显著。两运动组之间比较,胫骨前肌中Ca2+含量在一次间歇运动后非常显著性高于长期间歇训练组(P<0.01)。
3讨论
3.1运动对大鼠骨骼肌细胞凋亡基因的影响Bax和Bcl-2是细胞凋亡过程中两个重要的调控基因。Bax的过度表达会促进细胞凋亡,而Bcl-2的表达增强则会抑制细胞凋亡。Bax/Bcl-2比值决定了细胞的命运,当比值大于正常值时,细胞则趋于凋亡,当比值小于正常值时,凋亡则受到抑制。国内外的许多研究已经发现,在衰老,骨骼肌营养不良,去神经肌萎缩等过程中,骨骼肌细胞发生凋亡的同时,Bax,Bcl-2的表达发生了重要变化,并且两者的变化趋势相反[3-10]。
在本实验研究的结果中发现,运动结束后24 h,一次间歇运动组大鼠快慢肌中Bax表达都较安静对照组升高了,Bcl-2的表达则都下降了,但是各组间及组内都没有显著性差异。上述变化的趋势在快肌中表现得更明显,这也就构成了Bax/Bcl-2比值在一次间歇运动后显著性高于安静对照组。这样的研究结果与Podhorska-Okolow M等(1998)的研究结果很相似,其在研究结果中也发现,小鼠在进行一夜的自发转轮跑后出现骨骼肌细胞凋亡,同时Bcl-2表达下降,Bax表达增强,并且Bax的表达程度与细胞凋亡的程度高度相关[11],说明Bax的表达在诱导细胞凋亡方面起重要作用。本实验再次证实了过强的运动会导致Bax表达增强,而Bcl-2表达下降,并且由于运动方式的原因,间歇运动中起主要作用的快肌中Bax,Bcl-2表达的这种趋势体现的更明显,这也提示一次高强度的间歇运动对快肌的刺激作用更大,会导致快肌细胞凋亡发生的可能性更大,这可能是一次间歇运动中通过凋亡相关基因调控引起骨骼肌细胞凋亡增加导致疲劳的一种基因机制。
同时,本研究结果也显示,经过长期的间歇训练后,快慢肌中Bax表达较安静时升高,但略低于一次间歇运动后的值,Bcl-2的表达在训练后升高,且显著高于一次间歇运动组。同时Bax/Bcl-2比值虽高于安静对照组,但与一次间歇运动组相比却下降了,同样上述变化于快肌中体现得更明显。而在Song W等(2006)和Siu PM(2004)等的研究中则发现经过长期的耐力训练或者中等强度的运动训练后,Bcl-2表达相比对照组大鼠显著增加,而Bax,Bax/Bcl-2比值都降低了[10,12]。同时Song W等检测到DNA碎片梯形条带减少,而Siu PM等检测到运动组骨骼肌中DNA碎片较对照组增加,但无显著性差异。他们的研究结果存在些差异可能主要与训练的时间长短有关。本研究结果中Bax表达与上述研究结果有不同之处,可能也主要是训练时间较他们的短的缘故。而本研究结果也在一定程度上显示了长期间歇训练后骨骼肌细胞凋亡程度的降低。同时,本研究结果中一次间歇运动引起Bax/Bcl-2的比值升高,而长期间歇训练后Bax/Bcl-2比值又下降了,这样的基因表达趋势可能与黄颖峰,郑师陵和王长青长期运动训练过程中骨骼肌细胞凋亡率先增加后降低的趋势存在因果关系[13-16]。这也可能是长期间歇训练过程中通过降低促凋亡基因的表达,而增强抗凋亡基因的表达以增强运动能力的一种基因机制。
3.2运动后氧自由基代谢与Bax及Bcl-2表达人体或动物机体在剧烈的运动后会产生大量的活性氧(ROS),如H2O2,NO,超氧阴离子(O2-)等。这些活性氧分子是氧自由基的来源,它们可以通过一系列的途径诱导细胞凋亡,如氧自由基引起的DNA损伤可激活P53基因引起细胞凋亡,氧自由基形成的氧化应激可活化核转录因子NF-КB和AP-1,可加速细胞凋亡相关的一些基因的表达,诱发细胞凋亡[17]。另外,当ROS在线粒体内大量释放后,可引起Bax和Ced-4与Bcl-2的分离,使Ced-4与Bax参与随后的细胞凋亡发生[1]。
本研究发现,安静状态下比目鱼肌中SOD活性显著高于胫骨前肌,与周婕的研究结果具有一致性[18]。比目鱼肌中MDA含量较胫骨前肌中低,可能是由于慢肌中线粒体含量多,对自由基的抵抗和清除能力都较快肌强。经过一次间歇运动后,比目鱼肌和胫骨前肌中SOD活性以及MDA含量均升高了,但是只有胫骨前肌中SOD活性和MDA含量比安静对照组增加具有显著性,这样的研究结果与先前的诸多研究结果存在相似之处[18-21],同时本研究结果中也发现,Bax表达在一次间歇运动后增加与SOD活性和MDA含量的变化存在一致性,而Bcl-2表达的变化则与SOD活性和MDA含量的变化相反,并且这种趋势在快肌中体现得更明显,提示间歇运动后,快肌中活性氧产生增多,脂质过氧化程度增大,引起与加速了Bax与Bcl-2的分离,使骨骼肌趋向凋亡,运动能力下降。而慢肌纤维中由于SOD活性,MDA含量在间歇运动后与安静对照组相比均无显著性差异,说明间歇运动后氧自由基损伤在慢肌纤维中促凋亡的作用不大。
经过长期间歇训练后,快肌中SOD活性,MDA含量均较安静时升高了,而只有MDA的增幅具有显著性差异。而慢肌中这三项指标均无显著性差异。同时研究结果也显示,间歇训练后,胫骨前肌和比目鱼肌中Bax和Bcl-2表达均较安静对照组增加,而Bax表达则相对一次运动组下降,Bcl-2的表达相对一次运动组增加。这样的研究结果,一方面再次证实了前人关于长期进行中等强度或者有氧运动后,机体的抗氧化能力会增强[22-26]。
3.3运动后线粒体内Ca2+含量与Bax及Bcl-2表达激烈运动会对骨骼肌产生较大的刺激,在急性运动后,骨骼肌肌浆网(SR) Ca2+-Mg2+-ATP酶以及SR Ca2+-ATP酶水解活性均会降低,同时肌浆网对Ca2+转运能力也会明显下降[27-28],引起细胞质中的Ca2+浓度短暂升高,对Ca2+极度敏感的线粒体则会加大对Ca2+的摄取速率,线粒体摄取Ca2+曲线左移,这样细胞质中的Ca2+浓度则会降低,而线粒体内Ca2+则会升高[29-30]。而Ca2+则能结合线粒体通透性孔(MPTP)上的金属结合位点,开放MPTP,从而导致渗透压的改变,ATP的耗竭,细胞色素C释放,活化Caspase-9和Caspase-3,从而诱发细胞凋亡[31]。Bcl-2作为抑制凋亡的基因,它可以通过阻止细胞色素C从线粒体释放出来而抑制细胞凋亡;而Bax则通过与线粒体上的膜通道结合来促使细胞色素C的释放而促进细胞凋亡[32]。
本研究中发现,经过一次间歇运动后,快肌线粒体内Ca2+含量较安静对照组非常显著性升高,而慢肌线粒体中Ca2+浓度虽然升高,但无显著性。造成这种差异的原因可能是高强度的间歇运动后快肌肌浆网摄取Ca2+的能力和Ca2+-ATP酶活性下降比慢肌更多[33],进而引起快肌线粒体中Ca2+含量较慢肌中高。一次间歇运动后,快肌中线粒体内Ca2+浓度升高,Bax表达增强,Bcl-2表达减弱,造成运动能力下降,这可能是一次间歇运动一方面造成线粒体钙超载,造成MPTP的开放,引起线粒体跨膜电位的降低而诱发细胞凋亡,或者导致诱发细胞凋亡的因素如细胞色素c等进入细胞质,导致细胞凋亡;另一方面,Bax表达增高,而Bcl-2表达降低,促进细胞色素C等促凋亡因子得以释放,两方面因素共同促进细胞凋亡,致使运动能力下降。
长期间歇训练后,快肌和慢肌线粒体中Ca2+含量差异不显著。而两运动组间比较,则发现长期间歇训练后,快肌线粒体Ca2+含量明显低于一次间歇运动组,而慢肌线粒体Ca2+含量虽低于一次间歇运动组,但是不能发现显著性差异。这可能与大鼠对运动的适应引起Ca2+-ATPase活性以及肌浆网摄取Ca2+能力均增强有关[34],并且长期间歇训练可能使快肌中Ca2+-ATPase活性升高更多。提示长期间歇训练后,骨骼肌细胞应对细胞内Ca2+浓度增加的能力增强,这可能是骨骼肌运动能力增强的关键因素。
4结论
1) 一次高强度的间歇运动可能主要通过快肌中Bax表达增强,Bcl-2表达减弱,氧自由基的升高,粒体内钙超载,共同致运动能力下降。
2) 长期间歇训练可能通过增强抗氧化能力,增强抗凋亡基因表达来增强运动能力。间歇训练后,快慢肌应对细胞内Ca2+升高的能力增强,这可能是间歇训练增强运动能力的另一细胞内信息转导机制。
参考文献:
[1] 彭黎明,王曾礼.细胞凋亡的基础与临床 [M].北京:人民卫生出版社,2000.7.
[2] Bowles,D,K. , R.P.Farrar, and J.W.Starnes .Exercise training improves cardiac function after ischemia in the isolated, working rat heart [J].Am.J.Physiol,1992,263(Heart Circ.Physiol.32): H804-H809.
[3] 杨海平.低氧、运动对大鼠骨骼肌细胞凋亡及bcl-2、bax表达的影响[J].中国运动医学杂志,2006,25(6):706-709.
[4] 孙婷,田华,付春景,等.氯沙坦对心里衰竭大鼠骨骼肌萎缩中细胞凋亡、抗凋亡蛋白Bcl-2和促凋亡蛋白Bax表达的作用[J].中国临床康复,2006,10(40):43-45.
[5] Lim JH , Kim DY, Bang MS. Effect of exercise and steroid on skeletal muscle apoptosis in the mdx mouse[J] .Muscle Nerve,2004,30(4):456-462.
[6] Adhihetty PJ, O'leary MF, Chabi B, et al.Effect of denervation on mitochondrially-mediated apoptosis in skeletal muscle [J]. J Appl Physiol,2007,102(3):1143-51.
[7] Pistilli EE, Siu PM, Always SE.Molecular regulation of apoptosis in fast plantaris muscles of aged rats[J].J Gerontol A Biol Sci Med Sci,2006,61(3):245-55.
[8] Chung L,Ng YC. Age-related alterations in expression of apoptosis regulatory proteins and heat shock proteins in rat skeletal muscle[J].Biochim Biophys Acta,2006,1762(1):103-9.
[9] Siu PM, Always SE. Mitochondria-associated apoptotic signaling in denervated rat skeletal muscle[J].J Physiol,2005,565(5):309-23.
[10] Song W, Kwak HB, Lawler JM. Exercise training attenuates age-induced changes in apoptotic signaling in rat skeletal muscle [J]. Antioxid Redox Signal,2006 Mar-Apr,8(3-4):517-28.
[11] Podhorsha-Okolow M,Sandri M, Zampieri S, et al. Apoptosis of myofibres and satellite cells : exercise-induced damage in skeletal muscle of the mouse[J]. Neuropathol Appl Neurobiol,1998,24(6):518-531.
[12] Siu PM ,Bryner RW, Martyn JK,et al .Apoptotic adaptation from exercise training in skeletal and cardiac muscles [J]. FASEB J,2004,18(10):1150-2.
[13] 郑师陵,王建军,王青,等.运动状态下骨骼肌线粒体电位的变化与细胞凋亡[J].河北医科大学学报,2000,21(3):143-145.
[14] 王长青,刘丽萍,李雷,等.游泳训练后大鼠骨骼肌细胞自由基代谢、线粒体膜电位变化与细胞凋亡的关系[J].中国运动医学杂志,2002,21(3):256-260.
[15] 郑师陵,叶贤坤,王青.不同运动训练量与骨骼肌细胞凋亡的实验研究[J].中国实验诊断学,2001,5(6):310-312.
[16] 黄颖峰,徐晓阳.恒定负荷耐力训练对大鼠骨骼肌细胞凋亡的影响实验[J].体育科学,2005,25(3):58-61.
[17] 金惠铭.病理生理学(第五版)[M].北京:人民卫生出版社,2000,12.
[18]周婕.不同强度运动对大鼠骨骼肌细胞凋亡的影响[D].湖南师范大学硕士学位论文,2004.
[19] 徐冬青,陈家琦,李静先.力竭运动对大鼠骨骼肌自由基代谢及肌细胞膜通透性的影响[J].天津体育学院学报,1999,14(3):27-29,33.
[20] 傅静波,刘洪珍.少年在亚极量、极量负荷运动下血中MDA、GSH、SOD和CAT的变化[J].中国体育科技,2000,36(8):34-35,38.
[21] 刘晓莉,候莉娟,刘?,等.间歇性无氧运动对小鼠脑、心肌、骨骼肌抗氧化能力及脂质过氧化损伤的影响[J].中国运动医学杂志,2004,23(4):390-394.
[22] 周未艾,李肃反,吕丹云.不同跑步速度训练对大鼠肌肉细胞凋亡的实验研究[J].中国运动医学杂志,2002,21(4):367-370.
[23] 潘新宇,牛岭.巴戟天对运动训练大鼠骨骼肌自由基代谢及运动能力的影响[J].中国临床康复,2005,9(48):162-163.
[24] 任昭君,郭成吉,刘洪珍.“复方抗氧化制剂”对训练大鼠一次运动后骨骼肌谷胱甘肽抗氧化系统影响的研究[J].北京体育大学学报,2005,28(2):194-196,199.
[25] Venditti P, Di Meo S.Antioxidants, tissue damage,and endurance in trained and untrained young male rats[J].Arch Biochem Biophys,1996,331(1):63-68.
[26] 卜于骏.耐力训练对大鼠心肌、骨骼肌硫氧还蛋白还原酶的分子影响机制[D].华东师范大学硕士学位论文,2004.
[27] 田野,周锦琳,李洁.急性运动对骨骼肌肌浆网转运功能的影响[J].中国运动医学杂志,1997,16(3):173-175.
[28] 谢伟勇.胰岛素样生长因子-Ⅰ对大鼠力竭运动致骨骼肌细胞凋亡的影响及其机制[D].第一军医大学硕士学位论文,2004.
[29] 周锦琳,田野.酸性刺激对大鼠骨骼肌细胞胞浆Ca2+的影响[J].北京体育大学学报,2005,28(9):1201-1203,1232.
[30] 田野,李明华,张孙曦.急性运动后大鼠骨骼肌线粒体45Ca2+摄取的动力学观察[J].中国运动医学杂志,2001,20(2):132-133.
[31] He L , Poblenz A T,Medrano C J. Lead and caldium produce rod photoreceptor cell apoptosis by opening the mitochondrial permeability transition pore [J].J Biol Chem,2000,275(16):12175-12184.
[32] Pastorino J G,Tafani M,Rothman R J, et al.Functional consequences of the sustained or transient activation by Bax of the mitochondrial permeability transition pore[J]. J Biol Chem, 1999,274(44):31734-31739.
[33] Inashima S, Matsunaga S, Yasuda T, et al .Effect of endurance training and acute exercise on sarcoplasmic reticulum function in rat fast-and slow-twitch muscles[J]. Eur J Appl Physiol, 2003,89(2):142-149.
[34] Viru M. Differences in effects of various training regimens on metabolism of skeletal muscles[J].J Sports Med Phys Fitness,1994,34(3):217-27.

