体外培养血管平滑肌细胞与内皮细胞增殖的影响
潘 勇 艾玉峰
作者单位:第四军医大学西京医院整形外科中心(西安710032)
摘要目的:研究在体外培养条件下兔血管内皮细胞条件培养基(E CCM)、内皮素-1(ET-1)、内皮素转化酶抑制剂(Endothelial-coverting enzyme inhibit or)Phosphoramidon 对血管平滑肌细胞(SMC)增殖的影响,同时研究了血管平滑肌细胞条件 培养基(SMCCM)对血管内皮细胞(EC)增殖方面的影响。方法:EC和SMC均来源于兔主动脉,在 获得了EC和SMC的条件培养基(CM)后,分别用两者以及ET-1进行实验,细胞的增殖率通过 3H掺入法进行测定。结果:ECCM和ET-1可明显促进SMC的增殖,并呈现剂量依赖性。其最大 效应分别为190%±11%(100% ECCM)和166%±9%(100pg/ml ET-1)。而Phosphoramidon存在条 件下的ECCM使其分裂作用降低33%±2%。SMCCM抑制EC的增殖,这种抑制作用并非剂量依赖性 ,其最大的抑制效应为基本水平的78%±3%。结论:ECCM和ET-1可促进SMC的增殖。Phospho ramidon可明显地抑制ECCM对SMC的增殖作用。同时SMCCM对EC的增殖起抑制作用。
关键词血管内皮细胞血管平滑肌细胞增殖
MODULATIONS OF PROLIFERATION BETWEEN VASCULAR ENDOTHELIAL CELL AND VASCULAR SMOOTH MUSCLE CELL IN VITRO
Pan YongAi Yufeng
Department of Plastic Surgery, Xijing Hospital,Fourth Military Medical Uni versity(Xian 710032)
AbstractAim:To study the effects of vascular end othelial cell conditioned medium(ECCM), endothelin-1 (ET-1), Endothelin-conve rting enzyme inhibitor Phosphoramidon on the proliferation of vascular smooth mu scle cell (SMC) and vascular smooth muscle cell conditioned medium(SMCCM) on theproliferation of vascular endothelial cell(EC)in vitro.Methods:EC and SMC wereisolated from rabbit aortas and cultured.The conditioned medium(CM) of EC and SM C were harvested.ECCM,ECCM conditioned in the presence of Phosphoramidon,SMCCM a nd ET-1 were added individually to the cultures.Proliferation rate of the cellswas measured with 3 H-thymidine incorporation on 3 days.Result:ECCM and E T-1 significantly increased the proliferation of SMC in a dose-dependent manne r with a maximal effect of 199%±11%(100% ECCM) and 166%±9%(100pg/ml ET-1)resp ectively.ECCM conditioned in the presence of Phosphoramidon reduced the mitogeni c effect by 33%±2%.SMC conditioned medium elicited a dose dependent decrease ofcultured EC proliferation with a maximal effect of 78%±3% over basal level.C onclusion:ECCM and ET-1 had a mitogenic effect on SMC.Phosphoramidon could sign ificantly reduce the mitogenic effect of ECCM.SMCCM had an effective inhibitionon EC proliferation.
KeywordsVascular endothelial cellVascular smoo th muscle cellProliferation
血管内皮细胞(EC)和平滑肌细胞(SMC)是大血管壁的两种主要细胞 类型,在结构及功能上存在密切联系,血管内皮层的完整对血管的稳定性起着很大作用 〔1〕,EC通过释放血管收缩和舒张物质,且在二者的相互影响下调节着血管的紧张程度 。此外SMC也影响着EC血管活性因子的合成与分泌。本研究是组织工程人工血管实验研究的 一部分,其目的是为EC和SMC间复杂的调节作用,即有关细胞复制、生长因子活性和增殖方 面提供一定的实验依据。本实验主要研究①血管内皮细胞条件培养基(ECCM)、内皮素-1(ET -1)和内皮素转化酶抑制剂(Endothelial-coverting enzyme inhibitor)Phosphoramidon存在条件下ECCM对SMC增殖的影响作用;②血管平滑肌细胞条件培养基(SMCCM)对体外培养的 EC增殖作用的影响。实验采用细胞培养方法排除血管壁其它组成部分可能存在的干扰作用。
1材料和方法
1.1细胞培养
EC来源于重2.5kg~3.0kg新西兰雄性家兔的主动脉。家兔由第四军医大学实验动物中心提 供。动物经戊巴比妥钠(30mg~40mg/kg,iv)麻醉后,无菌条件下取出主动脉,迅速放入PBS 液中。将血管内径翻转,冲净内壁后,放入含1mg/ml胶原酶(Ⅰ型,Gibco公司)、4mg/ml牛 血清白蛋白的DMEM(Dulbeccos midufued Eagle medium,Gibco公司)培养液中,放于37℃条 件下25分钟。收集消化液并离心,将离心下的兔主动脉EC吹打均匀,培养在含20%新生牛血 清(Hyclone公司)的DMEM液中。当细胞融合为单层时,用0.125%胰蛋白酶进行消化传代。实 验采用的EC为第3~8代细胞。SMC采用组织块法进行培养,即将血管平滑肌层切割成1.0mm32的小块,然后在10%新生牛血清(Hyclone公司)的DMEM培养液中进行培养。培养条件为37 ℃、5% CO2、95%空气。每周更换培养液2次。当原代培养的细胞达到相对融合状态时,用 0.125%胰蛋白酶进行消化传代。实验采用的SMC为第2~6代细胞。
1.2条件培养液(CM)收集
为了获得CM,将两种细胞分别种植于24孔培养板中(EC和SMC分别为105/孔),加入含10%新 生牛血清的1ml DMEM培养液。细胞培养过夜后即牢固地贴附在每孔的底部形成单层。第二日 ,用无血清的DMEM培养液清洗孔内的EC或SMC各四次。在第3次和第4次冲洗的间隔中,将细 胞在无血清的DMEM培养液、37℃条件下培养3小时,以便更完全地去除血清蛋白。在4次冲洗 完成后,1ml无血清DMEM培养液加入到EC或SMC培养的孔中。其中部分EC的培养板孔中,加入 含10μ mol/l Phosphoramidon的1ml无血清DMEM培养液。在继续培养24小时后,ECCM或SMCC M加入到培养细胞中以测定其对细胞增殖的影响。
1.3ET-1和Phosphoramidon
在体外条件下,测定内皮素对SMC增殖的刺激作用时,应用的是合成的内皮素-1(ET-1,Fl uca 公司)。ET-1溶液是将其溶解于无血清的DMEM培养液中配制而成。其用于SMC增殖试验 浓度介于0.01pg/ml和100pg/ml之间。将含Phosphoramidon(10μ mol/L)的ECCM加入到培养 的SMC中,以估计ECCM中ET-1对SMC生长的作用。
1.4细胞增殖的测定
细胞增殖的测定是采用常见的3H掺入法。简要地说,分别将EC和SMC用胰蛋白酶消化后, 接种在96孔板中(1042/孔),加入含10%新生牛血清的DMEM培养液(100μl/孔)。细胞培养过 夜后,类似于收集条件培养基一样,用无血清DMEM培养液连续冲洗4次。冲洗完成后,ECCM 加入到SMC培养系统中。同理,SMCCM加入到EC培养系统中,细胞培养于微孔中,37℃条件下 培养3天。所选择的培养时间是按Leszczynski等报导的〔2〕。在培养第3天之前的最 后6个小时内,将〔3H〕-TdR(3.7kBq/1042个细胞)分别加入到EC和SMC培养系统中。当 培养期终止时,冲洗微孔中的细胞,在β计数器中收集并记数。
1.5记数与统计分析
所有实验重复3次,其结果表示为±S,统计分析采用单因素方差 分析,差异性显著(P<0.05)。
2结果
2.1条件培养基对细胞增殖的影响
所有实验均采用无血清培养基避免各种血清源性生长调节分子的存在。在相差显微镜下观察 EC或SMC在无血清培养液中的形态、生长方式呈正常状态(图1、2)。在加入条件培养基后, 于无血清条件下培养72小时,EC或SMC同样无形态及外观的改变。
无血清培养条件下相差显微镜观察融合的单层EC呈典型的" 鹅卵石"样外观。×200
在无血清DMEM培养液中培养EC 24小时所获取ECCM有强烈的促增殖作用。不同 浓度的ECCM(25%、50%、100%)可明显增加SMC的增殖。在培养3天后,与在无血清DMEM培养液 中培养的SMC相比较,ECCM(100%)可使SMC增殖增加90%(P<0.05)。(图3) 
图3不同浓度的ECCM作用SMC 3天对其增殖的影响
当采用不同浓度的SMCCM(25%、50%、100%)处理EC,随着浓度增加,EC的增殖 率降低。SMCCM可降低〔3H〕-TdR掺入量约78%(P<0.05)。(图4)
2.2ET-1对SMC生长的影响
将外源性的ET-1(0.01~100pg/ml)加入到SMC培养系统中,它可对SMC产生 浓度依赖性增殖作用。ET-1的终浓度为100pg/ml。其最大效应为166%±9%(图5,P <0.05)。为了证实ET-1是ECCM中促进SMC增殖的主要动力,故在ECCM中加入Phos phoramidon(10μ mol/L)。在ECCM的浓度为15%时,这一处理可使细胞增殖率降低33%±2%( P<0.05),由于Phosphoramidon对SMC的增殖并无作用,故以上结论得到 了证实。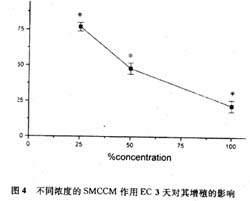
图4不同浓度的SMCCM作用EC 3天对其增殖的影响
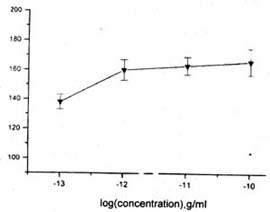
图5不同浓度的ET-1作用SMC 3天的增殖状况。数值为以与基数条 件下(指SMC在含ET-1的无血清条件下的增殖状况)3H掺入量相比的百分数。以上各结果采 用±S表示(n=3)
3结论
许多资料显示EC或SMC,即大血管壁的两种主要细胞类型,显然有能力产生一些细 胞因子,通过自分泌或旁分泌的方式,影响到细胞的迁移与增殖〔3〕。
EC可以合成大量的物质如碱性成纤维细胞生长因子(bFGF)、胰岛素样生长因子-1(IGF-1) 、ET-1等,它们都可明显地促进SMC的增殖〔4〕。本实验表明将EC培养在无血清条 件下所获得的ECCM可明显地促进SMC的增殖,这一结论与其它一些研究者的相类似〔5〕 。将外源性的ET-1加入到培养的SMC中时,它所起到的是一种增殖因子的作用。而且,在 本实验中,含有内皮素转换酶抑制剂Phosphoramidon的ECCM将阻碍体外培养的EC的分泌作用 。这一处理减少了ECCM诱导的SMC的增殖作用,从而阐明ET-1可能参与了EC对SMC增殖方面 的调节作用。
为进一步研究体外条件下EC和SMC之间的相互影响,我们将SMCCM加入到EC培养系统中,结果 显示SMCCM对于体外培养的EC具有明显的抑制作用。
近来,一些作者报导SMC也可能产生某些生长调节物质,如内皮细胞生长因子(ECGF),肿瘤 生长因子-β(TGF-β)〔6〕等。EC是仅有的一种表达ECGF受体的细胞〔7〕 。而且,一些SMC产生的生长调节物质对于血管内的各种细胞类型有着不同的作用〔8〕 。具有多种功能的TGF-β,可促进SMC的迁移但同时抑制EC的迁移。也有报导称SMCCM能 够明显地减少EC产生的ET-1,这可能是由于SMC自身产生了一种抗增殖作用,因此细胞壁的 细胞与细胞间必然存在着一定的平衡。我们的结果与认为一个被观察到的血管反应是几类细 胞和多种生长调节成份相互作用结果的观点相一致。为了使组织工程人工血管的研究进一步 深化,研究不同条件下血管壁细胞生长的调节介质和调节因子是未来的主要任务之一。
参考文献
1Rubanyi GM.The role of endothelium in cardiovascular homeostasis anddiseases.J Cardiovasc Pharmacol,1993;(1):8:344
2Leszczynski D, Zhao Y,Yeagley TJ,at al.Direct and endothelial cell-mediated e ffect of cyclosporin A on the proliferation of rat smooth muscle cells in vitro. Am J Pathol.1993;142(1):149
3Segal SS.Cell-to-cell communication coordinates blood flow control.Hypertensi on,1994;23:1113
4Arnqvist HJ,Bornfeldt KE,Chen Y,et al.The insulin-like growth factor system i n vascular smooth muscle:interaction with insulin and growth factors.Metabolism, 1995;44(10 Suppl 4):58
5Dariusz L,Yejun Z,Thomas JY,et al.Direct and endothelial cell-mediated effectof cyclosporin A on proliferation of rat smooth muscle cells in vitro. Am J Pat hol,1993;142(1)149
6Bauriedel G,Kandolf R,Welsch U,et al. Mechanisms of restenosis after angiopla sty.Z Kardiol,1994;83(Suppl 4):31
7Gildberg MA,Schneider TJ.Similarities between the oxygensensing mechanisms re gulation the expression of vascular endothelial growth factor and erthropoietin. J Biol Chem,1994;269(6):4355
8Redmond EM, Cahill PA,Sitzmann JV.Flow-mediated regulation of endothelin rece ptors in cocultured vascular smooth muscle cells:an endothelium-dependent effect .J Vasc Res,1997;34(6):425
收稿日期2000-03-05
编辑/姜如蓉

