荒漠草原土壤呼吸及其组分对持续干旱及再湿润的响应








摘要:气候变化下频繁和严重的干湿循环事件对荒漠化草地生态系统的碳循环产生不可估量的影响。本研究2023年在短花针茅(Stipa breviflora Griseb)荒漠草原生长季初期(5—6月)和旺盛期(7—9月)设置了持续干旱及再润湿模拟试验,测定土壤总呼吸(Soil respiration, Rs)和土壤异养呼吸(Soil heterotrophic respiration, Rh),同时测量表层土壤温度、湿度和土壤微生物生物量碳含量,以及对样地进行了植被调查。结果表明:持续干旱及再湿润均显著影响Rs与Rh,生长季旺盛期Rs和Rh较生长季初期对土壤水分的响应更强烈;Rh是荒漠草原生态系统土壤碳排放的主要成分,占比约为63.0%,其受土壤微生物生物量碳含量影响显著;土壤自养呼吸(Soil autotrophic respiration, Ra)主要受植被生物量的影响,但由于土壤根际微生物受土壤温度和土壤水分的影响,Ra与地上和地下生物量线性关系不显著。本研究对评估荒漠草原生态系统碳平衡与量化土壤碳排放过程具有指导意义。
关键词:短花针茅荒漠草原;土壤异养呼吸;土壤自养呼吸;干旱胁迫;复湿
中图分类号:S812""""""" 文献标识码:A""""""" 文章编号:1007-0435(2025)02-0535-12
Responses of Soil Respiration and its Components to Persistent Drought and Rewetting in Desert Steppe
SUN Zhi-qiang1,2,3#, HAN Chun-xue1,2,3#, LI Hai-gang1,2,3*
(1.College of Grassland and Resource Environment, Inner Mongolia Agricultural University, Huhhot, Inner Mongolia 010018, China;
2.Key Laboratory of Soil Quality and Nutrient Resources of Inner Mongolia Autonomous Region, Hohhot, Inner Mongolia 010018, China;
3.Key Laboratory of Agricultural Ecological Safety and Green Development of Autonomous Higher Education Institutions, Hohhot, Inner
Mongolia 010018, China)
Abstract:The frequency and severity of wet-dry cycle events are increasing under climate change, potentially exerting an immeasurable impact on the carbon cycle of desertification grassland ecosystems. The simulation experiments with continuous drought for 30 days and 50 days and rewetting were conducted during the early growing season (May-June) and peak period (July-September) of 2023 in Stipa breviflora Griseb desert steppe. Soil respiration (Rs) and soil heterotrophic respiration (Rh) were quantified. Simultaneously, measurements were taken for the surface soil temperature, soil moisture content and soil microbial biomass carbon were measured. In addition, the vegetation of the sample plots was investigated. The results showed that: (1) Both continuous drought and rewetting significantly impacted on Rs and Rh, with a stronger response of Rs and Rh to soil moisture content observed during the peak of the growing season compared to the early stage; (2) Rh represented the primary process and form of carbon release in desert steppe ecosystems, accounting for approximately 63.0%, while soil microbial biomass carbon content significantly influenced Rh; (3) Soil autotrophic respiration (Ra) was primarily influenced by vegetation biomass, but there was no significant linear relationship between Ra and biomass due to the impact of soil temperature and soil moisture content on soil rhizosphere microorganisms. This study held guiding significance for assessing carbon balance in desert steppe ecosystems as well as evaluating soil carbon emissions.
Key words:Stipa brevifloris desert steppe;Soil heterotrophic respiration;Soil autotrophic respiration;Drought stress;Re-wetting
由于全球水文循环的变化,未来土壤干湿循环将加剧[1]。已有研究表明,干旱区和半干旱区在近50年来连续无降水事件次数显著增加,且最长连续无降水日数呈线性增加趋势,平均持续日数以6~8天为最多,最大持续无降水日数以30~50天最多[1-2]。极端的气候状况将使干旱和半干旱生态系统更容易受到干旱风险和暴雨可能性增加的影响[3],未来土壤干湿循环在降水异常、高温且干燥的地区变得尤为频繁。干旱胁迫会使土壤有机质的物理保护作用增强,微生物可利用的底物减少,抑制土壤微生物的活性,从而减弱了土壤的矿化作用,有利于土壤有机碳的储存[4-5]。干旱胁迫会降低植物叶片气孔导度、光合酶的活性和浓度,改变土壤养分状态及其有效性[6-7],降低植物生产力,导致植物向土壤中输入的碳减少[8]。降雨再湿润会破坏土壤团聚体释放有机物,增强地下微生物活性[9]。在半干旱草地生态系统,土壤干湿循环加速了土壤有机质的矿化作用,从而促使土地碳流失[10]。鉴于上述研究背景,揭示土壤干湿循环对荒漠化草地生态系统碳循环的影响,对降低该生态系统受气候变化影响的不确定性至关重要。
土壤呼吸 (Soil respiration, Rs) 作为全球陆地碳循环中重要的通量,也是生态系统主要的碳排放源[11]。Rs可以根据其成分被分类为微生物分解有机碳并释放CO2的土壤异养呼吸(Soil heterotrophic respiration, Rh),这一过程依赖于微生物的活性和底物的可用性;以及源于根部和根际,并由新近同化的碳分配来调控的自养呼吸(Soil autotrophic respiration, Ra)[12-13]。先前研究表明,Rh对土壤水分更敏感,干旱胁迫对Rh的消极影响显著大于Ra [14-15]。持续干旱或使土壤向微生物群落蔓延的有机溶质减少,从而限制Rh[16-17]。此外,干旱胁迫对生态系统中Ra的影响取决于植物和植物根系对干旱的反应 [18],干旱胁迫可能会限制植物的生长,减少凋落物的输入,限制光合产物的供应,减少根系的呼吸[19]。综上所述,干旱胁迫对Rh是直接影响,而对Ra是间接影响,Rh受外部环境的影响较大。降水再湿润通过直接影响土壤湿度和土壤微生物活性,间接影响植物生长、凋落物分解和基质的可利用性[20-22],从而对土壤呼吸及其组分产生较大影响。揭示土壤呼吸及其组分在应对持续干旱情景时的响应规律,跟踪持续干旱后降雨处理对土壤呼吸及其组分的后续影响具有重要意义。
荒漠草原是我国生态屏障的前沿阵地,在国家生态安全格局中具有极其重要的价值。内蒙古自治区约有142万hm2的荒漠草原,占中国草原总面积的18%[23],但荒漠草原生态系统稳定性较差、结构简单、植被覆盖度低[24]。区分和量化土壤呼吸组分对于荒漠草原生态系统碳平衡的精确评估和对土壤碳排放及其对气候变暖响应的定量评估,对于了解碳转化过程及其对环境因素的适应性和响应性具有深远的意义。本研究的具体目的是:(1) 研究持续干旱及再润湿对短花针茅荒漠草原土壤呼吸及其组分的影响过程;(2) 探究生长季初期和旺盛期持续干旱及再湿润对荒漠草原土壤呼吸及其组分的影响因子。
1 材料与方法
1.1 研究区概况
以短花针茅 (Stipa breviflora Griseb)荒漠草原为研究对象,选取内蒙古乌兰察布市四子王旗阿德格野外试验基地(42°02′17″ N,112°30′57″ E,海拔1328 m)为研究区。研究区位于温带干旱半干旱大陆性季风气候区,多年(1961—2020年)平均降水量304 mm,降雨主要集中在5—10月,降雨量约275.8 mm,占年总降雨量的90%以上,年平均蒸发量为2180 mm,年平均气温3.8℃。研究区土壤类型为轻板栗钙质土,土壤质地为砂壤。草地类型属于荒漠草原,植物群落简单,植被平均盖度为9%,以多年生或一年生草本为主,优势物种包括短花针茅、无芒隐子草[Cleistogenes songorica (Roshev.)Ohwi]、栉叶蒿[Neopallasia pectinata(Pall.)Poljakov]等。
1.2 试验设计
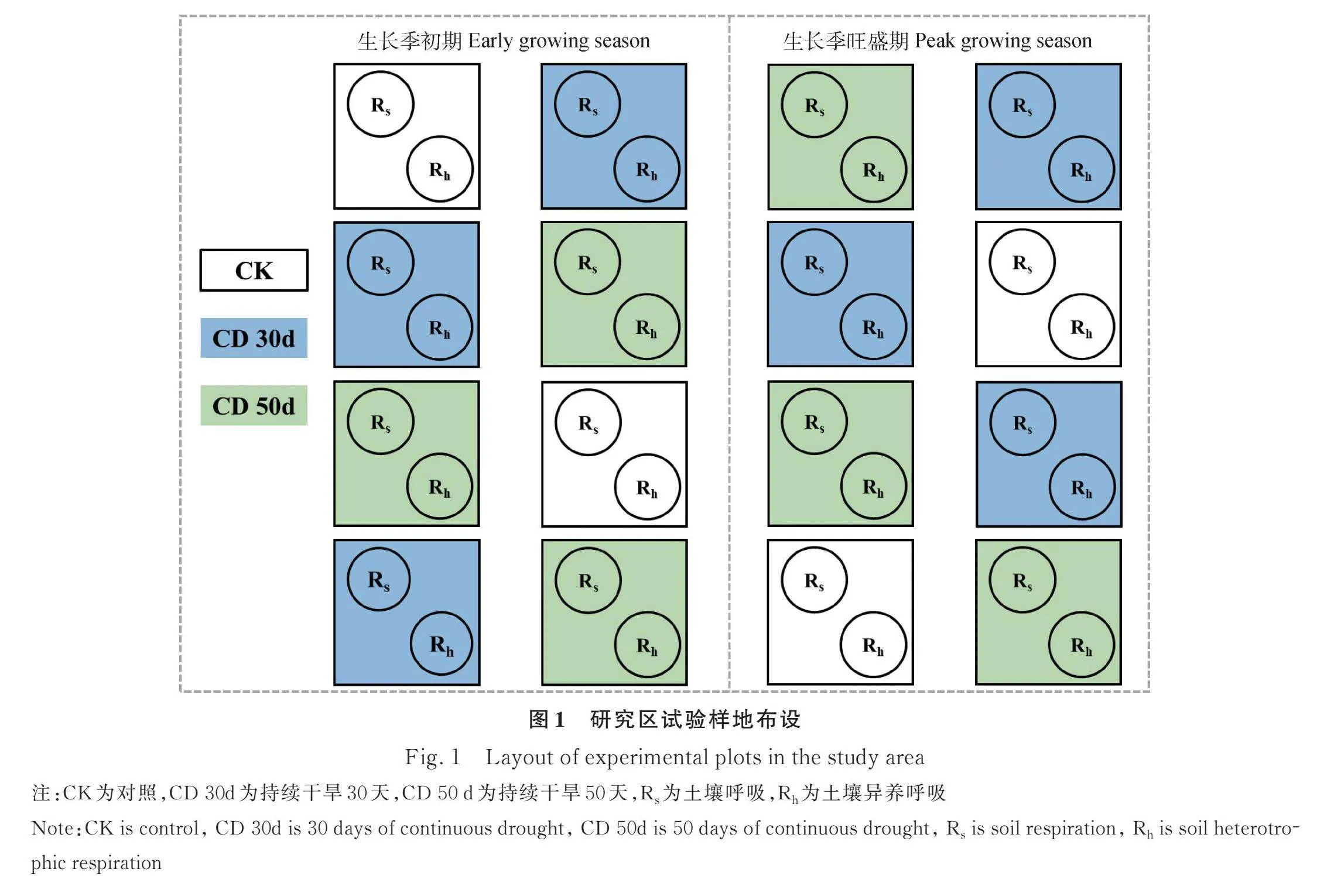
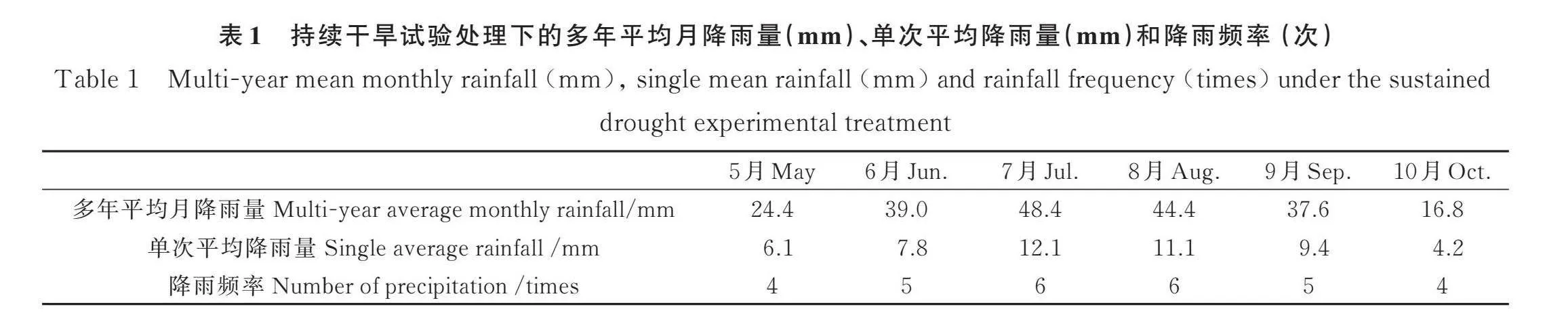
在研究区选择地势平坦且有典型植被分布的试验样地50 m×50 m,用围栏围封以阻止人为和牲畜等的干扰。采用遮雨棚截留全部雨水,根据60年(1961—2020)的降雨得到月平均降雨量和频次(表1)对试验区进行人工降雨。在生长季初期(5月初)和生长季旺盛期(7月中旬)两个时期分别进行持续30天和50天的干旱处理,即停止人工降雨,干旱结束后对试验小区恢复人工降雨。采用完全随机实验设计,设置了3个水平处理,分别为模拟正常降雨(CK),持续干旱30天(CD 30d)和持续干旱50天(CD 50d),每个处理重复三次(CK重复利用),共计15个1 m×1 m的小区,每个小区间隔0.5 m,并埋设隔水板,防止土壤水分横向运移。为了避免边界效应,观测点选在每个样地靠近中心位置。3月底在每个样地内均安置2个自制的直径为20 cm PVC环,一个高6 cm,插入地下3 cm,用于Rs测量。PVC环插入地面以下3 cm既可以保证观测时PVC环的稳定,又可以减少对表层土壤根系生长的影响;另一个高40 cm,插入地下37 cm,插入地面以下37 cm能排除大约88%~91%的新生根系,消除了相关的根系呼吸,用于Rh测量(图1)。Ra由Rs与Rh(校正后的)差值获得。
1.3 土壤呼吸及其组分、土壤温度和土壤含水量监测
在荒漠草原生长季节(5—10月)用便携式自动土壤C通量系统(Li-6800;Li-CorInc.,Lincoln,NE, USA)测定Rs和Rh,每周测量1次,选择晴朗无云天气的上午8:00-11:00。每次测量前24小时,清除监测Rs PVC环内的新增的凋落物等杂物并齐地剪掉绿色植被以消除测量过程中地上的植物呼吸,并检查监测Rh PVC环内新出现的植被,将其连根拔出。持续干旱结束后进行Rs和Rh的测定,测定结束后按照表1进行人工模拟降雨。为避免因增水处理刺激土壤孔隙气体逸出和扰动地表气压引起的Rs和Rh偏差,降雨48小时后再进行Rs和Rh的测定。
土壤温度和土壤水分的观测与测定Rs和Rh同步进行,利用 Li-6800自带的土壤热电偶探针测量0~10 cm 土壤温度和TDR-300探头测量0~10 cm土壤体积含水量。由于PVC环会干扰土壤中水的横向运移,因此同时测量了环内和环外的土壤温度和土壤水分。此外,由于荒漠草原土壤水分较低,在仪器测定范围的边缘,为降低仪器测定的误差,同步收集了样地附近0~10 cm土壤样品,利用烘干法测定土壤质量含水量(θs),对TDR-300测定的土壤水分进行校正。用于统计分析和制图的土壤水分均为矫正后的土壤水分。
土壤含水量校正公式:
θ_s=0.61×M_s+0.01
(R2=0.69,Plt;0.0001,n=32)
式中:Ms为TDR-300测定土壤含水量,θs为校正后的土壤含水量。
1.4 土壤微生物碳采集与测定
在持续干旱实验结束与再湿润48小时后分别在每个样地PVC环外使用内径为5 cm的土钻随机钻取0~20 cm土壤3次,将其充分混匀制成混合土壤样品后放入4℃保温箱内迅速带回实验室,用于土壤微生物碳的测定。采用氯仿-熏蒸直接浸提法,氯仿熏蒸土壤时由于微生物的细胞膜被氯仿破坏,微生物死亡,细胞质在酶的作用下自溶或转化为可被K2SO4提取成分。测定提取液中的碳含量,以熏蒸与不熏蒸土壤中提取碳增量除以转化系数来估计土壤微生物碳:
(土壤微生物生物量碳@(Soil microbial biomass carbon,MBC)=@E_C/K_EC )
式中:EC为熏蒸土壤提取的有机碳和不熏蒸土壤提取的有机碳的差。KEC为转换系数,取值0.45。
1.5 地上和地下生物量获取
在生长季每个月底进行植被调查,选择时间为持续干旱开始10天前和再湿润30天后进行植被的高度、密度和覆盖度的记录。为确保样地不被破坏,在生长季旺盛期(2023-07-26)试验样地附近同时随机选取了20个1 m×1 m的校正小区同步进行植被调查。将植株地上连同0~20 cm地下根系全部挖出,去除根系上附着的部分土壤后,将植株装入袋中,带回实验室分离植株地上部与地下部并进行分类、清洗、烘干(65℃)和称重,记录不同植被类型植物的地上部与地下部的干重。将植被调查的覆盖率(盖度)与相应的植物干重进行线性拟合,利用线性关系间接得出试验地块植物的地上生物量[25]。盖度与地下生物量的线性拟合也达到显著,故利用拟合结果间接得到地下生物量。根据植被功能群落建立盖度与生物量的拟合方程(表2),多年生禾本科包括短花针茅、无芒隐子草与羊草 [Leymus chinensis (Trin.) Tzvel];多年生非禾本科包括银灰旋花(Convolvulus ammannii Desr. in Lam)、蒙古葱(Allium mongolicum Regel)、细叶葱 (Allium tenuissimum L)、阿尔泰狗娃花(Aster altaicus Willd)、兔唇花(Lagochilus Bunge)、猪毛蒿(Artemisia scoparia Waldst. et Kit.) 与糙叶黄芪(Astragalus scaberrimus Bunge);一年生非禾本草本植物包括栉叶蒿[Neopallasia pectinata (Pall.) Poljakov]与猪毛菜(Salsola collina Pall);半灌木包括冷蒿(Artemisia frigida Willd)。
1.6 计算与统计分析
持续干旱呼吸速率降低比率:
Ratio=(Rx_tre-Rx_CK)/(Rx_CK )×100%
再湿润使呼吸速率增加比率:
(Ratio=((Rx_(CK_湿润后 )-Rx_(CK_湿润前 ))/(Rx_(CK_湿润前 ) )-@(Rx_(CD xd_湿润后 )-Rx_(CD xd_持续干旱后 ))/(Rx_(CD xd_持续干旱后 ) ))×100%)
式中,Ratio代表比值(%),Rxtre代表对应干旱胁迫处理土壤呼吸及其组分;Rx代表对应日期土壤呼吸及其组分(μmol·m-2·s-1),RxCK湿润后代表对照组湿润48小时后的土壤呼吸及其组分(μmol·m-2·s-1),RxCK湿润前代表对照组湿润前土壤呼吸及其组分(μmol·m-2·s-1),RxCD xd湿润后代表试验组持续干旱x天湿润48小时后的土壤呼吸及其组分(μmol·m-2·s-1),RxCD xd持续干旱后代表试验组持续干旱x天后的土壤呼吸及其组分(μmol·m-2·s-1)。
土壤累计碳排放量:采用日累积法估算土壤呼吸及其组分的碳排放量。日累积法是从2023-04-30至2023-09-16,计算每个测量周期的土壤呼吸碳排放量,然后逐日累积整个观测期的土壤呼吸及其组分碳排放量。周期内土壤呼吸及其组分碳排放量的计算公式为
R=R_x×3600×24×12/〖10〗^6
式中,R代表土壤呼吸及其组分的日碳排放量(g·m-2),Rx代表日平均土壤呼吸及其组分速率(μmol·m-2·s-1)。
利用方差分析(ANOVA)对PVC环内外的土壤温度和土壤水分进行差异性检验,发现只有用于监测Rh的PVC环内外的土壤水分存在显著性差异(Plt;0.05)。因此,将PVC环外的土壤水分代入到环内土壤水分与Rh 之间的拟合方程反演得到环外Rh用于结果分析。土壤水分为烘干法校正后的土壤水分。
采用线性回归分析土壤呼吸及其组分与土壤温度和土壤水分之间的关系,并分析Rh与土壤微生物生物量碳之间的关系以及Ra与地上、地下总生物量之间的关系。使用SPSS和SAS 9.4进行统计分析,方差分析(ANOVA)进行差异性检验(Plt;0.05),图表均是由Excel 2010和ORIGIN 2024绘制。
2 结果与分析
2.1 持续干旱及再湿润对土壤呼吸及其组分、土壤温度和土壤水分的影响
荒漠草原生长季Rs,Rh和Ra变化范围分别为0.39~1.63 µmol·m⁻²·s⁻¹,0.30~0.69 μmol·m⁻²·s⁻¹和0.07~0.87 μmol·m⁻²·s⁻¹,平均值分别为0.75 µmol·m⁻²·s⁻¹,0.45 µmol·m⁻²·s⁻¹和0.31 μmol·m⁻²·s⁻¹。生长季初期和旺盛期土壤温度变化范围分别为16.4℃~35.8℃和20.3℃~38.1℃,土壤水分变化范围分别为2.8%~13.4%和3.1%~17.1%。
生长季初期CD 30d和CD 50d Rs分别较CK下降13.7%与19.4%,在持续干旱第11天与CK才出现显著性差异;生长旺盛期CD 30d和CD 50d Rs分别较CK下降15.5%与30.5%,在持续干旱第16天与CK才出现显著性差异。生长季初期和旺盛期CD 30d和CD 50d再湿润48小时后Rs均恢复到CK水平。CD 30d和CD 50d再湿润后Rs分别比持续干旱结束时生长季初期高22.6%和21.2%,比生长季旺盛期Rs高57.0%和182.5%。Rs对持续干旱和再湿润的响应在生长季旺盛期要比生长季初期更强烈。
生长季初期CD 30d和CD 50d Rh分别较CK下降4.6%与9.2%,在持续干旱第19天才与CK出现显著性差异,生长旺盛期CD 30d和CD 50d Rh分别较CK下降11.4%与18.8%,在持续干旱第16天才与CK出现显著性差异。生长季初期CD 30d和CD 50d再湿润48小时后Rh恢复到CK水平,但生长季旺盛期CD 30d和CD 50d Rh均在再湿润后第8天才恢复到CK水平。CD 30d和CD 50d再湿润后Rh分别比持续干旱结束时生长季初期高3.6%和4.9%,比生长季旺盛期Rh高24.6%与40.0%。Rh对持续干旱和再湿润的响应在生长季旺盛期要比生长季初期更强烈。
生长季初期CD 30d和CD 50d Ra分别较CK下降9.1%与10.2%,持续干旱第11天才与CK出现显著性差异,持续干旱40天后Ra与CK相比又表现出无显著差异。生长旺盛期CD 30d和CD 50d Ra与CK相比均未出现显著性差异。生长季初期CD 30天再湿润48小时后Ra 恢复到CK水平,CD 50d再湿润48小时后与CK相比无显著差异,生长季旺盛期再湿润48小时后与CK相比均未出现显著性差异。CD 30d和CD 50d再湿润后Ra分别比持续干旱结束时生长季初期高19.0%和16.3%,比生长季旺盛期Ra高35.4%与142.5%。
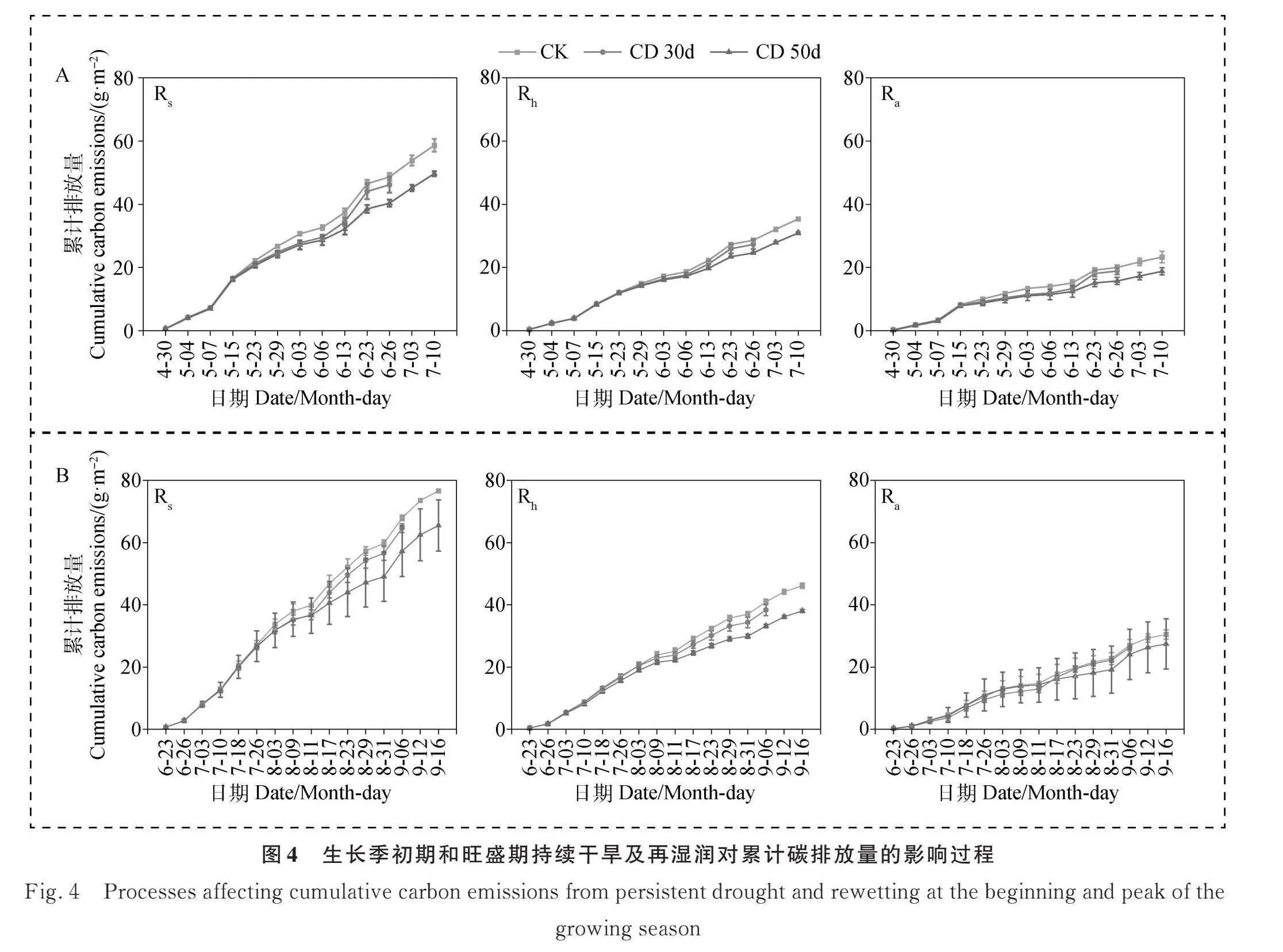
在生长季初期CD 30d和CD 50d Rh占Rs比例平均分别为64.0%和66.2%,Ra占Rs比例平均分别为36.0%和33.8%。在生长季旺盛期CD 30d和CD 50d Rh占Rs平均分别为63.1%和64.0%,Ra占Rs比例平均分别为36.9%和36.0%。生长季初期CD 30d和CD 50d 再湿润后Rh的贡献率增加了9.5%与2.4%,随着降雨的进行,Ra的贡献率逐渐增加(图4a-b);生长季旺盛期CD 30d和CD 50d 再湿润后Ra的贡献率分别增加了32.1%与38.4%(图4c-d)。持续干旱后再湿润Rs的增加在生长季初期Rh是主要贡献者,在生长旺盛期Ra是主要贡献者。
2.2 持续干旱结束前及再湿润后累计碳排放量及土壤微生物生物量碳的变化
生长季初期CD 30d和CD 50d Rs的累计碳排放量分别为27.0 g·m-2与37.8 g·m-2,较CK降低9.7%与17.4%;Rh的累计碳排放量分别为16.1 g·m-2与23.1 g·m-2,分别较CK降低2.8%与8.4%;Ra的累计碳排放量分别为10.9 g·m-2与14.7 g·m-2,分别较CK降低6.9%与8.9%。CD 30d和CD 50d 再湿润后Rs的累计碳排放量分别为28.8 g·m-2与39.6 g·m-2,分别较CK降低9.8%与17.3%;Rh的累计碳排放量分别为17.4 g·m-2与24.3 g·m-2,分别较CK降低3.0%与8.3%;Ra的累计碳排放量分别为11.4 g·m-2与15.3 g·m-2,分别较CK降低6.8%与9.0%(图4A)。
在生长季旺盛期CD 30d和CD 50d Rs的累计碳排放量分别为35.1 g·m-2与47.2 g·m-2,分别较CK降低7.5%与17.7%;Rh的累计碳排放量分别为22.9 g·m-2与29.0 g·m-2,分别较CK降低2.3%与11.7%;Ra的累计碳排放量分别为12.2 g·m-2与18.2 g·m-2,分别较CK降低5.2%与6.0%。CD 30d和CD 50d再湿润后Rs的累计碳排放量分别为36.8 g·m-2与49.1 g·m-2,分别较CK降低7.5%与17.9%;Rh的累计碳排放量分别为23.9 g·m-2与29.9 g·m-2,分别较CK降低3.0%与11.9%;Ra的累计碳排放量分别为13.0 g·m-2与19.2 g·m-2,分别较CK降低4.5%与6.0%(图4B)。持续干旱会导致土壤呼吸及其组分累计碳排放量的下降,再湿润后土壤呼吸及其组分累计碳排放量没有出现增加现象,趋于平缓。
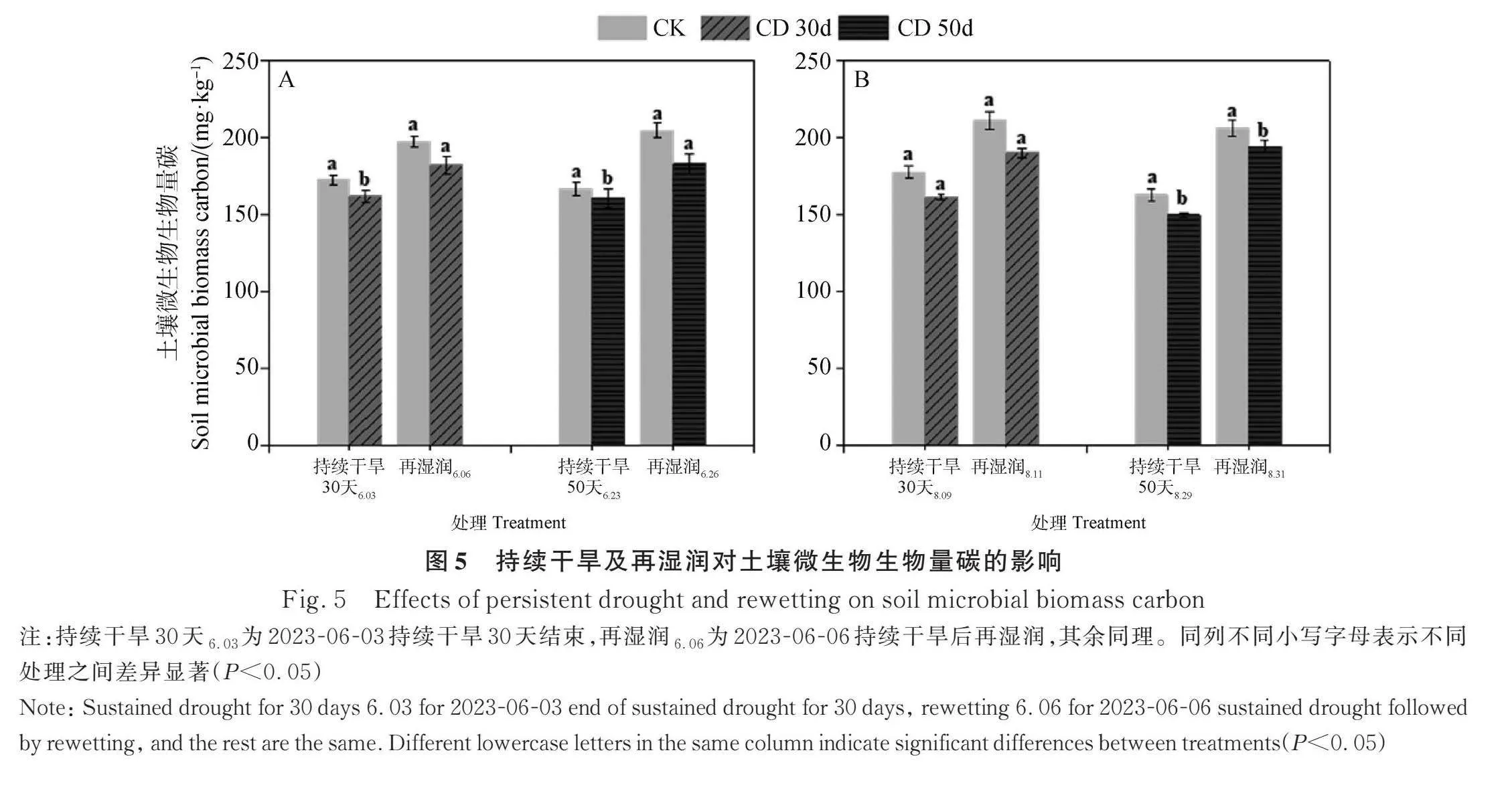
生长季初期和生长旺盛期,CD 30d和CD 50d 均会显著降低土壤微生物碳的含量(Plt;0.05)(图5) ,生长季初期分别从172.8 mg·kg-1降到162.1 mg·kg-1和167.1 mg·kg-1降到160.5 mg·kg-1,分别降低6.2%与3.9%;生长季旺盛期分别从177.8 mg·kg-1降到161.4 mg·kg-1和163.0 mg·kg-1降到150.0 mg·kg-1,分别降低9.2%与8.0%。再湿润48小时后土壤微生物碳含量在生长季初期恢复到CK水平,但在生长季旺盛期未恢复到CK水平(Plt;0.05)。
2.3 持续干旱及再湿润地上地下生物量的变化
生长季初期CD 30d和CD 50d会显著降低荒漠草原地上植被与地下根系的生物量的增长量,与CK相比地上植被生物量增长量分别降低了10.60 g·m-2与14.32 g·m-2,地下根系生物量增长量分别降低了15.48 g·m-2与17.59 g·m-2。生长季旺盛期持续干旱不会对荒漠草原地上植被与地下根系的生物量产生影响。
生长季初期CD 30d和CD 50d 再湿润后会显著提高荒漠草原地上植被与地下根系的生物量的增长量,与CK相比地上植被生物量增长量分别提高了7.96 g·m-2与12.79 g·m-2,地下根系生物量增长量分别提高了7.45 g·m-2与8.98 g·m-2。生长季初期地下根系生物量增长后仍出现显著性差异。生长季旺盛期再湿润不会对其地上与地下生物量产生影响。
2.4 土壤呼吸及其组分与影响因素的线性关系
土壤温度与土壤呼吸及其组分均呈现非显著的负相关线性关系,土壤水分与土壤呼吸及其组分的线性关系呈现极显著的正相关线性关系(图6),这表明在短花针茅荒漠草原土壤呼吸及其组分可能受土壤水分的影响。Rh与土壤微生物生物量碳同样呈现极显著正相关的线性关系,表明土壤微生物生物量碳的变化是Rh变化的另一主导因子(图6g)。但Ra与地上和地下总生物量的线性关系均未达到显著水平。
3 讨论
3.1 持续干旱及再湿润对土壤总呼吸的影响
生长季初期和旺盛期持续干旱都使土壤水分显著降低,这导致土壤微生物和生长季初期的植被生长受到水分胁迫,迫使Rs降低。有研究表明,持续干旱导致植物的光合作用减弱,向根系输送的有机物质减少,根系呼吸和土壤微生物呼吸的底物来源随之减少[3, 26],从而影响Rh和Ra。土壤水分降低还将导致Rs和Rh环内的凋落物分解减慢,归还速率降低,有机碳的矿化作用被减弱。在进入非根际土壤碳库之前,土壤微生物把大部分植物根系分泌物分解并排放CO2到大气中[27],因此,土壤水分降低导致土壤微生物活动受限,凋落物和土壤分泌物分解减慢,所以持续干旱会降低土壤累计碳排放量。土壤在经历长期持续干旱后,降雨使土壤水分得到迅速补充,植物快速生长,土壤微生物活动加剧,促使Ra和Rh增加,进而使Rs恢复到对照水平。持续干旱期间死亡的微生物、破裂的土壤团聚体和细胞呼吸酶活性解耦释放胞内渗透液,再湿润后均成为微生物呼吸基质[28],促进了矿化作用,使得土壤累计碳排放量随着土壤呼吸及其组分的增加逐渐升高,但仍低于对照,并未出现呼吸作用的“Birch”效应。这是由于荒漠草原土壤质地为沙壤土,团粒结构少,干湿交替并不能使团粒结构破坏释放更多新的有机质[29],导致再湿润48小时后土壤呼吸及其组分只是恢复到对照水平,甚至Rh在生长旺盛期持续干旱50天再湿润后仍低于对照水平。
已有研究发现荒漠草原土壤呼吸组分中Rh为主要贡献者[30-31]。一般来说,Ra对降水改变的响应需要更长的时间和更大的降雨脉冲,因为降水后根系生长相对缓慢[32-33],而土壤微生物生物量、丰度和活性在降水后均快速升高[34]。与Ra相比,Rh在生长季初期对降水改变具有更强的响应,并在降水后对Rs的贡献更大;在生长季旺盛期再湿润后根系较生长季初期更为发达,此时光合产物向根系的供应和根呼吸更加强烈,Ra对水分的响应更强,Ra的贡献随之增加。Han等[35]发现干旱区半干旱区土壤水分低于田间持水量,生态系统受到的水限制约束显著高于土壤温度对Rs的影响。土壤水分作为影响荒漠草原Rs的关键因子,其影响作用大于土壤温度(图6),土壤呼吸及其组分与土壤水分均呈现极显著的正相关关系,与土壤温度的关系不显著,其原因是土壤水分可以直接调控微生物活动和根系的生长发育,且土壤水分综合了降水和温度对土壤条件的影响,土壤水分的限制会削弱温度对Ra的刺激效应[28,36]。持续干旱后Rs均在10天后开始出现显著性差异,其主要原因是持续干旱10天后测量Rs的环内土壤水分出现显著性差异(图2)。
3.2 持续干旱及再湿润对土壤异养呼吸的影响
土壤微生物生物量碳含量与Rh呈极显著的正相关线性关系 (图6 d),这表明持续干旱处理期间水分胁迫抑制了微生物的生长与活性,甚至诱发了微生物的死亡[37-38],最终导致Rh降低。研究还发现持续干旱再湿润48小时后生长季初期Rh恢复到对照水平,但生长季旺盛期Rh仍然存在显著性差异。这可能是由于生长季初期土壤温度低于生长旺盛期,在土壤温度较高的时候持续干旱使得土壤团聚体和土壤胶体的结合更加紧密,大部分土壤有机质难以被土壤微生物分解[39]。由此可知,植物群落和土壤微生物群落对降水变化的滞后响应是Rh表现出遗留效应的主要原因。而生长季初期Rh未出现遗留效应的原因是生长季初期的土壤温度相对较低,没有对土壤微生物的活动以及酶活性造成消极影响。降水变化对根际微生物呼吸影响具有滞后性[40],土壤微生物的群落结构及多样性对土壤水分变化的响应也存在滞后性[41-42]。综合以上因素,生长季不同时期Rh对持续干旱及再湿润表现出不同的响应。
3.3 持续干旱及再湿润对土壤自养呼吸的影响
生长季初期持续干旱使Ra显著降低,但40天后Ra与对照不再出现显著性差异。其原因可能是干旱胁迫下植物通过调控气孔闭合的方式降低蒸腾作用,植物光合作用受到抑制,植被和根系总生物量减少,Ra受到限制 (表3)。40天后荒漠草原植被的根系通过动态调节和趋水生长,主动适应土壤干旱,具有较强的干旱抵抗力[43]。生长旺盛期CD 30d和CD 50d均未显著影响Ra,也进一步印证了以上推测。生长季早期干旱对地上净生产力的抑制作用极其显著[44-45],水分减少抑制植物光合作用,导致供给根生长的光合产物减少[46],无法从更深的土壤中获取水分来保持植被的正常生长发育,进而导致地上地下生物量的减少。但荒漠草原植被有很强的抗干旱能力,到了生长旺盛期植被逐渐生长,根系变得发达可抵消持续干旱带来的负效应。但是,本研究并没有发现Ra与地上地下总生物量之间呈现显著相关关系。这可能是由于Ra除了根呼吸还包括根际微生物呼吸,土壤根际微生物可能更多地受到土壤温度和土壤水分二者的影响,且与当地植被有关系,当地植被盖度较低,平均盖度仅为9%。
4 结论
荒漠草原生长季不同时期持续干旱及再湿润均显著影响Rs与Rh,但由于荒漠草原植被较强的抗旱能力,生长季初期持续干旱40天后和生长旺盛期Ra不再受其影响。持续干旱抑制Rs与Rh累计碳排放量,再湿润后Rs与Rh累计碳排放量有所上升但仍低于对照水平。Rh为Rs主要贡献者,占比约为63.0%。土壤水通过调控土壤微生物生物量碳含量和根生长影响土壤呼吸及其组分,Ra与地上和地下生物量的关系不显著。本研究探究了荒漠草原在气候变化下生长季不同时期干湿循环对土壤碳排放的影响过程,为陆地碳排放量估计提供数据支持。
参考文献
[1]"""""" 宝乐尔其木格. 1960—2020年内蒙古荒漠草原连续无降水日变化特征分析[J]. 干旱区地理,2022,45(1):46-56
[2]"""""" 刘莉红,翟盘茂,郑祖光. 中国北方夏半年最长连续无降水日数的变化特征[J]. 气象学报,2008,66(3):474-477
[3]"""""" WANG C,WANG X B,LIU D W,et al. Aridity threshold in controlling ecosystem nitrogen cycling in arid and semi-arid grasslands[J]. Nature Communications,2014,5:4799
[4]"""""" BORKEN W,MATZNER E. Reappraisal of drying and wetting effects on C and N mineralization and fluxes in soils[J]. Global Change Biology,2009,15(4):808-824
[5]"""""" SCHIMEL J,BALSER T C,WALLENSTEIN M. Microbial stress-response physiology and" its implications for ecosystem function[J]. Ecology,2007,88(6):1386-1394
[6]"""""" 徐浩然,俞富洋,贾聪慧,等. 两种灌丛化草原小叶锦鸡儿的叶片化学计量特征[J]. 草地学报,2021,29(10):2191-2199
[7]"""""" KEENAN T,SABATE S,GRACIA C. Soil water stress and coupled photosynthesis-conductance models: Bridging the gap between conflicting reports on the relative" roles of stomatal, mesophyll conductance and biochemical limitations to" photosynthesis[J]. Agricultural and Forest Meteorology,2010,150(3): 443-453
[8]"""""" REDDY C K,NYAKATAWA E Z,REEVES D W. Tillage and poultry litter" application effects on cotton growth and yield[J]. Agronomy Journal,2004,96(6):1641-1650
[9]"""""" OWLIAIE H R. Micromorphology of pedogenic carbonate features in soils of Kohgilouye, Southwestern Iran[J]. Journal of Agricultural Science and Technology,2012,14(1):225-239
[10]"""" 韦昌林,李毅,单立山,等. 降水变化对典型荒漠植物凋落物分解的影响[J]. 草地学报,2022,30(5):1280-1289
[11]"""" HAWKES C V,SHINADA M,KIVLIN S N. Historical climate legacies on soil respiration persist despite extreme changes in rainfall[J]. Soil Biology and Biochemistry,2020,143:107752
[12]"""" BAGGS E M. Partitioning the components of soil respiration:a research challenge[J]. Plant and Soil,2006,284(1):1-5
[13]"""" CHEN J,LUO Y Q,XIA J Y,et al. Differential responses of ecosystem respiration components to experimental warming in a meadow grassland on the Tibetan Plateau[J]. Agricultural and Forest Meteorology,2016,220:21-29
[14]"""" SONG W M,CHEN S P,WU B,et al. Simulated rain addition modifies diurnal patterns and temperature sensitivities of autotrophic and heterotrophic soil respiration in an arid desert ecosystem[J]. Soil Biology and Biochemistry,2015,82:143-152
[15]"""" WANG Y F,HAO Y B,CUI X Y,et al. Responses of soil respiration and its components to drought stress[J]. Journal of Soils and Sediments,2014,14(1):99-109
[16]"""" DAVIDSON E A,JANSSENS I A,LUO Y Q. On the variability of respiration in terrestrial ecosystems:moving beyond Q10[J]. Global Change Biology,2006,12(2):154-164
[17]"""" DESLIPPE J R,HARTMANN M,GRAYSTON S J,et al. Stable isotope probing implicates a species of Cortinarius in carbon transfer through ectomycorrhizal fungal mycelial networks in Arctic tundra[J]. New Phytologist,2016, 210(2):383-390
[18]"""" ZHANG C P,NIU D C,HALL S J,et al. Effects of simulated nitrogen deposition on soil respiration components and their temperature sensitivities in a semiarid grassland[J]. Soil Biology and Biochemistry,2014,75:113-123
[19]"""" GOMEZ‐CASANOVAS N,MATAMALA R,COOK D R,et al. Net ecosystem exchange modifies the relationship between the autotrophic and heterotrophic components of soil respiration with abiotic factors in prairie grasslands[J]. Global Change Biology,2012,18(8):2532-2545
[20]"""" FLANAGAN L B,SHARP E J,LETTS M G. Response of plant biomass and soil respiration to experimental warming and precipitation manipulation in a Northern Great Plains grassland[J]. Agricultural and Forest Meteorology,2013,173:40-52
[21]"""" LIU L L,WANG X,LAJEUNESSE M J,et al. A cross‐biome synthesis of soil respiration and its determinants under simulated precipitation changes[J]. Global Change Biology,2016,22(4):1394-1405
[22]"""" ZHANG N L,LIU W X,YANG H J,et al. Soil microbial responses to warming and increased precipitation and their implications for ecosystem C cycling[J]. Oecologia,2013,173(3):1125-1142
[23]"""" 中华人民共和国农业部畜牧兽医司,全国畜牧兽医总站. 中国草地资源[M]. 北京:中国科学技术出版社,1996:421-434
[24]"""" 田茹,张加涛,冯彩霞,等. 干湿年份短期恢复措施对荒漠草原群落结构和生物量的影响[J]. 草地学报,2024,32(7):2106-2117
[25]"""" GHERARDI L A,SALA O E. Enhanced interannual precipitation variability increases plant functional diversity that in turn ameliorates negative impact on productivity[J]. Ecology Letters,2015,18(12):1293-1300
[26]"""" PFLUG A,WOLTERS V. Influence of drought and litter age on Collembola communities[J]. European Journal of Soil Biology,2001,37(4):305-308
[27]"""" BORKEN W,MUHR J. Change in autotrophic and heterotrophic soil CO2 efflux following rainfall exclusion in a spruce forest[J]. Geophysical Research,2008,10:1-10
[28]"""" MOYANO F E,MANZONI S,CHENU C,. Responses of soil heterotrophic respiration to moisture availability: An exploration of processes and models[J]. Soil Biology and Biochemistry,2013,59:72-85
[29]"""" 王君,宋新山,严登华,等. 多重干湿交替格局下土壤Birch效应的响应机制[J]. 中国农学通报,2013,29(27):120-125
[30]"""" BALOGH J,PAPP M,PINTÉR K,et al. Autotrophic component of soil respiration is repressed by drought more than the heterotrophic one in dry grasslands[J]. Biogeosciences,2016,13(18):5171-5182
[31]"""" 李伟晶,陈世苹,张兵伟,等. 半干旱草原土壤呼吸组分区分与菌根呼吸的贡献[J]. 植物生态学报,2018, 42(8):850-862
[32]"""" REY A,OYONARTE C,MORAN-LOPEZ T. Changes in soil moisture predict soil carbon losses upon rewetting in a perennial semiarid steppe in SE Spain[J]. Geoderma,287:135-146
[33]"""" SCHIMEL J P. Life in dry soils: Effects of drought on soil microbial communities and processes[J]. Annual Review of Ecology, Evolution, and Systematics,2018,49:409-432
[34]"""" BOND-LAMBERTY B,BAILEY V L,CHEN M,et al. Globally rising soil heterotrophic respiration over recent decades[J]. Nature,2018,560(7716):80-83
[35]"""" HAN C X,YU R H,LU X X,et al. Interactive effects of hydrological conditions on soil respiration in China’s Horqin sandy land: An example of dune-meadow cascade ecosystem[J]. Science of the Total Environment,2019,651:3053-3063
[36]"""" HURSH A,BALLANTYNE A,COOPER L,et al. The sensitivity of soil respiration to soil temperature, moisture, and carbon supply at the global scale[J]. Global Change Biology,2017,23(5):2090-2103
[37]"""" LI J J,HUANG Y,XU F W,et al. Responses of growing-season soil respiration to water and nitrogen addition as affected by grazing intensity[J]. Functional Ecology,2018,32(7):1890-1901
[38]"""" RU J Y,ZHOU Y Q,HUI D F,et al. Shifts of growing-season precipitation peaks decrease soil respiration in a semiarid grassland[J]. Global Change Biology,2018,24(3):1001-1011
[39]"""" LUNDQUIST E J,JACKSON L E,SCOW K M. Wet-dry cycles affect dissolved organic carbon in two California agricultural soils[J]. Soil Biology and Biochemistry,1999,31(7):1031-1038
[40]"""" GONG Y H,ZHAO D M,KE W B,et al. Legacy effects of precipitation amount and frequency on the aboveground plant biomass of a semi-arid grassland[J]. Science of the Total Environment,2020,705:135899
[41]"""" LADAU J,SHI Y,JING X,et al. Existing climate change will lead to pronounced shifts in the diversity of soil prokaryotes[J].mSystems,2018,3(5):e00167-18
[42]"""" SHI Y,ZHANG K P,LI Q,et al. Interannual climate variability and altered precipitation influence the soil microbial community structure in a Tibetan Plateau grassland[J]. Science of the Total Environment,2020,714:136794
[43]"""" TESTERINK C,LAMERS J. How plant roots go with the flow[J]. Nature,2022,612(7940):414-415
[44]"""" CHELLI S,CANULLO R,CAMPETELLA G,et al. The response of sub-Mediterranean grasslands to rainfall variation is influenced by early season precipitation[J]. Applied Vegetation Science,2016,19(4):611-619
[45]"""" LI X Y,ZUO X A,YUE P, et al. Drought of early time in growing season decreases community aboveground biomass, but increases belowground biomass in a desert steppe[J]. BMC Ecology and Evolution,2021,21(1):106
[46]"""" SUTTLE K B,THOMSEN M A,POWER M E. Species interactions reverse grassland responses to changing climate[J]. Science,2007,315(5812):640-642
(责任编辑" 闵芝智)

