蒺藜苜蓿共生固氮突变体esn1的表型鉴定研究


摘要:本研究设置了4个生长条件(正常、低氮2 mmol∙L-1 N+不接种根瘤菌、低氮+接种根瘤菌、5 mmol∙L-1 N +不接种根瘤菌)对一个蒺藜苜蓿(Medicago truncatula)共生固氮突变体esn1进行了生长发育表型鉴定,以期明确该材料的生长发育特征。结果显示,在正常生长条件下,突变体esn1的所有器官,包括根、茎、叶、花、果荚、种子以及花期、分枝数均正常;但在低氮条件下,其接菌的生长速度与未接菌的生长速度几乎一样,这表明该突变体几乎不能固氮。进一步分析发现,该突变体虽然存在严重的固氮缺陷,但其仍然保留非常微弱的(lt;1%)固氮能力。在低氮条件下,突变体esn1根系、叶片、株高等发育与野生型植株的也没有差异。这些结果表明,esn1仅在共生固氮方面存在极其严重的缺陷,而其他的生长发育过程均不受影响。
关键词:蒺藜苜蓿;共生固氮;突变体;表型鉴定;生长发育
中图分类号:S542.9" " " " 文献标识码:A" " " " 文章编号:1007-0435(2025)02-0327-08
Phenotypic Characterization of esn1, a Symbiotic Nitrogen-Fixing Mutant of Medicago truncatula
GAO Ya-qing, SHI Wen-min, ZHANG Yong-kang, SUN Wan-yu, ZhU Long-tao, YIN Xu, XI Jie-jun*
(College of Grassland Agriculture, Northwest Aamp;F University, Yangling, Shaanxi Province 712100, China)
Abstract:To characterize the growth and development of a symbiotic nitrogen-fixing mutant esn1 of Medicago truncatula, in this study we set up 4 different growth conditions: normal nitrogen, low nitrogen with rhizobia inoculation, low nitrogen without rhizobia inoculation, 5 mmol∙L-1 N without rhizobia inoculation. The results showed that under normal nitrogen growth conditions, all organs of the mutant esn1, including roots, stems, leaves, flowers, pods, seeds, flowering period, and number of branches were normal; but under low-nitrogen conditions, the growth rate of the mutant esn1 with rhizobia inoculation was almost identical to that of uninoculated, indicating that it could hardly fix nitrogen. Further analysis found that although the mutant had severe nitrogen fixation defect, it still retained a very weak (lt;1%) nitrogen fixation ability. Under low-nitrogen conditions, the development of the root system, leaves, and plant height of the mutant esn1 was not different from that of the wild-type plant. These results indicate that esn1 only has extremely severe defect in symbiotic nitrogen fixation, while other growth and development processes are not affected.
Key words:Medicago truncatula;Symbiotic nitrogen fixation;Mutants;Phenotypic characterization;Growth and development
表型鉴定是生物科学研究中的惯常研究内容之一。在宏观上,表型鉴定可以通过对不同物种或不同个体的表型特征进行观察和比较,揭示生物在形态、生理和行为等方面的差异,进而加深对生物多样性的理解[1],还可以通过观察和分析生物在不同环境中的表型变化,揭示生物对环境变化的适应策略和适应机制[2]。在微观上,可利用基因敲除、突变体筛选等方法,通过表型变化来推断基因的生物学功能[3];还可通过对农作物、畜禽、野生动植物等的表型特征进行鉴定和评估,可以为其良种选育、品种改良、保护管理等提供科学依据[4]。此外,在医学研究领域,表型鉴定在疾病诊断、药物研发等方面具有重要应用价值,可通过对患者的表型特征进行分析,为疾病的诊断和治疗提供重要信息,促进个性化医疗的发展[5]。因此,表型鉴定通常是各种基础研究和应用研究工作的必要前提。
虽然表型鉴定在生物学研究中具有重要作用,但也面临着一些挑战和困难。表型作为生物体外在表现的总和,包括形态特征、生理特性和行为等多方面内容。因此,表型鉴定通常需要综合考虑不同方面的多种观察和测量,这使其具有较高的复杂性[6]。由于生物表型受环境因素影响较大,因此需要在控制条件下进行表型鉴定,以确保结果的准确性和可重复性[7]。而对于某些表型特征或研究目的,可能存在多种探究方法,而不同的探究方法可能会导致不同的结果。因此,在进行表型鉴定时,需要选择合适的探究方法,并进行标准化处理,以确保结果的可靠性和可比性[8]。此外,在突变体的创制过程中,各种化学、物理或生物诱变通常会造成全基因组的较多位点损伤[9],而多数实验室通常只关注与本实验室研究方向相关的表型,至于多效基因突变体所有的附带表型或其他方面的微弱表型通常因研究困难而被忽略。上述种种原因都可导致表型解析的偏差或不完全,通常会导致对目标基因生物学功能认知的不完全或偏颇。
豆科植物与根瘤菌形成的共生固氮作用,可在常温常压下将空气中的游离氮气(N2)固定成植物可以利用的化合态氮素,是一种对农业和生态环境极其重要的特殊生物性状。在当今化学合成氮肥造成严重污染且成本高昂的背景下,通过基因工程将豆科植物共生固氮的能力转移至农作物中的尝试引起了极大的关注[10]。因此,学界早在2000年左右选定蒺藜苜蓿(Medicago truncatula)作为豆科植物的模式生物,通过甲基磺酸乙酯(Ethyl methane sulfonate, EMS)、快中子以及转座子插入等方式创造了各种来源的突变体库[11-13],以探究豆科植物共生固氮的遗传基础和发育过程。过去20多年通过对豆科植物共生固氮突变体的表型鉴定研究,发现了很多重要的生物过程,如根瘤原基的形成、根瘤菌对植物的侵染、根瘤固氮功能的形成以及根瘤数量的调控等。这些过程在豆科植物共生固氮性状中隶属不同的调控等级和方面,共同协调共生固氮的高效有序进行[11]。本课题组曾经筛选鉴定到一个蒺藜苜蓿快中子突变源的共生固氮效率相关的突变体esn1(early senescent nodule 1)[14]并克隆了其对应的突变基因MtNCR211[11,15]。突变体esn1因其根瘤较野生型的发生早衰而命名,而后的遗传定位发现其目的基因隶属于更早报道的蒺藜苜蓿NCR肽(Nodule Cysteine-Rich Peptides)家族的第211个成员。当前,关于esn1突变体的信息主要集中在固氮相关生物发育过程以及对应基因的分子功能,尚未有其他方面的报道。
在上述背景下,本研究对蒺藜苜蓿共生固氮突变体esn1进行了全面的生长发育鉴定,以评估其目的基因MtNCR211的缺失对各种生物发育过程的影响,同时为该材料用于其他目的的研究提供基础的支撑信息。
1 材料与方法
1.1 植物材料的培养
蒺藜苜蓿A17(M. truncatula ‘Jemalong A17’)和突变体esn1均来自美国诺贝基金会[14]。健康饱满的种子用浓硫酸处理6~8 min后用蒸馏水冲洗干净, 吸胀4~6 h,然后置于培养皿中室温(25℃左右)避光发芽48 h,待胚根长至1 cm左右移栽。对于正常生长条件下的生长评估,将发芽种子种于含草炭土的花盆(上口径17㎝×下口径10 cm×高2 cm),生长期间根据需求浇灌全氮营养液。对于低氮、低氮接菌和 5 mmol∙L-1 KNO3条件的生长生理评估,则将发芽种子种于装有珍珠岩∶河沙(3∶1,v/v)的灭菌基质的32孔育苗穴盘(长54 cm×宽28 cm;穴孔6 cm×2.6 cm×5.3 cm),移栽时每盘浇灌1 L用KNO3调至2 mmol∙L-1 N的低氮ISV营养液(0.125 mmol∙L-1 N,0.125 mmol∙L-1 P, 0.56 mmol∙L-1 K,0.31 mmol∙L-1 Ca, 0.06 mmol∙L-1 Mg,14 μmol∙L-1 Fe)[14]。植物生长一周后,低氮组用ISV营养液浇灌;低氮接菌组用ISV营养液稀释的中华根瘤菌(Sinorhizobium meliloti)悬浮液(OD600=0.05)浇灌接种;5 mmol∙L-1 KNO3组用KNO3将ISV营养液中氮素调至5 mmol∙L-1进行浇灌。智能温室光周期16 h/8 h,昼夜温度为25℃/20℃。
1.2 指标测定
根据试验目的,用相机、尺子及天平对植株、叶片、种子和果荚等器官在设定时间点上进行取样观测,每处理三个重复,每重复8个植株。采用通用方法测量植物鲜重、干重[16],使用Chlorophyll Meter SPAD 502Plus(Konica Minolta Sensing, Inc.)测量叶绿素含量 [17]。
1.3 数据分析
用SPSS 26.0进行单因素方差分析(ANOVA)和显著性检验,用Origin作图。
2 结果与分析
2.1 正常生长条件下esn1的生长发育评估
为了探究esn1生长发育是否正常,本研究在正常生长条件下对其除根瘤以外的所有器官进行了观测,结果如图1所示。在草炭土中生长并浇全营养液的条件下,esn1植株生长正常。其在叶片的大小、色泽、紫色花青素斑点(图1C-D),植株的大小、分枝以及生育时期(图1A-B和E),花的大小、颜色、形态及体毛(图1F-G),果荚的大小和形态(螺旋结构、蒺藜倒刺)(图1H-I),以及种子的颜色、形态、大小及重量(图1J-M)等方面,均与野生型植株A17无显著差别。此外,esn1的根发育与野生型的也没有差异(图1N-O)。这些结果表明,在正常生长条件下,esn1的器官包括根、茎、叶、花、果和种子具有与野生型植株A17一样正常的发育过程和发育时期。
2.2 在低氮、低氮接菌和 5 mmol∙L-1 KNO3条件下对esn1的生长生理评估
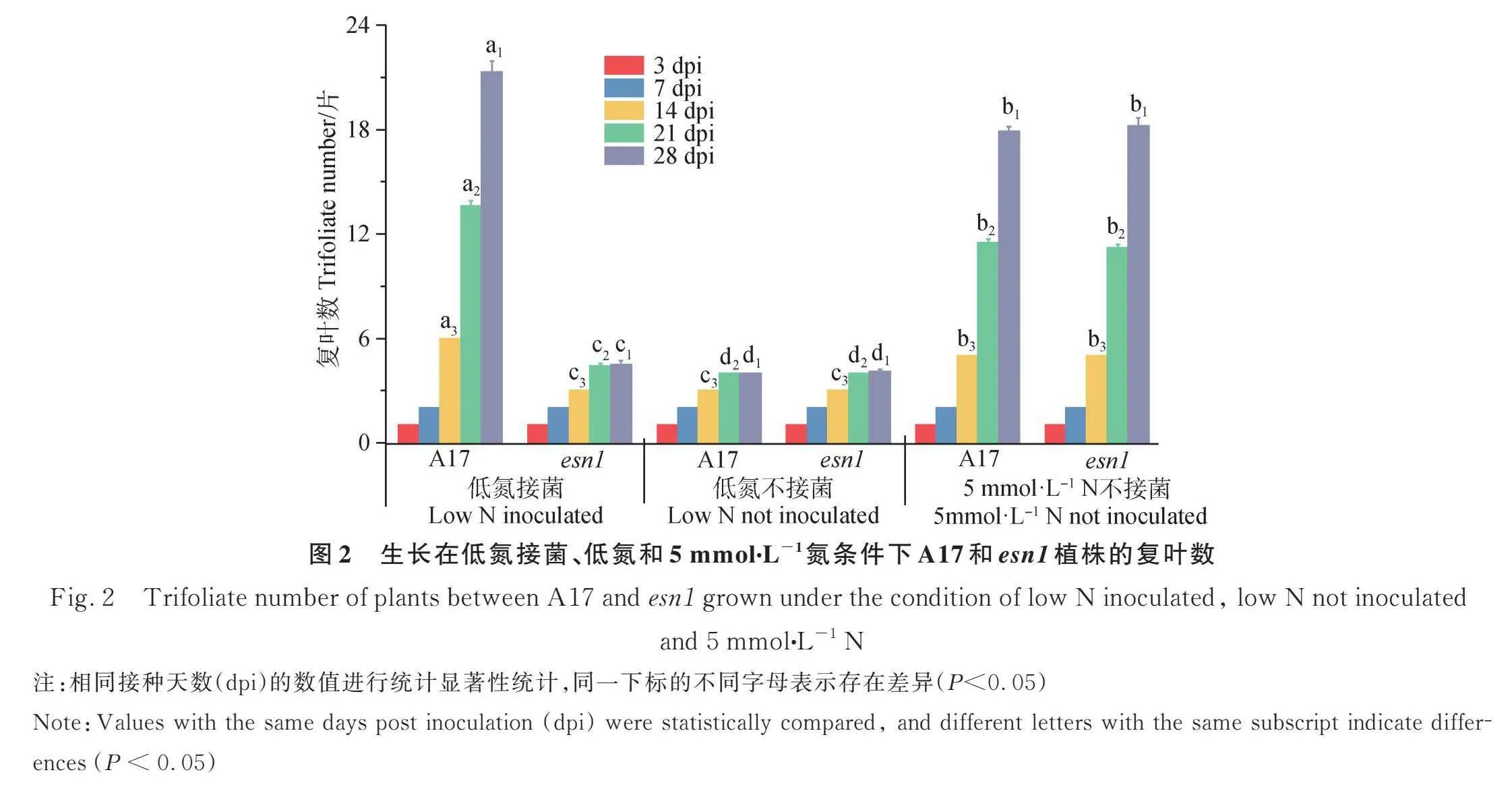
在低氮条件下接种兼容性根瘤菌时,蒺藜苜蓿会与根瘤菌互作进行共生固氮以克服氮素匮乏的生长限制困境。因此,若esn1存在固氮共生突变,那么在低氮接菌条件下,由于其不能固氮或固氮较少或固更多的氮会影响植株的生长发育。在这一假设下,本研究设计了检测esn1共生固氮缺陷程度的试验:将野生型A17和突变体esn1植株种于珍珠岩和砂子中,在低氮、低氮接菌和5 mmol∙L-1 KNO3条件下对复叶数进行了连续统计。
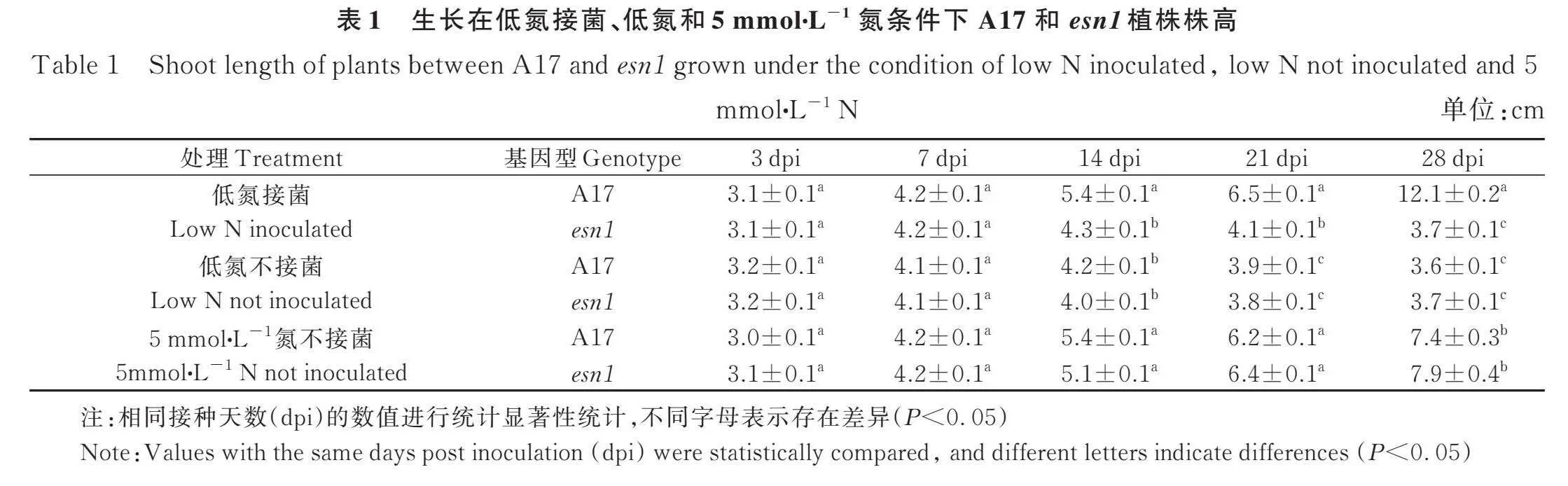
图2显示,在低氮接菌的情况下,esn1和A17在接种后3天(3 days post inoculation, 3dpi)和7 dpi时,植株的复叶数没有差异,分别为1片和2片复叶;但在14 dpi,A17的叶片已经为6片,而esn1的为3片;在21 dpi和28 dpi,A17的复叶差不多为14片和21片,而esn1的复叶却一直没有超过5片。在低氮未接菌的情况下,A17和esn1叶片的发育速度没有差异;此外,在5 mmol∙L-1 N的情况下,A17和esn1叶片的发育速度也没有差异。由于esn1与A17在低氮不接菌和5 mmol∙L-1 N的生长条件下叶片发育速度没有差异,而在低氮接菌时esn1的叶片发育比A17慢且数量较少,这表明esn1的确存在固氮缺陷。有趣的是,在低氮接菌28 dpi时A17的叶片数比其种在5 mmol∙L-1 N条件下的叶片数还要多,表明蒺藜苜蓿具有很强的共生固氮能力。
为了更直观地描述esn1共生固氮缺陷的特性,本研究还对种植于珍珠岩和砂子中野生型和突变体植株在低氮、低氮接菌和5 mmol∙L-1 KNO3条件下进行了地上部分高度的连续测量。结果显示(表1),在低氮接菌的情况下,A17和esn1在3 dpi和7 dpi时,植株的高度没有差异;但在14 dpi以后,A17的增长速度明显高于esn1的;在低氮未接菌的情况下和5 mmol∙L-1 N的生长条件下,esn1突变体和A17野生型植株的生长速度差异都不大。这些结果进一步表明,esn1具有严重的固氮缺陷。在低氮接菌条件下28 dpi时,A17地上部的高度为12.1 cm,而其在浇灌5 mmol∙L-1 N营养液时地上部的高度仅为7.4 cm,表明蒺藜苜蓿共生固氮所提供的氮比每周给植物补充的氮供应量要大的多,进一步表明豆科植物蒺藜苜蓿的共生固氮能力很强。
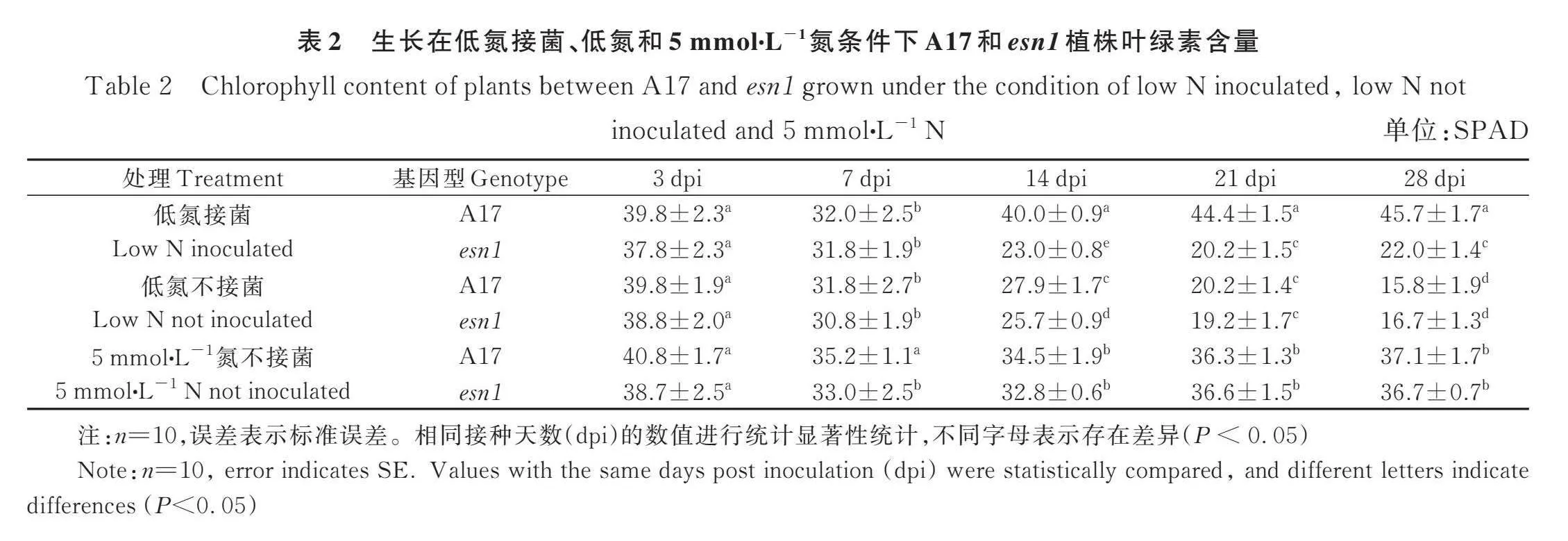
虽然形态指标如复叶数和地上部高度明确地显示了esn1存在共生固氮缺陷,但很难分辨其到底能否固氮。为此我们对野生型A17和突变体esn1植株在低氮、低氮接菌和5 mmol∙L-1 KNO3条件下进行了叶片叶绿素含量的连续测量。结果显示(表 2),在所有处理中,A17和esn1植株从3 dpi到7 dpi时,叶绿素的含量都下降,这因为在3 dpi时植株还比较小,其体内氮素主要来自种子自身的营养储存,因此叶绿素含量较高而且没有差异。在7 dpi时,由于植株的进一步生长,更多新器官如根和叶片的形成需要更多的营养元素,也包括氮素,由于环境氮供应有限,造成叶片叶绿素含量的下降。值得一提的是,在7 dpi时蒺藜苜蓿的根瘤还未发育完全,此时几乎没有或即将形成固氮能力。
在14 dpi以后,低氮接菌处理中的野生型A17叶绿素含量远高于突变体esn1植株的,再次表明esn1存在共生固氮缺陷;而在低氮不接菌和5 mmol∙L-1 KNO3条件下,野生型A17与突变体esn1植株在各时间点上的叶绿素几乎没有差异。由于低氮接菌esn1植株的叶绿素含量与低氮不接菌的A17及esn1的相当,表明低氮接菌的esn1因无法共生固氮而氮素匮乏致使叶绿素含量与低氮不接菌的植株相当。此外,5 mmol∙L-1氮不接菌条件下,野生型A17与突变体esn1植株的叶绿素含量相当且远高于低氮不接菌的植株,表明esn1的氮素吸收利用代谢途径不存在问题。
进一步分析发现,esn1植株在低氮不接菌条件下叶绿素含量自14 dpi开始一直下降,而在低氮接菌时则一直维持着一个稳定的较低值;此外,与7 dpi的叶绿素含量相比,esn1植株在低氮不接菌条件下叶绿素下降了45.8%,而低氮接菌时则下降了30.8%;而且28 dpi时esn1植株的叶绿素含量在低氮接菌时比低氮不接菌条件下的高。这些结果表明,esn1植株可以进行非常微弱的固氮作用。在低氮接菌时野生型A17植株在能固氮即14 dpi以后叶绿素含量远高于其在5 mmol∙L-1氮不接菌条件下的,表明蒺藜苜蓿的共生固氮能力超过外源添加5 mmol∙L-1氮素当量的氮供应。
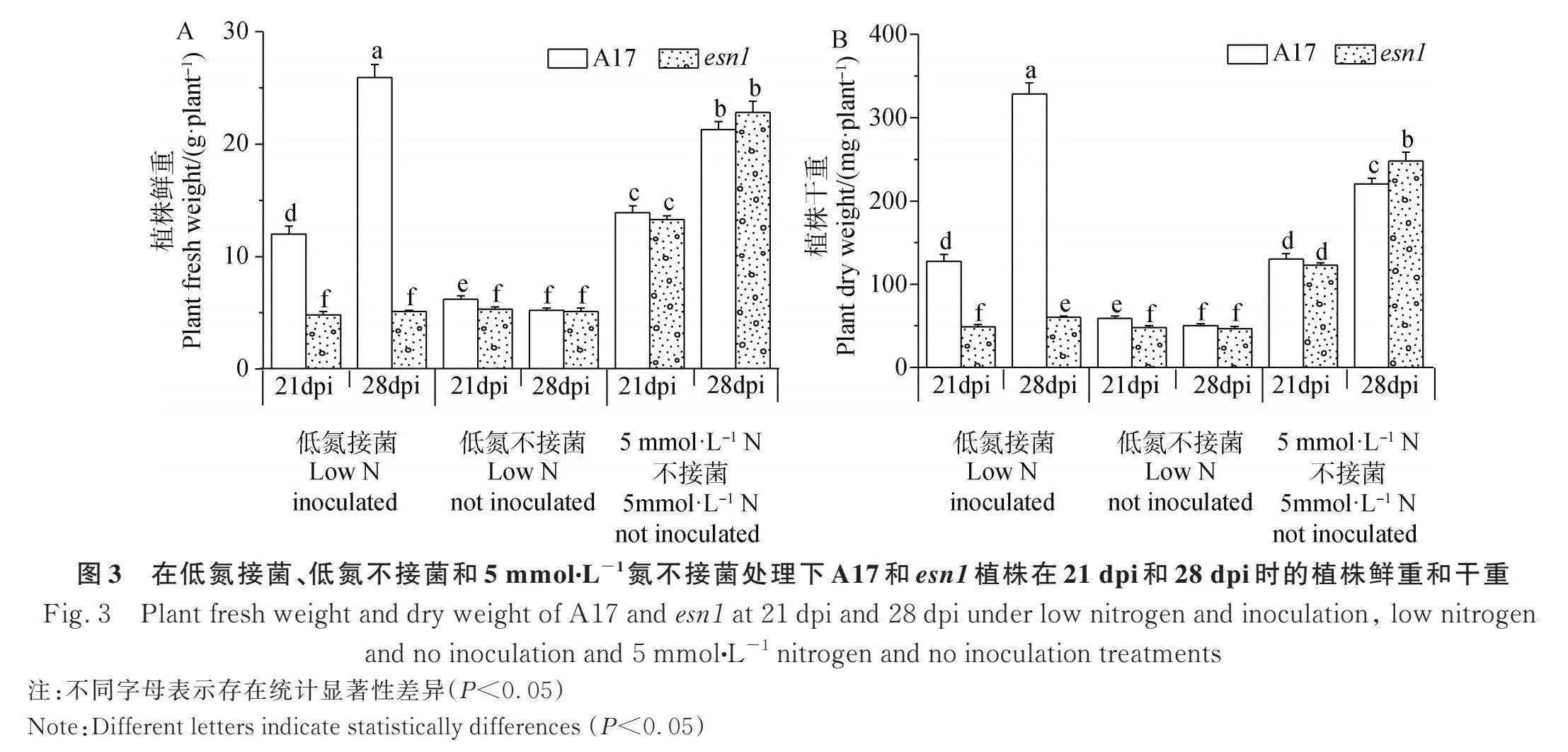
虽然从叶绿素连续测量的试验可推断esn1具有微弱的固氮活性,然而为了确保这种微弱固氮活性不是由于试验误差或试验精度水平所得出的错误结论,进而提出假设:若esn1真的具有微弱的固氮活性,那么随着时间的积累,其在低氮接菌时的生物量应该比低氮未接菌时的高。因此,本研究对低氮、低氮接菌和5 mmol∙L-1 KNO3处理下的21 dpi和28 dpi的植株干鲜重进行了测量。结果显示(图3),在低氮未接菌和5 mmol∙L-1 N的试验条件下,esn1和A17在21 dpi和28 dpi时的干鲜重几乎相当,而低氮接菌处理则大幅度低于野生型的,表明其固氮缺陷严重。但在28 dpi时esn1低氮接菌处理中的干重显著地高于低氮未接菌的,表明esn1的确具有微弱的固氮活性。
2.3 低氮条件下esn1的根系发育观测
Veereshlingam等[18]报道一个蒺藜苜蓿突变体nip不仅共生固氮存在缺陷,而且其侧根在低氮条件下也变得很少。因此,本研究也在低氮条件下对共生固氮缺陷突变体esn1的根系发育进行了观测。结果显示(图4),在低氮条件下esn1的主根长和侧根数在5 d,10 d和15 d与A17的在统计上没有差异。此外,这些结果还表明esn1与nip的共生固氮缺陷不是由同一基因造成的。
3 讨论
表型鉴定的主要目的为通过比较鉴别发现各种处理对客体造成的影响或效果。本研究通过各种处理对之前报道的一个蒺藜苜蓿共生固氮突变体esn1进行了生长发育相关的表型鉴定[14-15],结果显示MtESN1的突变,除了对共生固氮性状有影响外,对其他发育过程或性状如叶片、花、果荚、种子、根的发育以及花期、分枝和氮的吸收和利用等过程均无影响。这些结果表明MtESN1/NCR211仅辖限在共生固氮的过程中发挥关键的作用,不像其他基因如MtSGL1突变后不但使蒺藜苜蓿三出复叶变成单片小叶,而且还造成花的发育异常,并且无法形成种子[19]。研究发现,MtESN1编码一个抗菌肽NCR211[15]。NCR是一类富含半胱氨酸的大小为60~90个氨基酸的类似防御素小肽,家族成员多达600个以上,仅在IRLC豆科植物分枝中存在,主要控制根瘤细胞内类菌体的分化[20-21]。在267种不同的试验条件下利用344种RNA探针对NCR基因表达进行全局分析的结果显示,334个NCR基因,除了5个基因NCR247,NCR077,NCR218,NCR122和NCR247在其他组织或试验条件下有表达外,都不受其他生物或非生物因素的影响,仅在根瘤组织里高水平表达[22]。本研究对根、茎、叶、根瘤、花、幼嫩果荚等组织进行qRT-PCR定量的研究发现, NCR211也仅在根瘤内高度表达,而在其他组织则没有表达(未发表)。在低氮条件下,与nip突变体不同[18],esn1的主根和侧根发育不受影响(图4)。这些证据表明NCR是极端特异的共生固氮相关基因,因此,MtESN1/NCR211的突变仅影响共生固氮,而不会影响其他的性状发育或代谢过程,而这与本研究中的表型鉴定结果相吻合。
为了析因或定性,在科学探究的过程中往往会碰到一些非常边际或观测起来非常困难的问题,因此,常常需要高精准度的试验结果。本研究对蒺藜苜蓿突变体esn1进行表型表征的结果显示,其在低氮接菌的情况下与野生型的发育存在巨大差异,因此很容易判断其存在严重的共生固氮缺陷(图2及表1),但其株高及叶片发育速度又与低氮不接菌的相当,而且研究发现esn1根瘤固氮酶nifH在9 dpi时的表达与野生型A17的没有差异[14] ,因此,很难判定其是否依然存在微弱的固氮能力。而该问题是表征共生固氮突变体特征特性以及分析其生物学功能的核心问题。为了厘清该问题,我们假设其存在微弱的固氮能力并对叶绿素和干鲜重进行了连续的观测,试验结果可相互验证且都显示esn1具有微弱的共生固氮能力(表2和图3)。通过乙炔还原测定固氮酶活性的试验结果显示,14 dpi时esn1固氮酶活力为0.0081,而A17的为1.04(单位:nmol∙L-1 ·plant-1·h-1)[14],前者仅为后者的0.78%。这些结果表明,esn1虽然存在极其严重的固氮缺陷,但依然存在非常微弱的共生固氮能力。此外,本研究的结果还表明,不借助价格高昂的仪器和复杂的试验技术,在精心的试验设计和严格的试验条件下,也可对某些困难问题进行高精准度的定性观测,而且这些定性观测结果有助于对高精尖仪器所测量到的微弱数值的真实性进行判定。
豆科植物因突出的共生固氮能力而备受关注,因其有助于减少化学合成氮肥的施用,从而降低农业生产对化石燃料的依赖,减少温室气体排放和氮污染[23]。此外,共生固氮还在改善土壤结构和质量、提高农产品品质和生物多样性[24]、增强植物对干旱、盐碱和重金属[25-26]等逆境的抗性方面也具有重要的作用。因此,为了解析豆科植物遗传发育基础而创制的共生固氮突变体不但可以应用于共生固氮发育过程和遗传定位研究,也可用于上述研究以全面评估并揭示共生固氮在不同领域中的意义。 在本研究中,共生固氮突变体esn1,因MtESN1/NCR211突变不影响其他发育过程而仅限于共生固氮过程,而且固氮效率丧失99%以上,因此,可成为各种共生固氮相关评估研究的优良材料。
4 结论
蒺藜苜蓿突变体esn1是一个几乎没有固氮活性的共生固氮缺陷突变体,其目的基因MtESN1/NCR211的突变,仅影响共生固氮过程而不影响其他器官的生长及发育。
参考文献
[1] GRANT P R,ROSEMARY GRANT B. Evolution of character displacement in Darwin’s finches[J]. Science,2006,313(5784):224-226
[2] BRADSHAW W E,HOLZAPFEL C M. Evolutionary response to rapid climate change[J]. Science,2006,312(5779):1477-1478
[3] BELLEN H J,TONG C,TSUDA H. 100 years of Drosophila research and its impact on vertebrate neuroscience: a history lesson for the future[J]. Nature Reviews Neuroscience,2010,11(7):514-522
[4] COLLARD B C Y,MACKILL D J. Marker-assisted selection: an approach for precision plant breeding in the twenty-first century[J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2008,363(1491):557-572
[5] KATSANIS N. The continuum of causality in human genetic disorders[J]. Genome Biology,2016,17(1):233
[6] GIBSON G. The synthesis and evolution of a supermodel[J]. Science,2005,307(5717):1890-1891
[7] PIGLIUCCI M. Evolution of phenotypic plasticity: Where are we going now?[J]. Trends in Ecology and Evolution, 2005,20(9):481-486
[8] SHAW R G,GEYER C J,WAGENIUS S,et al. Unifying life-history analyses for inference of fitness and population growth[J]. The American Naturalist, 2008,172(1):E35-E47
[9] 张浩巍,马昕巍,高雅晴,等. 一种新的蒺藜苜蓿遗传杂交方法[J]. 草地学报,2023,31(3):914-922
[10] BEATTY P H,GOOD A G. Plant science.Future prospects for cereals that fix nitrogen[J]. Science,2011,333(6041):416-417
[11] ROY S,LIU W,NANDETY R S,et al. Celebrating 20 years of genetic discoveries in legume nodulation and symbiotic nitrogen fixation[J]. The Plant Cell,2020,32(1):15-41
[12] 陈爱民,连瑞丽,孙杰,等. 豆科模式植物——蒺藜苜蓿[J]. 植物生理学通讯,2006,42(5):997-1003
[13] KANG Y,LI M,SINHAROY S,et al. A snapshot of functional genetic studies in Medicago truncatula[J]. Frontiers in Plant Science,2016,7:1175
[14] XI J J,CHEN Y H,NAKASHIMA J,et al. Medicago truncatula esn1 defines a genetic locus involved in nodule senescence and symbiotic nitrogen fixation[J]. Molecular Plant-Microbe Interactions,2013,26(8):893-902
[15] KIM M,CHEN Y H,XI J J,et al. An antimicrobial peptide essential for bacterial survival in the nitrogen-fixing symbiosis[J]. Proceedings of the National Academy of Sciences of the United States of America,2015,112(49):15238-15243
[16] XI J J,HUANG S Y,LIU W J,et al. Enhancement by sodium on the growth of the xerophyte Zygophyllum xanthoxylum is achieved by maintaining efficient photosynthesis when stomatal aperture is minimized[J]. Environmental and Experimental Botany,2021,191:104624
[17] KANG Y,HAN Y H,TORRES-JEREZ I,et al. System responses to long‐term drought and re‐watering of two contrasting alfalfa varieties[J]. The Plant Journal,2011,68(5):871-889
[18] VEERESHLINGAM H,HAYNES J G,VARMA PENMETSA R,et al. nip, a symbiotic Medicago truncatula mutant that forms root nodules with aberrant infection threads and plant defense-like response[J]. Plant Physiology,2004,136(3):3692-3702
[19] WANG H L,CHEN J H,WEN J Q,et al. Control of compound leaf development by FLORICAULA/LEAFY ortholog SINGLE LEAFLET1 in Medicago truncatula[J]. Plant Physiology, 2008,146(4):1759-1772
[20] MERGAERT P,UCHIUMI T,ALUNNI B,et al. Eukaryotic control on bacterial cell cycle and differentiation in the Rhizobium-legume symbiosis[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(13):5230-5235
[21] VAN DE VELDE W,ZEHIROV G,SZATMARI A,et al. Plant peptides govern terminal differentiation of bacteria in symbiosis[J]. Science, 2010,327(5969): 1122-1126
[22] GUEFRACHI I,NAGYMIHALY M,PISLARIU C I,et al. Extreme specificity of NCR gene expression in Medicago truncatula[J]. BMC Genomics,2014,15(1):712
[23] HERRIDGE D F,PEOPLES M B,BODDEY R M. Global inputs of biological nitrogen fixation in agricultural systems[J]. Plant and Soil,2008,311(1):1-18
[24] KEBEDE E. Contribution, utilization, and improvement of legumes-driven biological nitrogen fixation in agricultural systems[J]. Frontiers in Sustainable Food Systems,2021,5:767998
[25] GOYAL R K,HABTEWOLD J Z. Evaluation of legume-rhizobial symbiotic interactions beyond nitrogen fixation that help the host survival and diversification in hostile environments[J]. Microorganisms,2023,11(6):1454
[26] 熊海琳,毛培春,田小霞,等. 接种根瘤菌对林下红三叶草产量与品质及土壤特性影响[J]. 草地学报,2023,31(11):3561-3568
(责任编辑" 闵芝智)

