基于NPNT/JAK2/STAT3信号通路探讨血府逐瘀汤促冠心病血瘀证模型大鼠心肌修复的作用机制



〔摘要〕 目的 基于肾连蛋白(NPNT)/Janus激酶2(JAK2)/信号转导及转录激活因子3(STAT3)信号通路探讨血府逐瘀汤促冠心病血瘀证模型大鼠心肌修复的作用机制。方法 通过结扎大鼠冠状动脉左前降支建立冠心病血瘀证模型,造模成功后将大鼠随机分为模型组(灌胃等量蒸馏水)、曲美他嗪组[灌胃5.4 mg/(kg·d)曲美他嗪溶液]和低、中、高剂量组[分别灌胃3.51、7.02、14.04 g/(kg·d)血府逐瘀汤药液]。另设正常组(无任何干预措施)、假手术组(冠状动脉左前降支只穿线不结扎),均灌胃等量蒸馏水。每组5只,均连续灌胃给药7 d后处死取材。超声心动图检测大鼠心功能指标;血液流变学检测全血黏度、卡松黏度和红细胞聚集指数含量;HE染色法观察心肌组织形态学变化;ELISA法检测血清血小板衍生生长因子-BB(PDGF-BB)、胰岛素样生长因子-1(IGF-1)和心肌组织血管内皮生长因子(VEGF)、血管内皮细胞生长因子受体-1(VEGFR-1)的表达;Western blot法检测心肌组织JAK2、p-JAK2、STAT3、p-STAT3蛋白的表达;实时荧光定量PCR检测心肌组织NPNT、JAK2、STAT3的mRNA表达。结果 与假手术组比较,模型组大鼠的心电图ST段明显抬高;左室射血分数(LVEF)、左室轴缩短率(LVFS)降低(Plt;0.01),左心室舒张末期内径(LVIDd)、左心室收缩末期内径(LVIDs)升高(Plt;0.01);全血黏度(低、中、高切)、卡松黏度、红细胞聚集指数均升高(Plt;0.01);心肌细胞肿胀、断裂、排列紊乱,出现大量炎性细胞;PDGF-BB、IGF-1、VEGF、VEGFR-1含量均升高(Plt;0.01);p-JAK2、p-STAT3蛋白表达增加(Plt;0.01);JAK2、STAT3、NPNT的mRNA表达水平均升高(Plt;0.01)。与模型组比较,各治疗组的心电图ST段出现不同程度下降;曲美他嗪组、中剂量组和高剂量组LVEF、LVFS升高(Plt;0.01),LVIDd、LVIDs降低(Plt;0.01),低剂量组LVIDd降低(Plt;0.05);曲美他嗪组、中剂量组和高剂量组的全血黏度(低、中、高切)、卡松黏度、红细胞聚集指数均降低(Plt;0.01,Plt;0.05),低剂量组全血黏度(低切)和卡松黏度降低(Plt;0.01,Plt;0.05);各治疗组的心肌细胞形态结构出现不同程度的改善;曲美他嗪组、中剂量组、高剂量组PDGF-BB、IGF-1、VEGF、VEGFR-1含量均升高(Plt;0.01,Plt;0.05),低剂量组IGF-1、VEGF含量升高(Plt;0.01,Plt;0.05);各治疗组p-JAK2、p-STAT3蛋白表达均增加(Plt;0.01,Plt;0.05);曲美他嗪组、中剂量组、高剂量组NPNT、JAK2、STAT3的mRNA表达水平均升高(Plt;0.01)。结论 血府逐瘀汤能显著改善冠心病血瘀证模型大鼠的心肌损伤,其机制可能与调控NPNT/JAK2/STAT3信号通路,促进血管新生有关。
〔关键词〕 冠心病;血瘀证;血府逐瘀汤;NPNT/JAK2/STAT3信号通路;心肌修复
〔中图分类号〕R285.5" " " " "〔文献标志码〕A" " " " " 〔文章编号〕doi:10.3969/j.issn.1674-070X.2025.01.002
Mechanism of action of Xuefu Zhuyu Decoction in promoting myocardial repair in a rat model of coronary heart disease with blood stasis pattern based on the NPNT/JAK2/STAT3 signaling pathway
WANG Mingyun, LIU Yi, YANG Yang, TIAN Peng, LI Jing, KUANG Huifang,
DONG Jing, ZHANG Qiuyan*
Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To explore the mechanism of action of Xuefu Zhuyu Decoction (XFZYD) in promoting myocardial repair in a rat model of coronary heart disease with blood stasis pattern based on the NPNT/Janus kinase 2 (JAK2)/signal transducer and activator of transcription 3 (STAT3) signaling pathway. Methods A rat model of coronary heart disease with blood stasis pattern was established by ligating the left anterior descending branch of the coronary artery. After successful modeling, the rats were randomized into model group (intragastric administration of an equal volume of distilled water), trimetazidine group [intragastric administration of 5.4 mg/(kg·d) trimetazidine solution], and low-, medium-, and high-dose XFZYD groups (intragastric administration of 3.51, 7.02, and 14.04 g/(kg·d) of XFZYD solution, respectively). Additionally, a normal group (no intervention measures) and a sham-operated group (the left anterior descending coronary artery was only threaded but not ligated) were established, and both groups were administered an equal volume of distilled water by gavage. Five rats were in each group, and all were euthanized for tissue collection after seven days of continuous gavage administration. Echocardiography was performed to measure the rat cardiac function indicators; Hemorheological tests were conducted to determine the whole blood viscosity, Casson viscosity, and red blood cell aggregation index; HE staining was used to observe the morphological changes in myocardial tissue; ELISA was employed to measure the expressions of serum platelet-derived growth factor-BB (PDGF-BB), insulin-like growth factor-1 (IGF-1), myocardial tissue vascular endothelial growth factor (VEGF), and vascular endothelial cell growth factor receptor-1 (VEGFR-1); Western blot was used to examine the protein expressions of JAK2, p-JAK2, STAT3, and p-STAT3 in myocardial tissue; real-time fluorescence quantitative PCR was performed to check the mRNA expressions of NPNT, JAK2, and STAT3 in myocardial tissue. Results Compared with the sham-operated group, the model group showed significant ST-segment elevation on electrocardiogram, lower left ventricular ejection fraction (LVEF) and left ventricular fractional shortening (LVFS) (Plt;0.01), higher left ventricular end-diastolic diameter (LVIDd) and left ventricular end-systolic diameter (LVIDs) (Plt;0.01), elevated whole blood viscosity (low, medium, and high shear rates), Casson viscosity, and red blood cell aggregation index all (Plt;0.01), swollen, fractured, and disordered myocardial cells with numerous inflammatory cells, higher levels of PDGF-BB, IGF-1, VEGF, and VEGFR-1 (Plt;0.01), elevated protein expressions of p-JAK2 and p-STAT3 (Plt;0.01), and higher mRNA expression levels of JAK2, STAT3, and NPNT (Plt;0.01). Compared with the control group, the treatment groups showed varying degrees of ST-segment reduction on electrocardiogram. The trimetazidine group, medium-dose XFZYD group, and high-dose XFZYD group showed higher LVEF and LVFS (Plt;0.01), and lower LVIDd and LVIDs (Plt;0.01), while the low-dose XFZYD group showed reduced LVIDd (Plt;0.05). The trimetazidine group, medium-dose XFZYD group, and high-dose XFZYD group showed lower whole blood viscosity (low, medium, and high shear rates) (Plt;0.01, Plt;0.05), while the low-dose XFZYD group showed reduced whole blood viscosity (low shear) and Casson viscosity (Plt;0.01, Plt;0.05). The myocardial cell morphology and structure were improved to varying degrees in all treatment groups. The trimetazidine group, medium-dose XFZYD group, and high-dose XFZYD group showed higher levels of PDGF-BB, IGF-1, VEGF, and VEGFR-1 (Plt;0.01, Plt;0.05), while the low-dose XFZYD group showed higher levels of IGF-1 and VEGF (Plt;0.01, Plt;0.05). All treatment groups showed elevated protein expressions of p-JAK2 and p-STAT3 (Plt;0.01, Plt;0.05). The trimetazidine group, medium-dose XFZYD group, and high-dose XFZYD group showed higher mRNA expression levels of NPNT, JAK2, and STAT3 (Plt;0.01). Conclusion XFZYD can significantly reduce myocardial injury in a rat model of coronary heart disease with blood stasis pattern. Its mechanism may be related to the regulation of the NPNT/JAK2/STAT3 signaling pathway and promotion of angiogenesis.
〔Keywords〕 coronary heart disease; blood stasis pattern; Xuefu Zhuyu Decoction; NPNT/JAK2/STAT3 signaling pathway; myocardial repair
冠状动脉粥样硬化性心脏病,简称冠心病,是由于冠状动脉粥样硬化病变引起的血管管腔狭窄或阻塞,导致心肌缺血、缺氧或坏死,是造成死亡或致残的重要疾病之一[1]。研究显示,血运重建是治疗冠心病的主要手段,冠状动脉旁路移植术和经皮冠状动脉介入作为血运重建的主要方式,可明显改善患者症状和预后[2]。然而,经冠状动脉旁路移植术治疗后可能出现进行性动脉粥样硬化性闭塞[3];经皮冠状动脉介入治疗一年后发生再狭窄的可能性极大[4],严重影响患者的预后。因此,如何恢复冠心病患者的血液供应,促进心肌修复,从而提高患者的生存率,仍然是当今的难题。
血瘀证是冠心病的关键证型,祛瘀生新是中医治疗冠心病的根本大法。血府逐瘀汤是活血化瘀的经典名方,也是体现祛瘀生新法的代表方剂,临床广泛用于冠心病的治疗,疗效确切,大量临床研究证实该方具有较好的保护冠心病心肌缺血的作用[5-9]。课题组前期研究表明,该方能够促进缺血心肌血管新生[10-11]、延缓内皮组细胞衰老[12-14]等,有效保护心肌缺血损伤。课题组虽已开展了血府逐瘀汤促缺血心肌血管新生的部分研究,但其作用机制尚未完全明确。肾连蛋白(nephronectin, NPNT)是一种细胞外基质蛋白,属于表皮生长因子样超家族[15],也是旁分泌血管生成因子,参与血管新生过程[16]。Janus激酶2(Janus
kinase 2, JAK2)/信号转导及转录激活因子3(signal transducer and activator of transcription 3, STAT3)通路在细胞生长、发育和增殖中起着重要的作用,参与多种生物学过程[17]。血管内皮生长因子(vascular endothelial growth factor, VEGF)是JAK2/STAT3途径的下游效应因子,与JAK2/STAT3信号通路结合后可激活一系列病理生理反应。
因此,本研究以NPNT/JAK2/STAT3信号通路介导的血管新生为切入点,通过结扎大鼠冠脉构建冠心病血瘀证模型,探讨血府逐瘀汤通过调控NPNT/JAK2/STAT3信号通路促进冠心病血瘀证模型大鼠心肌修复的作用机制。
1 材料和方法
1.1" 实验动物
清洁级雄性SD大鼠60只,体质量(240±20) g,由湖南斯莱克景达实验动物有限公司提供,动物合格证号:430727231101449155,许可证号:SYXK(湘)2019-0009,伦理编号:LL2023022202。饲养于湖南中医药大学实验动物中心SPF级屏障系统,相对温度20~25 ℃,相对湿度55%~60%,自由摄食饮水。
1.2" 实验药物与主要试剂
血府逐瘀汤:当归三钱(9 g),生地黄三钱(9 g),桃仁四钱(12 g),红花三钱(9 g),枳壳二钱(6 g),赤芍二钱(6 g),柴胡一钱(3 g),甘草二钱(6 g),桔梗一钱半(4.5 g),川芎一钱半(4.5 g),牛膝三钱(9 g)。饮片购自湖南中医药大学第一附属医院。用10倍量蒸馏水将血府逐瘀汤饮片浸泡30 min,煎煮1 h,滤出药液,再加8倍量蒸馏水煎煮1 h,滤出药液,混合两次药液,制备为含生药量0.702 g/mL的溶液。盐酸曲美他嗪缓释片(益爽美)[齐鲁制药有限公司,批号:14202871991,规格:35 mg×14片,批准文号:国药准字H20193055]。
大鼠血小板衍生生长因子-BB(platelet-derived growth factor-BB, PDGF-BB)、胰岛素样生长因子-1(insulin-like growth factor 1, IGF-1)、VEGF、血管内皮细胞生长因子受体-1(vascular endothelial growth factor receptor-1, VEGFR-1)ELISA检测试剂盒(上海酶联生物科技有限公司,批号:ml003279、ml059459、ml064294、ml002934);JAK2、p-JAK2抗体(长沙艾碧维生物科技有限公司,批号:AWA10178、AWA41311);STAT3抗体(武汉三鹰生物技术有限公司,批号:10253-2-AP);p-STAT3抗体(艾比玛特医药科技有限公司,批号:T56566)。
1.3" 主要仪器
小动物呼吸机(深圳市瑞沃德生命科技有限公司,型号:RWD407);数字心电图机(广州市三锐电子科技有限公司,型号:VECG-2303B);小动物彩色多普勒超声成像系统(苏州市飞依诺科技有限公司,型号:D650 LAB);全自动血液流变测试仪(北京赛科希德科技股份有限公司,型号:SA-7000);生物组织包埋机(浙江省金华市科迪仪器设备有限公司,型号:KD-BM Ⅱ);石蜡切片机(赛默飞世尔科技公司,型号:HM 325);台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司,型号:H1650R);全自动酶标洗板机、多功能酶标分析仪(深圳市汇松科技发展有限公司,型号:PW-812、MB-530);电热恒温培养箱(北京市永光明医疗仪器有限公司,型号:DHP-500);电泳仪电源(北京龙方科技有限公司,型号:LF-600S);化学发光成像系统(杭州申花科技有限公司,型号:SH-523);荧光定量PCR仪(瑞士Roche公司,型号:LightCycler 480Ⅱ)。
1.4" 大鼠冠心病血瘀证模型的制备
SD大鼠适应性喂养7 d。参考徐叔云等编著的《药理实验方法学》(第2版)[18]中提出的心脏与冠状血管实验法。将大鼠腹腔注射1%戊巴比妥钠,麻醉后固定大鼠,颈部和左侧胸部备皮后行气管插管术,连接小动物呼吸机,呼吸比设置为2∶1,呼吸频率为75次/min,潮气量定为30 mL,连接数字心电图机观察大鼠心电图变化。左侧胸部消毒,沿左侧第4~5肋间切开,切口长度约为3 cm,对周围组织进行钝性分离,打开胸腔,暴露心脏。用眼科镊将心包膜前部撕开,随后用6-0型号带线缝合针结扎左心耳下方约2 mm处的左前降支冠状动脉。以左室前壁向外膨胀发白和心电图ST段抬高为冠心病模型结扎成功的标志,以后续血液流变学和心功能检测作为评价血瘀证模型成功的指标。将心脏归于胸腔原位后迅速关闭胸腔,并逐层缝合伤口,待大鼠恢复自主呼吸后撤离呼吸机插管,缝合颈部皮肤。术后采取肌内注射青霉素8万U/只,连续3 d预防感染。
1.5" 动物分组与给药
在冠心病血瘀证大鼠模型造模成功24 h后,将其随机分为模型组、曲美他嗪组及低、中、高剂量组。另设正常组(不施加任何干预)、假手术组(冠状动脉左前降支只穿线不结扎)。正常组、假手术组、模型组均灌胃20 mL/(kg·d)蒸馏水,曲美他嗪组灌胃5.4 mg/(kg·d)曲美他嗪溶液,低、中、高剂量组分别灌胃3.51、7.02、14.04 g/(kg·d)血府逐瘀汤药液。造模成功后第2天开始灌胃,1次/d,连续灌胃7 d,并于第7天灌胃2 h后处死大鼠并取材。
1.6" 检测指标
1.6.1" 大鼠一般症状观察" 每天于8:00测量大鼠的体质量,并在安静环境下观察各组大鼠的精神状态、活动度、毛发、爪甲、舌色、口唇等一般情况,详细记录。
1.6.2" 心电图检测" 各组大鼠取仰卧位固定,进行心电图检查,观察ST段的变化。
1.6.3" 超声心动图检测大鼠心功能变化情况" 采用小动物彩色多普勒超声成像系统,将探头固定在大鼠左心室长轴切面,测定各组大鼠的左室射血分数(left ventricular ejection fractions, LVEF)、左室轴缩短率(left ventricular fractional shortening, LVFS)、左心室舒张末期内径(left ventricular end-diastolic dimension LVIDd)、左心室收缩末期内径(left ventricular end-systolic dimension, LVIDs)。每个指标均连续测量3个心动周期,再取平均值。
1.6.4" 血液流变学检测" 大鼠腹主动脉采血3~4 mL,储存于肝素钠抗凝管中,充分摇匀,避免凝血,置于全自动血液流变测试仪中检测全血黏度[低(1 s)、中(50 s)、高(200 s)切]、卡松黏度、红细胞聚集指数。
1.6.5" HE染色观察大鼠心肌组织形态学变化" 取完整心脏组织放置于4%多聚甲醛溶液中固定,使用梯度乙醇脱水后,石蜡包埋切片,苏木素染料进行核染,伊红染液使细胞质着色,封片后在光学显微镜下观察心肌组织形态结构并拍照。
1.6.6" ELISA法检测大鼠血清中PDGF-BB、IGF-1的含量" 各组大鼠腹主动脉取血3~4 mL,静置后在台式高速冷冻离心机中以3 000 r/min离心15 min(离心半径7 cm),取上清液置于-80 ℃冰箱保存。按照PDGF-BB检测试剂盒、IGF-1检测试剂盒的操作要求进行实验操作与结果分析。
1.6.7" ELISA法检测大鼠心肌中VEGF、VEGFR-1的含量" 各组大鼠取20 mg心肌组织,研磨后加入PBS制成匀浆,于2~8 ℃台式高速冷冻离心机以5 000 r/min离心5 min(离心半径7 cm)取上清液,按照VEGF检测试剂盒、VEGFR-1检测试剂盒的操作要求进行实验操作与结果分析。
1.6.8" Western blot法检测大鼠心肌组织中JAK2、p-JAK2、STAT3、p-STAT3的蛋白表达" 于冰上将心肌组织剪碎后按比例加入RIPA裂解液、蛋白酶抑制剂和磷酸酶抑制剂,匀浆机充分匀浆后冰上静置20 min,4 ℃下12 000 r/min,离心5 min(离心半径7 cm)后取上清液。BCA试剂盒检测蛋白总浓度后制备蛋白样品。取各组适量样品经SDS-PAGE电泳,湿转法转膜,5%脱脂牛奶封闭。将膜置入一抗(β-actin稀释比例为1∶2 000,JAK2和p-JAK2稀释比例为1∶1 000,STAT3和p-STAT3稀释比例为1∶4 000),于4 ℃孵育过夜。TBST清洗3次后加二抗(稀释比例为1∶10 000),室温孵育2 h。TBST漂洗3次,加入ECL化学发光液显色。用ImageJ软件分析灰度值。
1.6.9" 实时荧光定量PCR法检测大鼠心肌组织中NPNT、JAK2、STAT3的mRNA表达" 按照RNA试剂盒要求提取总RNA,然后根据反转录试剂盒说明书将mRNA反转录成cDNA。将cDNA作为模板,β-actin作为内参再配制20 μL反应体系(2 μL cDNA、0.4 μL上游引物、0.4 μL下游引物、7.2 μL无酶水、10 μL荧光DNA结合染料),进行实时荧光定量反应。采用2-ΔΔCt法检测NPNT、JAK2、STAT3的相对表达量,每个样本重复测量3次。引物序列见表1。
1.7" 统计学方法
采用SPSS 25.0软件进行统计学分析,计量资料采用“x±s”表示。组间比较若满足正态性与方差齐性,采用单因素方差分析,两两比较采用LSD法;若不满足方差齐性,采用Dunnett's T3法;若不符合正态性,采用Kruskal-Wallis H检验。Plt;0.05表示差异有统计学意义。
2 结果
2.1" 各组大鼠一般症状
造模过程中大鼠死亡25只,存活35只,最终确定每组纳入5只大鼠。正常组、假手术组大鼠正常摄食饮水,精神状态良好,活动度强,体质量增长较快,毛发顺滑带有光泽感,爪甲、唇舌红润。模型组大鼠饮食量减少,精神状态差,接触时应激性强,体质量增加较慢,毛发干枯无光泽,爪甲紫暗,鼻尖偶有出血,舌面有瘀点,口唇发紫。低剂量组大鼠精神状态不佳,活动度差,反应迟钝,毛发干涩灰暗,爪甲、舌面色深。与模型组比较,曲美他嗪组、中剂量组、高剂量组大鼠精神状态有所改善,活动度增加,体质量增长较快,毛色渐有光泽感,爪甲稍有血色,口唇、舌质稍红润。
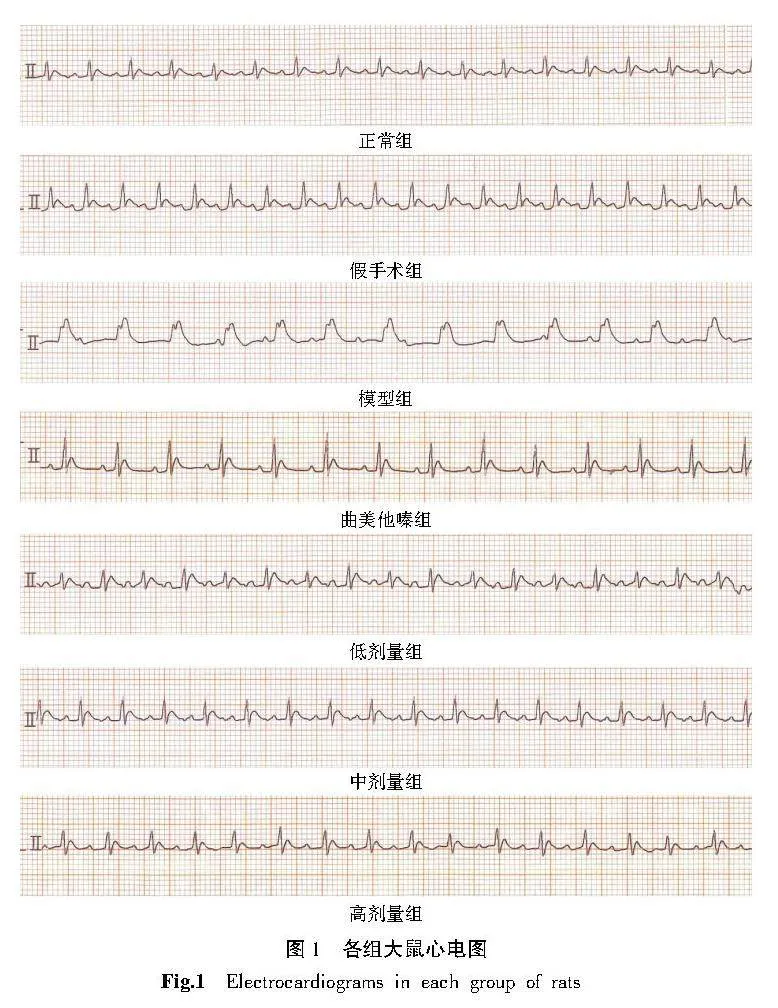
2.2" 各组大鼠心电图比较
正常组和假手术组心电图波形相对规整。与假手术组比较,模型组大鼠的心电图Ⅱ导联可见ST段明显抬高,初步提示大鼠冠心病模型制备成功。与模型组比较,曲美他嗪组、低剂量组、中剂量组和高剂量组的心电图Ⅱ导联可见ST段不同程度降低。详见图1。
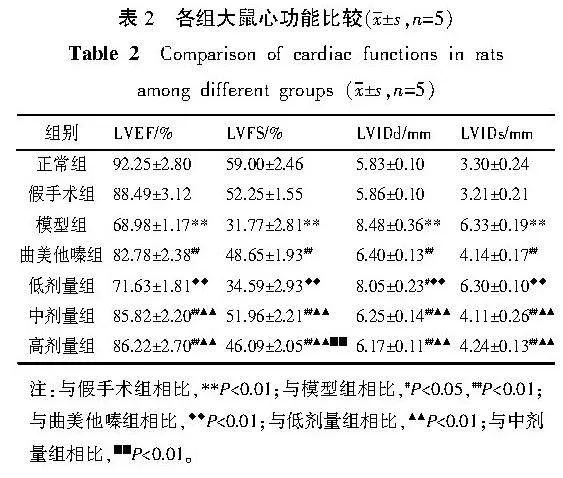
2.3" 各组大鼠心功能比较
与假手术组比较,模型组大鼠的LVEF、LVFS降低(Plt;0.01),LVIDd、LVIDs升高(Plt;0.01)。与模型组比较,曲美他嗪组、中剂量组、高剂量组LVEF、LVFS升高(Plt;0.01),LVIDd、LVIDs降低(Plt;0.01);低剂量组LVIDd降低(Plt;0.05)。与曲美他嗪组比较,低剂量组LVEF、LVFS降低(Plt;0.01),LVIDd、LVIDs升高(Plt;0.01)。与低剂量组比较,中剂量组和高剂量组的LVEF、LVFS升高(Plt;0.01),LVIDd、LVIDs降低(Plt;0.01)。与中剂量组比较,高剂量组LVFS降低(Plt;0.01)。详见表2。
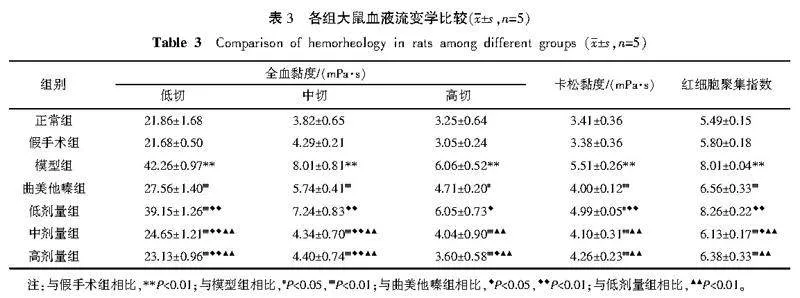
2.4" 各组大鼠血液流变学比较
与假手术组比较,模型组的全血黏度(低、中、高切)、卡松黏度、红细胞聚集指数均升高(Plt;0.01)。与模型组比较,曲美他嗪组、中剂量组和高剂量组的全血黏度(低、中、高切)、卡松黏度、红细胞聚集指数均降低(Plt;0.01,Plt;0.05);低剂量组全血黏度(低切)和卡松黏度降低(Plt;0.01,Plt;0.05)。与曲美他嗪组比较,低剂量组全血黏度(低、中、高切)、卡松黏度、红细胞聚集指数均升高(Plt;0.01,Plt;0.05);中剂量组全血黏度(低、中切)和红细胞聚集指数降低(Plt;0.01,Plt;0.05);高剂量组全血黏度(低、中、高切)降低(Plt;0.01,Plt;0.05)。与低剂量组比较,中剂量组和高剂量组全血黏度(低、中、高切)、卡松黏度、红细胞聚集指数均降低(Plt;0.01)。详见表3。
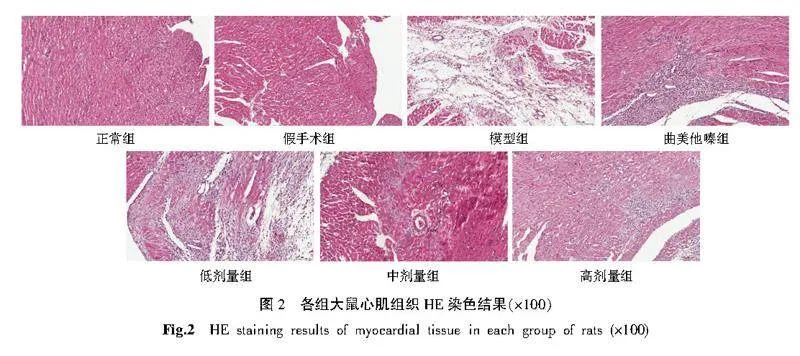
2.5" 各组大鼠心肌组织形态学观察
HE染色结果显示,正常组和假手术组大鼠心肌细胞排列整齐,细胞核呈椭圆形,可见横纹,无炎性细胞浸润。模型组大鼠心肌组织明显受损,心肌细胞肿胀、断裂、排列紊乱,炎性细胞浸润明显可见。曲美他嗪组细胞间质分布较均匀,心肌细胞排列相对规整,炎性细胞浸润减少。低剂量组可见心肌细胞排列较为紊乱疏松,横纹较模糊,仍有大量炎性细胞浸润。中剂量组心肌细胞变性程度减轻,心肌细胞排列较规则,心肌间隙减小,可见少量炎性细胞浸润。高剂量组心肌细胞变性程度减轻,心肌细胞排列相对规整,细胞间质间可见少量炎性细胞浸润。详见图2。
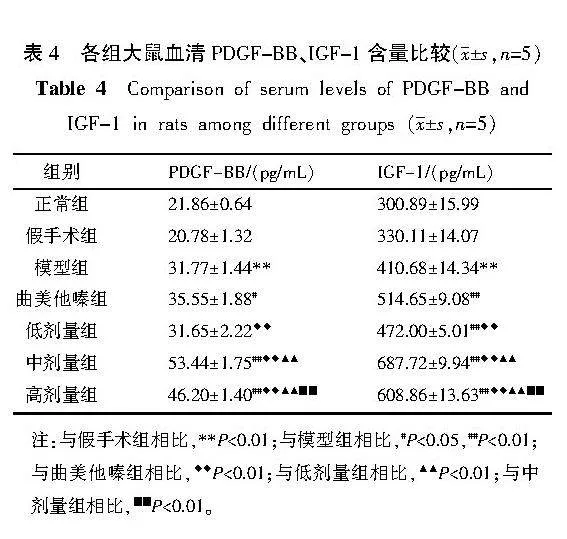
2.6" 各组大鼠血清PDGF-BB、IGF-1含量比较
与假手术组比较,模型组PDGF-BB、IGF-1含量升高(Plt;0.01)。与模型组比较,曲美他嗪组、中剂量组、高剂量组PDGF-BB、IGF-1含量升高(Plt;0.01,Plt;0.05);低剂量组IGF-1含量升高(Plt;0.01)。与曲美他嗪组比较,低剂量组PDGF-BB、IGF-1含量降低(Plt;0.01);中剂量组和高剂量组PDGF-BB、IGF-1含量升高(Plt;0.01)。与低剂量组比较,中剂量组和高剂量组PDGF-BB、IGF-1含量升高(Plt;0.01)。与中剂量组比较,高剂量组PDGF-BB、IGF-1含量降低(Plt;0.01)。详见表4。
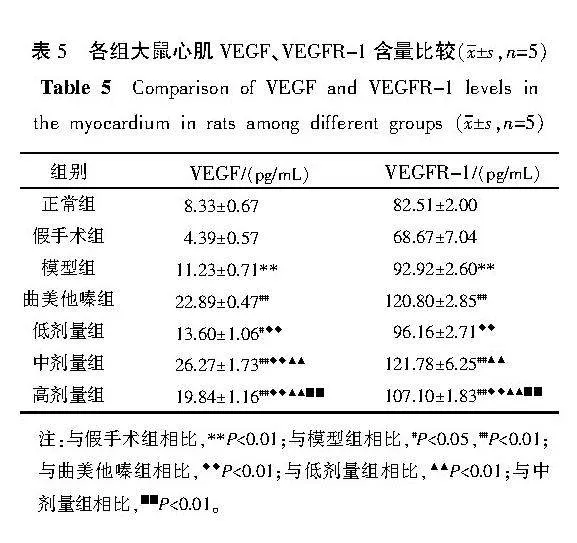
2.7" 各组大鼠心肌VEGF、VEGFR-1含量比较
与假手术组比较,模型组VEGF、VEGFR-1含量升高(Plt;0.01)。与模型组比较,曲美他嗪组、中剂量组、高剂量组VEGF、VEGFR-1含量升高(Plt;0.01);低剂量组VEGF含量升高(Plt;0.05)。与曲美他嗪组比较,低剂量组VEGF、VEGFR-1含量降低(Plt;0.01);中剂量组VEGF含量升高(Plt;0.01);高剂量组VEGF、VEGFR-1含量降低(Plt;0.01)。与中剂量组比较,高剂量组VEGF、VEGFR-1含量降低(Plt;0.01)。详见表5。
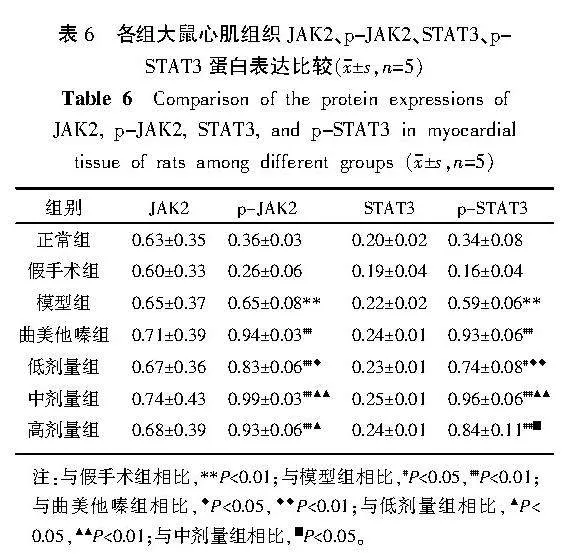
2.8" 各组大鼠心肌组织JAK2、p-JAK2、STAT3、p-STAT3蛋白表达比较
各组间JAK2和STAT3的蛋白表达比较,差异均无统计学意义(Pgt;0.05)。与假手术组比较,模型组p-JAK2、p-STAT3蛋白表达增加(Plt;0.01)。与模型组比较,曲美他嗪组、低剂量组、中剂量组和高剂量组p-JAK2、p-STAT3蛋白表达增加(Plt;0.01,Plt;0.05)。与曲美他嗪组比较,低剂量组p-JAK2、p-STAT3的蛋白表达减少(Plt;0.01,Plt;0.05)。与低剂量组比较,中剂量组p-JAK2、p-STAT3蛋白表达增加(Plt;0.01);高剂量组p-JAK2蛋白表达增加(Plt;0.05)。与中剂量组比较,高剂量组p-STAT3蛋白表达减少(Plt;0.05)。详见图3、表6。
2.9" 各组大鼠心肌组织NPNT、JAK2、STAT3的mRNA表达水平比较
与假手术组比较,模型组NPNT、JAK2、STAT3的mRNA表达水平均升高(Plt;0.01)。与模型组比较,曲美他嗪组、中剂量组、高剂量组NPNT、JAK2、STAT3的mRNA表达水平均升高(Plt;0.01)。与曲美他嗪组比较,低剂量组NPNT、JAK2、STAT3的mRNA表达水平均降低(Plt;0.01);中剂量组NPNT、JAK2的mRNA表达水平均升高(Plt;0.01,Plt;0.05)。与低剂量组比较,中剂量组、高剂量组NPNT、JAK2、STAT3的mRNA表达水平均升高(Plt;0.01)。与中剂量组比较,高剂量组NPNT、JAK2、STAT3的mRNA表达水平均降低(Plt;0.01)。详见表7。
3 讨论
冠心病是心血管疾病中导致死亡或病残的最主要疾病之一,我国冠心病中医证型的流行病学研究显示,心血瘀阻证是出现频率最高的证型[19]。中医学认为,血行瘀滞,心脉痹阻,经络不通是该证型的病机[20],因此强调用活血化瘀法以助行血消瘀滞,达到祛瘀生新之效。血府逐瘀汤是临床治疗冠心病的常用活血化瘀类代表方,该方在桃红四物汤和四逆散的基础上化裁,佐以桔梗和牛膝,具有祛瘀、活血、行气之功。现代药理学研究证实[21],血府逐瘀汤能改善血液凝固性、血液流变性和毛细血管通透性,促进微循环,抑制血小板功能,防止血栓形成,保护血管内皮细胞,减轻血管内皮细胞损伤,抑制心肌细胞坏死及凋亡,促进缺血心肌血管新生[21]。本研究通过结扎大鼠冠状动脉左前降支,制备冠心病血瘀证模型,采用活血化瘀经典方血府逐瘀汤作为干预药物,通过观察大鼠的心电图、心功能变化、血液流变学、心肌组织形态学、血清PDGF-BB和IGF-1的含量、心肌VEGF和VEGFR-1的含量以及NPNT/JAK2/STAT3信号通路相关因子的蛋白表达,多方面验证血府逐瘀汤对心肌修复的作用。
本研究结果发现,经血府逐瘀汤中剂量和高剂量干预后,大鼠心电图ST段抬高幅度下降,LVEF、LVFS显著升高,LVIDd、LVIDs显著降低,大鼠心功能受损得到改善;代表血瘀证客观评价指标[22-23]的全血黏度(低、中、高切)、卡松黏度、红细胞聚集指数均显著降低,提示血府逐瘀汤可有效改善血瘀证血液“黏、稠、凝、聚”的特征[24],使血行通畅,减轻瘀阻。有学者发现,通过促进血管新生可以增加缺血、缺氧心肌细胞的血氧供应,提高细胞外基质蛋白的生成,从而有助于心肌的修复,减少心肌坏死的可能性[25]。PDGF-BB能够有效促进缺血心肌区域的血管新生;IGF-1分布于心血管系统,参与细胞生长发育,促进心肌纤维生长[26]。VEGF和VEGF受体是血管生成的中间产物,常在心血管疾病相关的血管生成调控中呈现出高表达状态[27]。本研究发现,血府逐瘀汤中剂量和高剂量均能提高PDGF-BB、IGF-1、VEGF、VEGFR-1的表达,表明血府逐瘀汤可能通过促进心肌缺血区域血管生成相关因子的表达,从而促进血管新生,修复受损心肌。NPNT在心脏发育早期起到至关重要的作用,作为表皮生长因子受体(epider⁃mal growth factor receptor, EGFR)的配体之一,可通过自身表皮生长因子重复序列与EGFR结合后激活下游的JAK2/STAT3关键信号蛋白,并与JAK2/STAT3信号通路结合,激活一系列病理生理反应,促进内皮细胞的血管生成[17]。JAK2/STAT3信号通路是一条由细胞因子刺激的信号转导通路,在细胞的增殖、分化、凋亡以及免疫调节中发挥重要作用,其中,JAK2在造血和免疫系统调节中发挥关键作用,对红细胞生成及免疫细胞的活化具有重要作用[28];STAT3是一种重要的转录因子,活化后能诱导多种与细胞分化、凋亡及血管生成等生物学行为相关的下游靶基因的表达,而阻断STAT3的活化,可抑制内皮细胞的迁移和微血管的形成[29]。本研究结果显示,血府逐瘀汤可上调NPNT、JAK2、STAT3的mRNA表达水平并促进p-JAK2、p-STAT3的蛋白表达,提示血府逐瘀汤可能通过激活NPNT/JAK2/STAT3信号通路促进下游VEGF的表达,从而调控血管新生,修复心肌缺血损伤。
本研究以血府逐瘀汤为被试因素,综合运用生物化学、组织病理学、ELISA法、实时荧光定量PCR法、Western blot法等现代技术,观察血府逐瘀汤对冠心病血瘀证模型大鼠宏观指标与微观指标的影响,阐明血府逐瘀汤通过调控血管新生修复心肌缺血损伤的重要作用。但本研究采用7 d观察期,用时较短,后续研究可以适当延长治疗期,并增加NPNT的受体EGFR和JAK2/STAT3通路抑制剂等相关蛋白的检测,以进一步阐明血府逐瘀汤促进冠心病血瘀证模型大鼠的心肌修复与NPNT/JAK2/STAT3信号通路的相关性。
参考文献
[1] 国家卫生计生委合理用药专家委员会, 中国药师协会. 冠心病合理用药指南(第2版)[J]. 中国医学前沿杂志(电子版), 2018, 10(6): 1-130.
[2] 马涵萍. 心脏团队对复杂冠心病血运重建决策的质量评价与优化研究[D]. 北京: 北京协和医学院, 2023.
[3] HAYWARD P A, ZHU Y Y, NGUYEN T T, et al. Should all moderate coronary lesions be grafted during primary coronary bypass surgery? An analysis of progression of native vessel disease during a randomized trial of conduits[J]. The Journal of Thoracic and Cardiovascular Surgery, 2013, 145(1): 140-149.
[4] RAHEL B M, SUTTORP M J, LAARMAN G J, et al. Primary stenting of occluded native coronary arteries: Final results of the Primary Stenting of Occluded Native Coronary Arteries (PRISON) study[J]. American Heart Journal, 2004, 147(5): e22.
[5] 何" 莉, 聂" 娟, 张秋雁. 血府逐瘀汤抗心肌缺血的研究进展[J]. 湖南中医杂志, 2019, 35(3): 144-147.
[6] 许晓梅. 血府逐瘀汤治疗冠心病心肌缺血患者的临床观察[J]. 中国中医药现代远程教育, 2017, 15(16): 98-100.
[7] 黄雪君, 谭志韵, 曾晓会, 等. 血府逐瘀汤对急性心肌缺血大鼠心肌保护作用的实验研究[J]. 临床医学工程, 2012, 19(4): 526-527.
[8] 张秋雁, 王权礼, 苏剑峰, 等. 血府逐瘀汤促急性心肌缺血大鼠心肌血管新生及对血管内皮细胞生长因子的影响[J]. 中国中医药信息杂志, 2011, 18(2): 53-54.
[9] 苏剑峰, 张秋雁, 王权礼, 等. 血府逐瘀汤对心肌缺血大鼠心肌梗死面积及缺血心肌血管新生影响的研究[J]. 中医研究, 2011, 24(1): 15-17.
[10] 杨" 漾, 谢雪姣, 邹蔓姝, 等. 血府逐瘀汤对心肌缺血大鼠血清VEGF、VEGFR-1、VWF、CD105表达影响的动态观察[J]. 时珍国医国药, 2021, 32(4): 769-772.
[11] 李" 蕾, 何" 莉, 苏" 畅, 等. 血府逐瘀汤诱导内皮祖细胞对心肌缺血模型大鼠缺血区血管新生的影响[J]. 中国中医药信息杂志, 2021, 28(2): 69-75.
[12] 杨" 漾, 苏" 畅, 邹蔓姝, 等. 血府逐瘀汤对心肌缺血大鼠外周血内皮祖细胞衰老的作用机制研究[J]. 中国临床药理学杂志, 2021, 37(14): 1832-1835, 1839.
[13] 杨" 漾, 苏" 畅, 梁" 昊, 等. 基于P53-SIRT1-miR-34a信号通路调控内皮祖细胞探讨血府逐瘀汤对心肌缺血模型大鼠的作用机制[J]. 时珍国医国药, 2022, 33(3): 527-530.
[14] 刘" 芸, 郑" 炎, 谢" 辉, 等. 血府逐瘀汤延缓大鼠骨髓源内皮祖细胞衰老的机制研究[J]. 中国临床药理学杂志, 2018, 34(23): 2723-2726.
[15] 钱国清, 杨乃彬, 石洁君. 肾连蛋白的研究进展[J]. 生理学报, 2019, 71(5): 799-805.
[16] ZHANG Y P, WANG D, ZHAO Z, et al. Nephronectin promotes cardiac repair post myocardial infarction via activating EGFR/JAK2/STAT3 pathway[J]. International Journal of Medical Sciences, 2022, 19(5): 878-892.
[17] GUO B, YU Y F, WANG M, et al. Targeting the JAK2/STAT3 signaling pathway with natural plants and phytochemical ingredients: A novel therapeutic method for combatting cardiovascular diseases[J]. Biomedecine amp; Pharmacotherapie, 2024, 172: 116313.
[18] 徐叔云, 亢如濂, 陈" 修, 等. 药理实验方法学[M]. 第2版. 北京: 人民卫生出版社, 1994: 921.
[19] 王传池, 吴" 珊, 江丽杰, 等. 1990—2020年我国冠心病中医证的流行病学调查研究概况[J]. 中国中医基础医学杂志, 2020, 26(12): 1883-1893.
[20] 中华中医药学会心血管病分会. 冠心病稳定型心绞痛中医诊疗指南[J]. 中医杂志, 2019, 60(21): 1880-1890.
[21] 刘甜甜, 姚魁武, 段锦龙. 血府逐瘀汤治疗心血管病的药理机制研究进展[J]. 吉林中医药, 2019, 39(10): 1397-1400.
[22] 姚" 旭. 赤芍和川芎在血瘀证大鼠上的应用[D]. 哈尔滨: 东北农业大学, 2013.
[23] 简维雄, 左和宁, 袁肇凯, 等. 心血瘀阻证动态演变过程大鼠模型的建立及方证验证评价[J]. 中医杂志, 2015, 56(16): 1420-1424.
[24] 郭强中, 李云英. 血瘀证研究进展[J]. 辽宁中医药大学学报, 2012, 14(8): 45-50.
[25] NARASIMHAN B, NARASIMHAN H, LORENTE-ROS M, et al. Therapeutic angiogenesis in coronary artery disease: A review of mechanisms and current approaches[J]. Expert Opinion on Investigational Drugs, 2021, 30(9): 947-963.
[26] CAO B, GUO Z, ZHU Y, et al. The potential role of PDGF, IGF-1, TGF-beta expression in idiopathic pulmonary fibrosis[J]. Chinese Medical Journal, 2000, 113(9): 776-782.
[27] 贺" 粤, 周亚滨, 王" 贺, 等. 基于血管新生理论探析冠心病中医药防治机制[J]. 辽宁中医药大学学报, 2022, 24(8): 203-209.
[28] YANG N N, YANG J W, YE Y, et al. Electroacupuncture ameliorates intestinal inflammation by the Extracellular Matrix[J]. Circulation Research, 2020, 127(7): 896-907.
[29] HU C J, WU Z F, HUANG Z H, et al. Nox2 impairs VEGF-A-induced angiogenesis in placenta via mitochondrial ROS-STAT3 pathway[J]. Redox Biology, 2021, 45: 102051.
〔收稿日期〕2024-07-01
〔基金项目〕湖南省自然科学基金项目(2024JJ8167);湖南中医药大学2022年度学科建设揭榜挂帅项目(22JBZ005);2023年湖南省研究生科研创新项目(CX20230796);湖南中医药大学2023年“一方”研究生创新项目(2023YF07)。
〔通信作者〕*张秋雁,女,博士,教授,博士研究生导师,E-mail:1746821852@qq.com。

