清脂固发酊对雄激素性脱发小鼠模型毛发生长的影响

〔摘要〕 目的 探讨清脂固发酊对雄激素性脱发(AGA)小鼠模型毛发生长的影响及作用机制。方法 将70只SPF级C57BL/6小鼠随机分为空白组、模型组、乙醇组、米诺地尔酊组及低、中、高浓度清脂固发酊组。除空白组外,其余各组连续4周皮下注射丙酸睾酮注射液5 mg/(kg·d),建立AGA小鼠模型。造模成功后在脱毛区继续皮下注射等量丙酸睾酮注射液的同时涂抹相应药物,其中空白组及模型组涂抹生理盐水,米诺地尔酊组涂抹5%米诺地尔酊,乙醇组涂抹70%乙醇,低、中、高浓度清脂固发酊组分别涂抹0.1、0.2、0.4 g/mL清脂固发酊,各组均涂抹1 mL/次,每日1次,连续治疗6周。肉眼观察小鼠毛发生长情况;记录脱毛区皮色变黑时间;用药干预14、21、28、35、42 d随机拔取新生毛发5根,测量其长度;HE染色观察脱毛区毛囊形态,并计算毛囊数量及终毛/毳毛比值;ELISA检测血清中睾酮(T)、雌二醇(E2)水平,并计算两者比值。结果 与空白组比较,模型组毛发稀疏灰暗、毛囊密度稀疏,皮色变黑时间明显升高(Plt;0.01),各个时间点新生毛发长度明显缩短(Plt;0.01),毛囊数量和终毛/毳毛比值明显降低(Plt;0.01),血清中T水平及T/E2比值显著升高(Plt;0.01),E2水平显著降低(Plt;0.01)。与模型组比较,低、中、高浓度清脂固发酊组毛发旺盛有光泽、毛囊密度较大,高浓度清脂固发酊组脱毛区皮色变黑时间明显升高(Plt;0.01),低浓度清脂固发酊组在干预28、35、42 d时新生毛发长度增长(Plt;0.05,Plt;0.01),中、高浓度清脂固发酊组在各个时间点新生毛发长度明显增长(Plt;0.01)、毛囊数量和终毛/毳毛比值明显升高(Plt;0.01)、血清E2水平均显著升高(Plt;0.01),低、中、高浓度清脂固发酊组T水平及T/E2比值均降低(Plt;0.05,Plt;0.01)。与低浓度清脂固发酊组比较,中、高浓度清脂固发酊组毛发更浓密黑亮、毛囊密度大,中浓度清脂固发酊组在干预35、42 d新生毛发长度明显增长(Plt;0.01),高浓度清脂固发酊组在干预21、28、35、42 d新生毛发长度明显增长(Plt;0.01),中、高浓度清脂固发酊组毛囊数量和终毛/毳毛比值升高(Plt;0.05,Plt;0.01)、T水平及T/E2比值显著降低(Plt;0.01)、E2水平升高(Plt;0.05,Plt;0.01)。结论 清脂固发酊可以促使毛囊提前进入生长期,增加毛囊数量,改善毛囊微型化,加速毛发生长,其可能是通过调节激素水平以发挥作用。
〔关键词〕 雄激素性脱发;脂溢性脱发;清脂固发酊;皮色变黑时间;新生毛发长度;毛囊数量;终毛/毳毛比值;激素水平
〔中图分类号〕R285.5"""nbsp;"""" 〔文献标志码〕A""""""""" 〔文章编号〕doi:10.3969/j.issn.1674-070X.2025.02.002
〔收稿日期〕2024-07-23
〔基金项目〕湖南省科技厅项目基金(2021SK51305)。
〔通信作者〕*向丽萍,女,博士,教授,主任医师,E-mail:xlpxkj@126.com。
Effects of Qingzhi Gufa Tincture on hair growth in a mouse model of androgenetic alopecia
TANG Yuying1, DUAN Yuqian1, WANG Shi2, HE Ruolan1, TAN Shimiao1, ZOU Wenjuan1, XIANG Liping2*
1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. The Second Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410000, China
〔Abstract〕 Objective To investigate the effects and mechanism of action of Qingzhi Gufa Tincture (QZGFT) on hair growth in androgenic alopecia (AGA) mouse model. Methods Seventy SPF C57BL/6 mice were randomly divided into blank group, model group, ethanol group, minoxidil tincture group, and low-, medium-, and high-concentration QZGFT groups. Except for the blank group, the other groups were subcutaneously injected with testosterone propionate injection 5 mg/(kg·d) for four weeks to establish AGA mouse model. After successful modeling, while continuing to administer an equal amount of testosterone propionate subcutaneously in the depilation area, the corresponding medications were applied at the same time. The blank and model groups were treated with normal saline, the minoxidil tincture group with 5% minoxidil tincture, the ethanol group with 70% ethanol, and the low-, medium-, and high-concentration QZGFT groups with 0.1 g/mL, 0.2 g/mL, and 0.4 g/mL QZGFT, respectively. Each group received 1 mL per application, once daily for six consecutive weeks. The hair growth was observed macroscopically. The time for skin darkening in the depilation area was recorded. After 14, 21, 28, 35, and 42 days of drug intervention, five newly grown hairs were randomly plucked and their length was measured. HE staining was used to observe the morphology of hair follicles in the depilation area, and the number of hair follicles as well as the terminal to vellus hair ratio were calculated. ELISA was used to check the levels of testosterone (T) and estradiol (E2) in serum, and the ratio of the two was calculated. Results Compared with the blank group, the hair in the model group was sparse and gray, with small density of hair follicles. The time for skin darkening significantly increased (Plt;0.01), the length of newly grown hairs was significantly shortened at each time point (Plt;0.01), and the number of hair follicles and the terminal to vellus hair ratio were significantly lower (Plt;0.01). The serum T level and T/E2 ratio were significantly elevated (Plt;0.01), while the serum E2 level was significantly lower (Plt;0.01). Compared with the model group, the low-, medium-, and high-concentration QZGFT groups had bright and shiny hair, with greater follicle density; the time for skin darking in the depilation area of the high-concentration QZGFT group was significantly higher (Plt;0.01); the length of newly grown hairs in the low-concentration QZGFT group increased at 28, 35, and 42 days after intervention (Plt;0.05, Plt;0.01). At each time point, the length of newly grown hairs (Plt;0.01), the number of hair follicles and the terminal to vellus hair ratio were significantly higher (Plt;0.01), and the serum E2 level was significantly higher (Plt;0.01) in the medium- and high- concentration QZGFT groups. The T level and T/E2 ratio of low-, medium-, and high-concentration QZGFT groups were decreased (Plt;0.05, Plt;0.01). Compared with the low-concentration QZGFT group, the medium- and high-concentration QZGFT groups exhibited denser and shinier hair with greater follicle density..The length of newly grown hairs in the medium-concentration QZGFT group significantly increased on the 35 and 42 days of intervention (Plt;0.01). At 21, 28, 35, and 42 days after intervention, the length of newly grown hairs in the high-concentration QZGFT group significantly increased (Plt;0.01). The medium- and high-concentration QZGFT groups also had increased number of hair follicles and terminal to vellus hair ratio (Plt;0.05, Plt;0.01), significantly reduced T levels and T/E2 ratio (Plt;0.01), and elevated E2 level (Plt;0.05, Plt;0.01). Conclusion QZGFT can promote the early entry of hair follicles into the growth phase, increase the number of hair follicles, improve hair follicle miniaturization, and accelerate hair growth, which may exert its effects by regulating hormone levels.
〔Keywords〕 androgenic alopecia; seborrheic alopecia; Qingzhi Gufa Tincture; time for skin darkening; length of newly grown hairs; number of hair follicles; terminal to vellus hair ratio; hormone levels
本文引用: 唐玉莹, 段雨倩, 王" 适, 何若斓, 谭诗淼, 邹文娟, 向丽萍. 清脂固发酊对雄激素性脱发小鼠模型毛发生长的影响[J]. 湖南中医药大学学报, 2025, 45(2): 196-203.
雄激素性脱发(androgenetic alopecia,AGA),又称脂溢性脱发,属于中医学“发蛀脱发”“蛀发癣”范畴,主要表现为头皮油腻多屑伴瘙痒,进而出现毛发稀疏脱落、毛囊萎缩等症[1]。在我国AGA男性患病率约为21.3%,女性患病率约为6.0%[2],且该病发病率逐年增加,呈现年轻化趋势,对患者的生活、工作、心理都造成极大的负面影响[3]。因此,治疗和预防AGA成为医学上的研究热点。
目前,AGA的发病机制尚不明确,可能与遗传、雄激素水平、雄激素受体及5α-还原酶的异常表达、微炎症、环境等因素相关[4]。目前,美国食品药品监督管理局对于治疗本病的推荐药物是非那雄胺和米诺地尔[5],但以上两种药物毒副作用明显;激光治疗与手术治疗虽可用于AGA,但费用较高,且对施术者技术有一定要求,推广性较差。近年来,对于中草药治疗脱发的研究日益增多,中药因其多靶点、多途径特点可改善脱发症状得到广泛关注。研究表明,与单纯西医治疗相比,中药辅助治疗脱发总有效率更高,且安全性高[6]。
清脂固发酊是由侧柏叶、透骨草、墨旱莲、丹参等11味中药浸泡于乙醇所制备而来,其直接作用于皮肤黏膜表面,直达病灶,具有高透过率、高吸收率、给药量可控等特点[3],且便于使用与携带,有利于提高患者依从性。本研究基于AGA小鼠模型探讨清脂固发酊对AGA毛发生长、毛囊修复、激素水平等方面的影响,以期丰富AGA的治疗方法,提高该病的治疗效果。
1 实验材料与方法
1.1" 实验动物
6~8周龄SPF级C57BL/6小鼠70只,体质量(20±2) g,由实验动物中心提供,实验动物生产许可证号:SCXK(辽)2020-0001。将70只健康的SPF级C57BL/6小鼠适应性喂养1周,室温20~25 ℃,光线、通风良好,自由饮水、进食,分笼饲养。实验通过湖南中医药大学医学伦理委员会批准(伦理编号:LLBH-202303220001),所有实验操作均严格遵循动物实验伦理学原则。
1.2" 清脂固发酊制备
将侧柏叶30 g、透骨草30 g、墨旱莲20 g、丹参15 g等11味中药药材粉碎成粗粉,以上中药由湖南中医药大学第二附属医院药剂科提供,按照《中华人民共和国药典2020年版四部》[7]酊剂项下的浸渍法,加70%乙醇浸泡2次,每次7 d。将此方法所得清脂固发酊作为中浓度清脂固发酊(0.2 g/mL),在此基础上将生药量减半,其余条件不变,作为低浓度清脂固发酊(0.1 g/mL),生药量增加至2倍作为高浓度清脂固发酊(0.4 g/mL)[8-9]。
1.3" 主要仪器
石蜡切片机(德国徕卡仪器有限公司,型号:RM2235);电热恒温鼓风干燥箱(上海精宏实验设备有限公司,型号:QH01-9030A);超纯水系统(力康生物医疗科技控股有限公司,型号:NW10LVF);显微镜型号、显微镜拍照系统(日本奥林巴斯株式会社,型号:BX53、DP73);微量移液器、酶标仪(美国伯腾仪器有限公司,型号:Proline、ELX-800);电热恒温培养箱(天津泰斯特仪器有限公司,型号:DH36001B)。
1.4" 主要试剂
5%米诺地尔酊(浙江万晟医药有限公司,批号:20010714);雌二醇ELISA试剂盒、睾酮ELISA试剂盒(武汉菲恩生物科技有限公司,批号:EU0390、EU0400);无水乙醇(国药集团医药股份有限公司,批号:10009218);苏木精染液(北京索莱宝科技有限公司,批号:H8070);曙红Y(醇溶)[生工生物工程(上海)股份有限公司,批号:A600190];二甲苯(上海阿拉丁生化科技股份有限公司,批号:1330-20-7);丙酸睾酮注射液、三溴乙醇(上海麦克林生化科技股份有限公司,批号:T818615、T903147)。
1.5" 实验分组
将70只小鼠适应性喂养1周后,按随机数字表法分为空白组、模型组、乙醇组、米诺地尔酊组、低浓度清脂固发酊组、中浓度清脂固发酊组、高浓度清脂固发酊组,每组10只。
1.6" 造模方法
参照文献[10-13]构建动物模型。在造模前1天用备皮刀将所有小鼠背部中央区域部分毛发剃除,每只小鼠的备皮面积约为2 cm×3 cm,然后按照脱毛膏的使用说明书对备皮区域进行彻底脱毛,以去除备皮后仍残留的毛发。脱毛处理24 h后,除空白组外,其余60只小鼠背部皮下多点注射丙酸睾酮5 mg/(kg·d),每日1次。丙酸睾酮注射4周后,分别从空白组和模型组随机抽取2只小鼠,用无菌组织剪取背部脱毛区皮肤约1 cm×1 cm,制作皮肤病理切片,HE染色观察皮肤毛囊形态、数量,用于评价模型是否成功。造模成功标准[14]:(1)小鼠背部毛发生长稀疏,毛发颜色暗淡,背部皮肤可见皮脂溢出;(2)组织病理学上表现为毛囊数量减少,毛干色素变浅、直径变小,毛囊微型化。造模成功后,再次用脱毛膏将每只实验动物背部中央区域的部分毛发脱毛,然后开始用药干预。
1.7" 治疗方法
造模成功后,除空白组外其余各组继续皮下注射丙酸睾酮5 mg/(kg·d)保持AGA模型,同时每日在脱毛区涂抹相应药物。其中空白组及模型组涂抹生理盐水;乙醇组涂抹70%乙醇;米诺地尔酊组涂抹5%米诺地尔酊;低、中、高清脂固发酊组涂抹相应浓度清脂固发酊。均为1 mL/d,每日1次,连续6周。
1.8" 样本采集与处理
实验10周后,禁食12 h,每组随机抽取5只小鼠,使用三溴乙醇溶液对小鼠进行腹腔麻醉。小鼠麻醉后,通过摘眼球取血法采血,每只小鼠大约取1 mL血液,收集于无菌EP管中,在室温放置20 min,待血液自然凝固后,4 ℃以12 000 r/min离心10 min(离心半径:9 cm),仔细收集上清液,存于无菌EP管内,在-80 ℃冰箱保存备用。采血结束后,用无菌组织剪取背部脱毛区皮肤组织约1 cm×1 cm,放置在EP管中,在浓度为10%的甲醛溶液中进行组织固定。另取一份皮片,存于EP管内,在-80 ℃冰箱保存备用。
1.9" 脱毛区皮色变化及毛发长度测定
造模成功开始用药干预后,每日于固定时间(共计6周)观察背部脱毛区的皮色变化,观察并记录脱毛区皮色变黑的时间,并且分别于第14、21、28、35、42日随机拔取受试小鼠背部新生毛发5根,用游标卡尺测量毛发长度。整个过程需每日观察并记录小鼠背部脱毛区外用药物后有无红肿、渗液、溃烂、干燥起皮,生活及饮食习惯有无改变。
1.10" 脱毛区皮片病理学观察
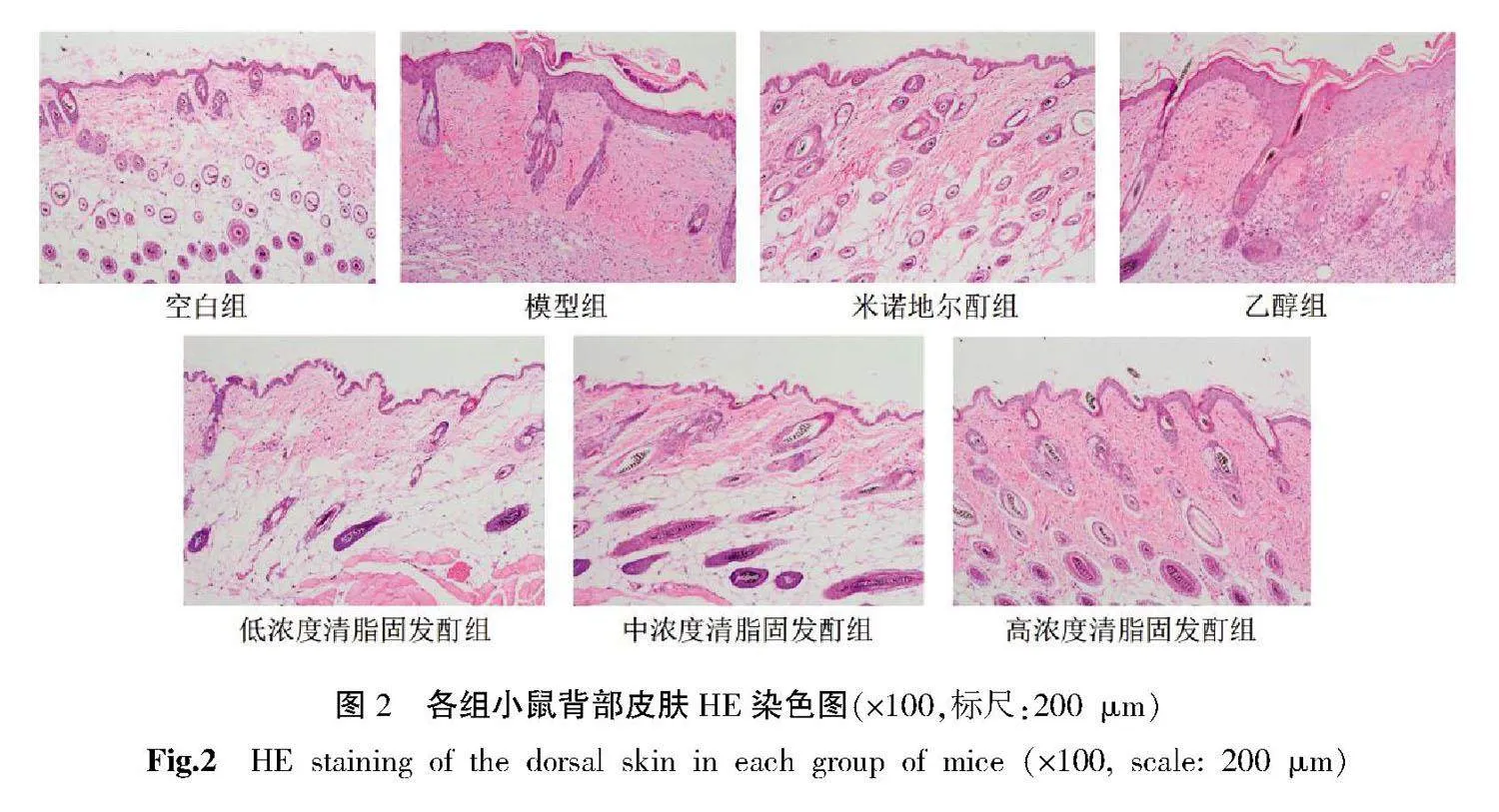
取出用10%的甲醛溶液固定的皮肤组织,石蜡包埋、切片、常规脱蜡、脱水,HE染色后脱水、透明、封片,于普通光学显微镜下观察。主要观察小鼠背部脱毛区皮片毛囊形态、数量,并计算终毛/毳毛比值。
1.11" 血清激素含量测定
将冻存的血清样本于-20 ℃、4 ℃梯度解冻后,平衡到室温,严格按照ELISA试剂盒说明书步骤操作,测定小鼠血清中的睾酮(testosterone,T)、雌二醇(estradiol,E2)水平,并计算T/E2比值。
1.12" 统计学分析
采用统计软件SPSS 25.0对数据进行统计分析,采用Graph Pad Prism 8.0制作柱状图。计量资料符合正态分布用“x±s”描述,不符合正态分布用M(P25~P75)描述。若数据满足正态分布及方差齐性,选用单因素方差分析并采用LSD检验进行两两比较;若数据不满足正态分布,则使用非参数检验Kruskal-Wallis单因素ANOVA检验进行多组比较。不同时期毛发长度变化情况采用重复测量方差分析。以Plt;0.05为差异具有统计学意义。
2 结果
2.1" 各组小鼠毛发生长情况
干预7 d,空白组、米诺地尔酊组毛发生长明显,低、中、高浓度清脂固发酊组毛发生长整体情况低于空白组及米诺地尔酊组,而模型组及乙醇组毛发生长稀疏。干预21 d,空白组小鼠脱毛区毛发几乎完全覆盖,毛色黑亮;米诺地尔酊组及中、高浓度清脂固发酊组毛发覆盖率优于低浓度清脂固发酊组,模型组、乙醇组小鼠毛发生长仍稀疏。干预42 d,空白组、米诺地尔酊组及高浓度清脂固发酊组小鼠脱毛区毛发基本完全覆盖,毛发黑亮有光泽;低、中浓度清脂固发酊组仍有小部分区域毛发生长较稀疏;模型组、乙醇组小鼠整体毛发稀疏,毛色灰暗,部分区域无毛发生长。详见图1。
整个用药干预期间空白组小鼠精神活跃,对外界刺激敏感;模型组、乙醇组小鼠较空白组兴奋、好动,脾气较暴躁;米诺地尔酊组及低、中、高浓度清脂固发酊组小鼠较模型组性情平和,相对安静。实验过程中个别小鼠背部脱毛区皮肤出现肿胀、鼓包,可自行恢复,考虑与注射手法不当相关,个别小鼠背部脱毛区皮肤出现抓痕、破溃,为小鼠间相互撕抓所致。
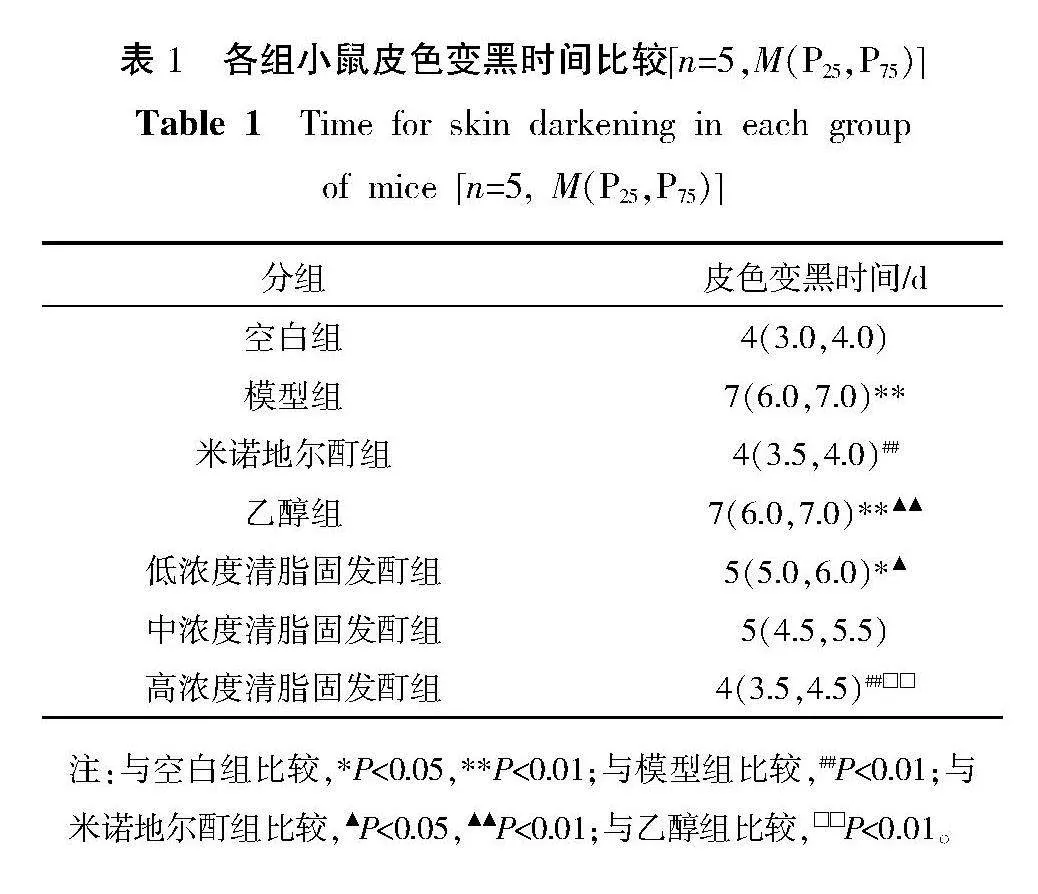
2.2" 各组小鼠脱毛区皮色变黑时间比较
与空白组比较,模型组皮色变黑时间明显升高(Plt;0.01);与模型组比较,米诺地尔酊组、高浓度清脂固发酊组皮色变黑时间均明显升高(Plt;0.01);与米诺地尔酊组比较,乙醇组、低浓度清脂固发酊组皮色变黑时间均升高(Plt;0.05,Plt;0.01);与乙醇组比较,高浓度清脂固发酊组小鼠皮色变黑时间明显降低(Plt;0.01)。详见表1。
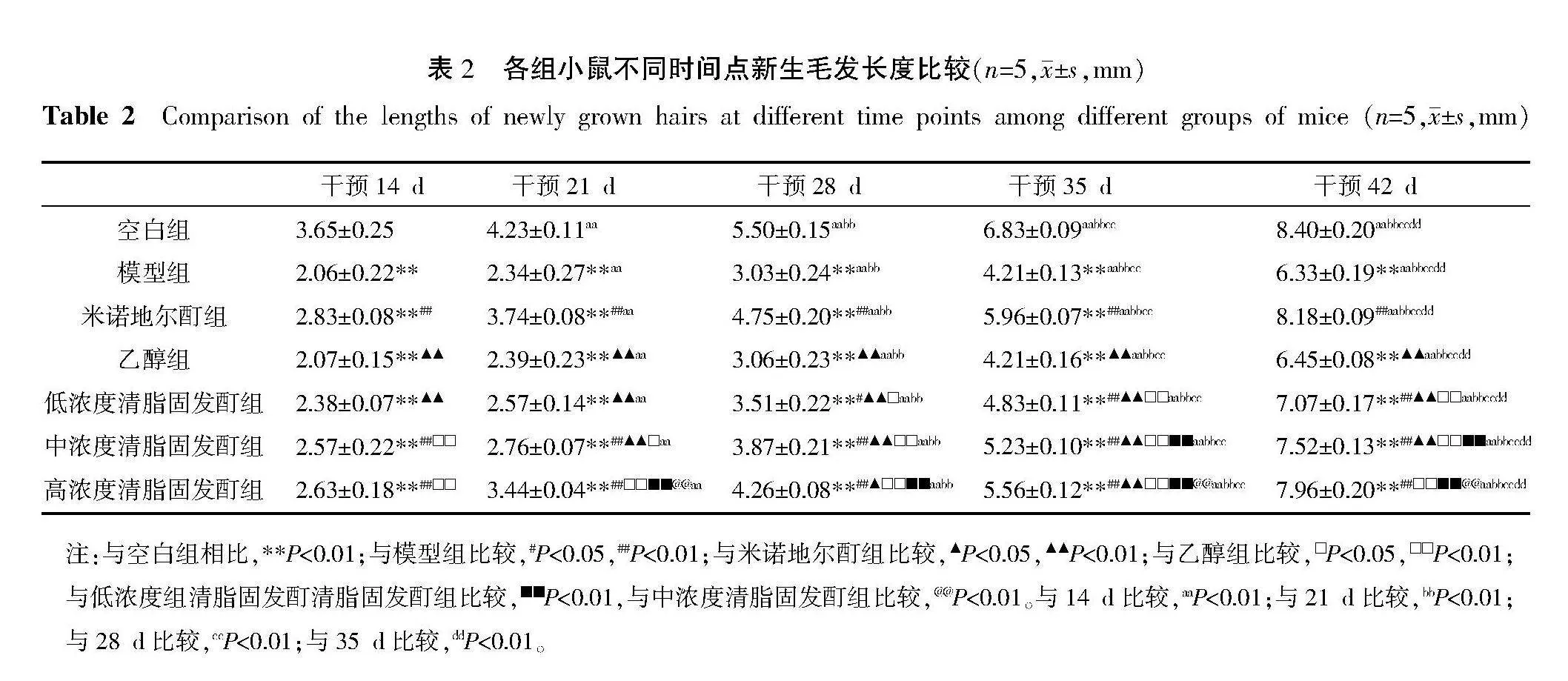
2.3" 各组小鼠新生毛发长度比较
与空白组比较,模型组在各个时间点新生毛发长度明显缩短(Plt;0.01);与模型组比较,米诺地尔酊组及中、高浓度清脂固发酊组在各个时间点新生毛发长度明显增长(Plt;0.01),低浓度清脂固发酊组在干预28、35、42 d时新生毛发长度增长(Plt;0.05,Plt;0.01);与米诺地尔酊组比较,乙醇组、低浓度清脂固发酊组在各个时间点新生毛发长度明显缩短(Plt;0.01),中浓度清脂固发酊组在干预21、28、35、42 d时新生毛发长度明显缩短(Plt;0.01),高浓度清脂固发酊组在干预28、35 d时新生毛发长度缩短(Plt;0.05,Plt;0.01);与乙醇组比较,低浓度清脂固发酊组在干预28、35、42 d时新生毛发长度增长(Plt;0.05,Plt;0.01),中、高浓度清脂固发酊组在各个时间点新生毛发长度增长(Plt;0.05,Plt;0.01);与低浓度清脂固发酊组比较,中浓度清脂固发酊组在干预35、42 d时新生毛发长度明显增长(Plt;0.01),高浓度清脂固发酊组在干预21、28、35、42 d时新生毛发长度明显增长(Plt;0.01);与中浓度清脂固发酊组比较,高浓度清脂固发酊组在干预21、35、42 d时新生毛发长度明显增长(Plt;0.01)。与干预14 d比较,干预21、28、35、42 d时各组新生毛发长度明显增长(Plt;0.01);与干预21 d比较,干预28、35、42 d时各组新生毛发长度明显增长(Plt;0.01);与干预28 d比较,干预35、42 d时各组新生毛发长度明显增长(Plt;0.01);与干预35 d比较,干预42 d时各组新生毛发长度明显增长(Plt;0.01)。详见表2。
2.4" 各组小鼠毛囊形态比较
空白组可见毛囊密度大,毛干色素深;模型组、乙醇组毛囊密度小,毛干色素浅或无,毛囊微型化;与模型组相比,米诺地尔酊组及中、高浓度清脂固发酊组毛囊密度较大,毛干黑色素形成明显,毛囊微型化改善,而低浓度清脂固发酊组毛囊整体改善情况较差。详见图2。
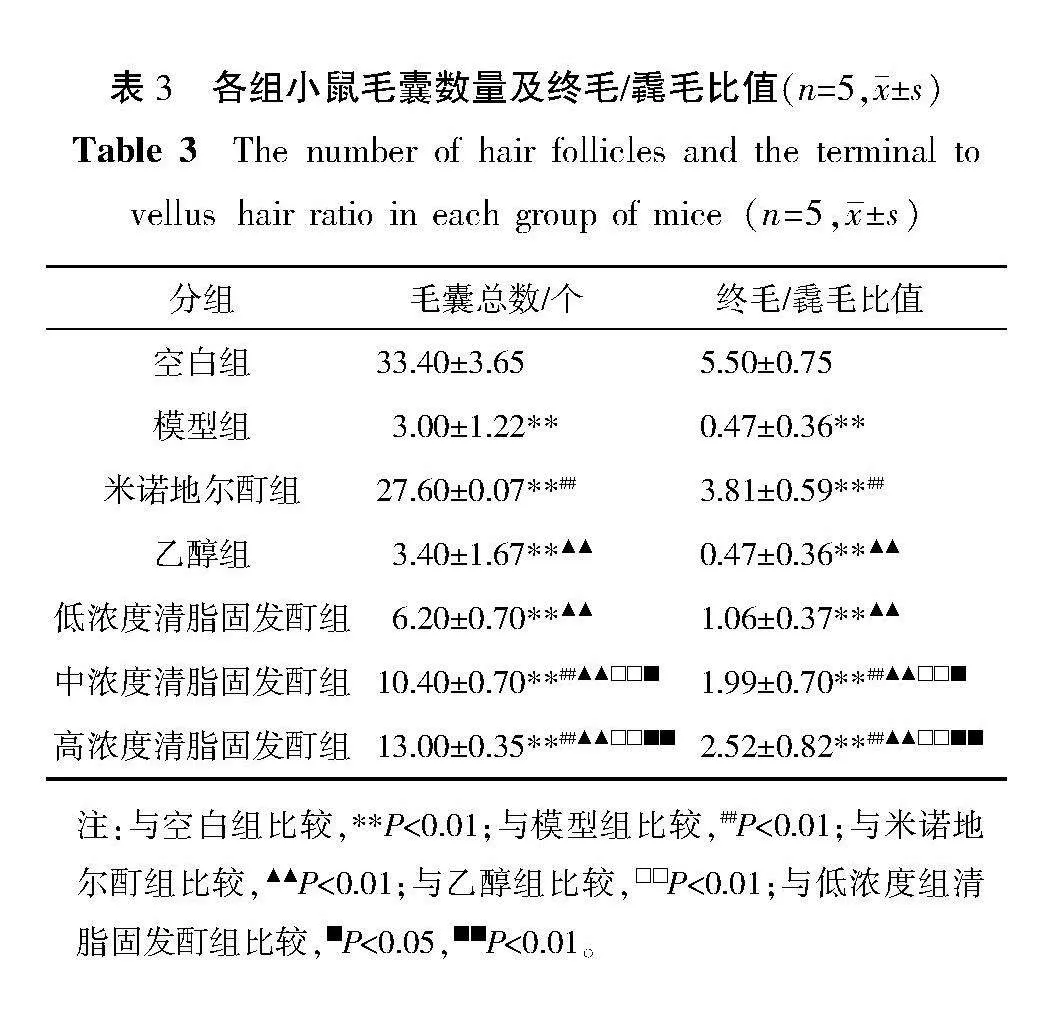
2.5" 各组小鼠毛囊数量及终毛/毳毛比值比较
与空白组比较,模型组的毛囊数量和终毛/毳毛比值明显降低(Plt;0.01);与模型组比较,米诺地尔酊组及中、高浓度清脂固发酊组的毛囊数量和终毛/毳毛比值明显升高(Plt;0.01);与米诺地尔酊组比较,乙醇组及低、中、高浓度清脂固发酊组毛囊数量和终毛/毳毛比值明显降低(Plt;0.01);与乙醇组、低浓度清脂固发酊组比较,中、高浓度清脂固发酊组毛囊数量和终毛/毳毛比值升高(Plt;0.05,Plt;0.01)。详见表3。
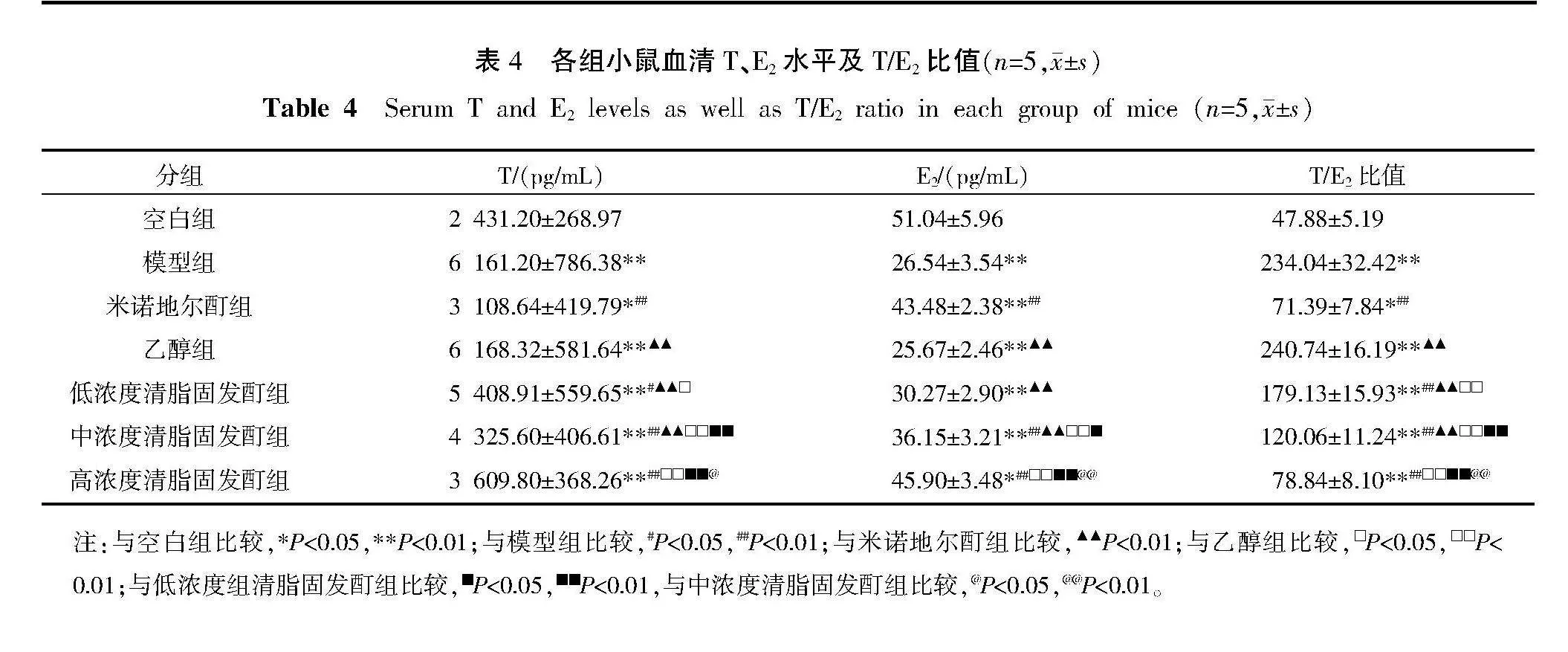
2.6" 各组小鼠血清中T、E2水平及T/E2比值比较
与空白组比较,模型组小鼠血清中T水平、T/E2比值均升高(Plt;0.01),E2水平显著降低(Plt;0.01);与模型组比较,米诺地尔酊组及低、中、高浓度清脂固发酊组T水平、T/E2比值均降低(Plt;0.05,Plt;0.01),米诺地尔酊组及中、高浓度清脂固发酊组E2水平均显著升高(Plt;0.01);与米诺地尔酊组比较,乙醇组及低、中浓度清脂固发酊组T水平、T/E2比值均显著升高(Plt;0.01),E2水平显著降低(Plt;0.01);与乙醇组比较,低、中、高浓度清脂固发酊组T水平、T/E2比值均降低(Plt;0.05,Plt;0.01),中、高浓度清脂固发酊组E2水平均显著升高(Plt;0.01);与低浓度清脂固发酊组比较,中、高浓度清脂固发酊组T水平、T/E2比值均显著降低(Plt;0.01),E2水平均升高(Plt;0.05,Plt;0.01);与中浓度清脂固发酊组比较,高浓度清脂固发酊组T水平、T/E2比值均降低(Plt;0.05,Plt;0.01),E2水平显著升高(Plt;0.01)。详见表4。
3 讨论
AGA是临床最常见的脱发类型之一,严重影响患者的心理及生活质量。中医学认为AGA的发生与气血失调、五脏失衡关系密切,其中以肝肾亏虚、气血不足为本,以湿、热、瘀、风为标,临床上常分为湿热蕴结证、血热风燥证、气郁血瘀证、气血不足证、肝肾亏虚证,故治疗时多以清热祛湿、疏风润燥、行气活血、益气养血、补益肝肾为主[15-16]。
西医多认为AGA的发病因素众多,其中雄激素占有决定性因素,其机制为T在5α-还原酶的作用下被还原成二氢睾酮,其进一步与雄激素受体结合形成复合物,进入细胞核控制毛发生长基因的表达,导致头发正常的生长期缩短,毛囊微小化甚至萎缩,进而出现头发变细甚至脱发[4,17]。而体内雌激素的主要存在形式为E2,其大部分由雄激素在芳香化酶的作用下转化而来,不仅可以促使毛囊提前进入生长期,也可以促进胰岛素样生长因子-1、血管内皮生长因子等分泌,从而刺激毛囊增殖、改善局部微循环以促进毛发生长[18]。研究发现,在毛囊中可检测到芳香酶活性,其主要在生长期表达[19]。故当T与E2处于相对平衡状态时毛发可正常生长,当二者平衡失调时,尤其是当T水平明显上升时,使得毛囊生长期缩短,毛囊持续进行性微型化,最终导致脱发。多项研究证明,AGA患者血清中T含量显著升高[20-21]。
清脂固发酊由侧柏叶、透骨草、墨旱莲、丹参等11味中药组成,具有清热除湿、凉血祛风、生发固发之功,其中侧柏叶可清热凉血、生发乌发;透骨草可祛风除湿、活血解毒;墨旱莲既可滋补肝肾精血以生发,又可入血分以清热凉血;丹参可清热凉血活血。研究发现,侧柏叶中富含侧柏叶挥发油、黄酮类物质等,可有效刺激毛囊转换至生长期、抑制5α-还原酶活性[22-23];透骨草可降低T及E2水平、抑制毛囊细胞凋亡[24];墨旱莲可降低雄激素水平,同时促进毛囊黑色素形成[25];丹参主要有效成分丹参酮具有雌激素样活性,通过拮抗雄激素发挥治疗AGA作用,同时亦可以通过调节毛囊生长周期、改善微循环从而促进毛发生长[26-27]。而本次实验结果表明,与模型组比较,高浓度清脂固发酊组小鼠脱毛区皮色变黑时间提前,提示清脂固发酊具有缓解丙酸睾酮抑制毛发生长的作用,促使毛囊提前进入生长期。与模型组相比,中、高浓度清脂固发酊组在各个时间点新生毛发长度明显增长,毛囊数量增多,终毛/毳毛比值增大,毛干黑色素形成明显,毛囊微型化改善,提示清脂固发酊能发挥增加毛囊数量、改善毛囊微型化、促进毛发生长的作用。与模型组比较,低、中、高浓度清脂固发酊组T水平、T/E2比值均降低,且中、高浓度清脂固发酊组E2水平均升高,提示清脂固发酊可能是通过调节激素水平从而发挥治疗AGA的作用。
本次研究清脂固发酊对AGA小鼠毛发生长的影响并对其作用机制进行了初步探讨,体外实验尚未完善,促毛发生长作用的相关机制尚未完全阐明,未来可进一步围绕细胞因子、信号通路、基因检测等方向深入研究和探讨清脂固发酊治疗AGA的相关机制,为其治疗AGA提供全面客观依据。此外,中医药可通过多成分、多靶点、多途径发挥作用,而清脂固发酊由多味药物组成,其成分复杂,未来可以针对其化学成分进行更精准细化的研究,筛选出有效成分并探索其最佳浓度。
参考文献
[1] 中国医师协会美容与整形医师分会毛发整形美容专业委员会. 中国人雄激素性脱发诊疗指南[J]. 中国美容整形外科杂志, 2019, 30(1): 前插2-前插6.
[2] 杨嘉祺, 逯" 敏, 冯" 侃, 等. 激素性脱发分子机制的研究进展[J]. 甘肃科技, 2022, 38(6): 128-132.
[3] 马林纳, 白" 明, 苗明三. 中药酊剂临床外用现状与分析[J]. 中华中医药杂志, 2021, 36(1): 532-535.
[4] GRYMOWICZ M, RUDNICKA E, PODFIGURNA A, et al. Hormonal effects on hair follicles[J]. International Journal of Molecular Sciences, 2020, 21(15): 5342.
[5] 吴" 巍, 张" 颖, 张" 美, 等. 雄激素性脱发的药物研究进展[J]. 中国美容整形外科杂志, 2022, 33(5): 308-311.
[6] YOU Q, LI L, MA X, et al. Meta-analysis on the efficacy and safety of traditional Chinese medicine as adjuvant therapy for refractory androgenetic alopecia[J]. Evidence-Based Complementary and Alternative Medicine, 2019, 2019: 9274148.
[7] 国家药典委员会. 中华人民共和国药典: 2020年版: 四部[M]. 北京: 中国医药科技出版社, 2020: 56.
[8] 王" 晖. 皮肤外用药物研究方法学[M]. 北京: 人民卫生出版社, 2017: 144-148.
[9] 中国药理学会中药药理专业委员会. 中药外用药理实验技术规范(草案)[J]. 中药药理与临床, 2014, 30(4): 128-131.
[10] 孙位军, 甘大莉, 王" 张, 等. 脱毛动物模型造模要素和药物防治的数据挖掘研究[J]. 中药与临床, 2017, 8(6): 57-61.
[11] CRABTREE J S, KILBOURNE E J, PEANO B J, et al. A mouse model of androgenetic alopecia[J]. Endocrinology, 2010, 151(5): 2373-2380.
[12] FU D L, HUANG J F, LI K T, et al. Dihydrotestosterone-induced hair regrowth inhibition by activating androgen receptor in C57BL6 mice simulates androgenetic alopecia[J]. Biomedicine amp; Pharmacotherapy, 2021, 137: 111247.
[13] 李琳琳. 雄激素脱发模型小鼠的建立及其初步探讨[D]. 广州: 南方医科大学, 2021.
[14] LIU W W, LI K T, WANG G F, et al. Impairment of autophagy may be associated with follicular miniaturization in androgenetic alopecia by inducing premature catagen[J]. The Journal of Dermatology, 2021, 48(3): 289-300.
[15] 李思远, 武" 忠. 中医药治疗脂溢性脱发的临床研究进展[J]. 中国中医药科技, 2022, 29(6): 1135-1138.
[16] 李" 瑒, 李忻红. 中药方剂在治疗脂溢性脱发中的应用[J]. 光明中医, 2022, 37(12): 2145-2148.
[17] 徐宇轩, 范卫新. 雄激素受体与雄激素性秃发相关性研究进展[J]. 临床皮肤科杂志, 2019, 48(9): 572-577.
[18] 王超凡, 毕凌波, 林雪雯, 等. 雄激素性秃发相关遗传易感基因的全基因组关联研究进展[J]. 临床皮肤科杂志, 2022, 51(11): 687-690.
[19] INUI S, ITAMI S. Androgen actions on the human hair follicle: Perspectives[J]. Experimental Dermatology, 2013, 22(3): 168-171.
[20] CHEN Q T, TAO Q W, ZHU Q L, et al. Association between trichoscopic features and serum hormone levels and vitamin D concentration in patients with androgenetic alopecia in Eastern China: A cross-sectional study[J]. Clinical, Cosmetic and Investigational Dermatology, 2023, 16: 2547-2555.
[21] ZHANG Y C, XU J J, JING J, et al. Serum levels of androgen-associated hormones are correlated with curative effect in androgenic alopecia in young men[J]. Medical Science Monitor, 2018, 24: 7770-7777.
[22] 张瑞峰, 曾" 阳, 刘力宽, 等. 侧柏叶的化学成分与药理学作用研究进展[J]. 中国野生植物资源, 2021, 40(4): 53-56.
[23] 范" 娜. 侧柏叶促毛发生长的药效物质基础及其作用机制[D]. 西安: 西北大学, 2022.
[24] 孔维嘉, 陈佳祺, 张文旭, 等. 复方透骨草酊对睾酮的抑制及促进毛发生长作用的初步研究[J]. 实用皮肤病学杂志, 20, 15(1): 41-45.
[25] TAO R, LIU E W, ZHAO X, et al. Combination of Ligustri Lucidi Fructus with Ecliptae Herba and their phytoestrogen or phytoandrogen like active pharmaceutical ingredients alleviate oestrogen/testosterone-induced benign prostatic hyperplasia through regulating steroid 5α-reductase[J]. Phytomedicine, 2022, 102: 154169.
[26] JIN J, HU Q Y, XU W W, et al. Tanshinone IIA attenuates estradiol-induced polycystic ovarian syndrome in mice by ameliorating FSHR expression in the ovary[J]. Experimental and Therapeutic Medicine, 2019, 17(5): 3501-3508.
[27] 方慧娟. 丹参酮胶囊治疗雄激素性秃发模型小鼠的机制研究[D]. 北京: 北京中医药大学, 2021.
(本文编辑" 田梦妍)

