基于“睡美人”转座系统观察OGT抑制剂HLY838对肝癌的治疗作用
【摘 要】目的:利用“睡美人”转座系统和快速大容量尾静脉注射法,建立肝癌动物模型,并观察O-连接N-乙酰氨基葡萄糖转移酶(O-linked N-acetylglucosamine transferase,OGT)抑制剂(R)-3-(2-甲氧基苯基)-1-(噻吩-2-基甲基)哌嗪-2,5-二酮[(R)-3-(2methoxyphenyl)-1-(thiophen-2-ylmethyl)piperazine-2,5dione,HLY838]对肝癌的治疗效果。方法:将6~8周龄雄性C57BL/6J小鼠随机分为3组,分别将插入神经母细胞瘤ras病毒同源物(neuroblastoma RAS viraloncogene homolog,NRAS)的NRASV12转座子质粒、表达β-连环蛋白(β-catenin)基因转座子质粒、表达Yes相关蛋白(Yes-associated protein,YAP)基因的转座子质粒pT3-EF1aH Yap S127A与转座酶SB100质粒的混合溶液经尾静脉快速注射至小鼠体内,饲养8~16周后处死小鼠,观察肝脏成瘤情况以及肝脏病理学变化。肝癌模型建成后,腹腔注射HLY838,观察对肝癌的治疗效果。结果:高压注射质粒8~16周后,小鼠肝脏体积增大,表面出现颗粒状、结节样改变;苏木精-伊红染色(hematoxylin-eosin staining,HE)染色显示肝组织结构紊乱,出现多个肿瘤结节。pT3-EF1aH YAP S127A组成瘤率高、时间短,但肿瘤较小;pT/CAGGS-NrasV组肿瘤结节大小适中,但成瘤时间较长;pT3-N90-β-catenin组肿瘤主要为肝细胞癌。HLY838治疗组小鼠肝肿瘤结节数变少,小鼠肝肿瘤负担减轻。结论:应用水动力大容量尾静脉注射质粒的方法可快速建立小鼠肝癌模型,成功率较高。OGT抑制剂HLY838对小鼠肝癌有较好的抗肿瘤效果。
【关键词】肝肿瘤;动物模型;“睡美人”转座系统;水动力尾静脉注射;(R)-3-(2-甲氧基苯基)-1-(噻吩-2-基甲基)哌嗪-2,5-二酮
【中图分类号】R735.7【文献标志码】A【收稿日期】2024-06-26
基金项目:国家自然科学基金资助项目(编号:82272975)。
Therapeutic effect of the O-linked N-acetylglucosamine transferase inhibitor HLY838 on liver cancer:a study based on the Sleeping Beauty transposition system
Liang Huijun,Huang Luyi,Wang Kai,Tang Ni
(Key Laboratory of Molecular Biology of Infectious Diseases Designated by the Chinese Ministry of Education,Chongqing Medical University)
【Abstract】Objective:To establish an animal model of liver cancer by rapid high-volume tail vein injection,and to investigate the therapeutic effect of O-linked N-acetylglucosamine transferase inhibitor(R)-3-(2methoxyphenyl)-1-(thiophen-2-ylmethyl)pipera‐zine-2,5dione(HLY838) on liver cancer based on the Sleeping Beauty(SB) transposition system. Methods:Male C57BL/6J mice,aged 6-8 weeks,were randomly divided into three groups and were given the NRASV12 transposon plasmid,the β-catenin geneexpressing transposon plasmid,or the YAP gene-expressing transposon plasmid pT3-EF1aH Yap S127A,mixed with the transposase SB100 plasmid,through rapid high-volume tail vein injection. The mice were sacrificed after 8-16 weeks of feeding to observe tumor formation and liver pathological changes. After the establishment of the liver cancer model,HLY838 was injected intraperitoneally to investigate its therapeutic effect on liver cancer.Results:After high-pressure injection of the plasmids for 8-16 weeks,there was an in‐crease in liver volume,with granular and nodular changes on the surface of the liver,and HE staining showed disordered structure of the liver and the presence of multiple tumor nodules. The pT3-EF1aH YAP S127A group had a higher tumor formation rate and a shorter duration,but with a relatively small tumor size;the pT/ CAGGS-NrasV group had moderately sized tumor nodules,but with a relative long time for tumor formation; the pT3-N90-β-catenin group mainly had hepatocellular carcinoma. The HLY838 treatment group had reductions in the number of liver tumor nodules and the burden of liver tumor. Conclusion:The method of hydrodynamic high-volume tail vein injection can be used to establish a mouse model of liver cancer rapidly,with a relatively high success rate. The OGT inhibitor HLY838 has a good antitumor effect on liver cancer in mice.
【Key words】liver tumor;animal model;Sleeping Beauty transposition system;hydrodynamic tail vein injection;(R)-3-(2methoxy‐phenyl)-1-(thiophen-2-ylmethyl)piperazine-2,5dione
肝癌(hepatocellular carcinoma,HCC)是全球公共卫生问题之一,目前肝癌发病率已升至我国第4位,死亡率居第2位,构成了严峻的公共卫生挑战[1]。肝癌起病隐匿,易侵袭性生长,难以早期诊断,极大阻碍了对其发病机制和治疗策略的研究。因此建立合适的肝癌动物模型对其生长、演进和转移等生物学特征研究和抗肿瘤药物疗效评价都具有重要意义。目前常见的肝癌小鼠模型包括自发性肿瘤模型、诱发性肿瘤模型、移植型肿瘤模型和基因修饰型肿瘤模型。自发性肝癌模型成瘤时间差异较大,耗时较长[2]。常见的诱导型模型存在建模时间长、小鼠死亡率较高等缺点[3]。移植型肝癌模型比如原位成瘤模型,则对操作技术要求较高[4]。基因修饰肝癌模型主要通过插入致癌基因诱导肝癌形成,该方法建模时间相对较短,而且可以研究特定基因对肝癌进展的调控作用。“睡美人”转座系统能快速将致癌基因整合到小鼠体内,过表达致癌基因,在短时间内诱导肿瘤形成[5]。相比其他肿瘤模型,“睡美人”系统建立的肝癌模型具有周期短,死亡率低和成功率高等优点。
O-连接-N-乙酰葡糖胺基化(O-GlcNAcylation,O-GlcNAc)糖基化修饰是细胞内蛋白质的一种重要的翻译后修饰,催化单个β-O-GlcNAc可逆添加到蛋白质的丝氨酸或苏氨酸残基上[6]。O-GlcNAc修饰是1个高度动态的过程,真核细胞中O-连接N-乙酰氨基葡萄糖转移酶(O-linked N-acetylglucosamine transferase,OGT)和O-连接N-乙酰氨基葡萄糖苷酶(O-linked N-acetylglucosamine glucosidase,OGA)是催化O-GlcNA修饰可逆反应的唯一一对酶。多数肿瘤组织中OGT水平升高或OGA水平降低,导致O-GlcNAc糖基化修饰整体水平增加,促进肿瘤的进展[7-8]。但目前采用OGT抑制剂阻断O-GlcNAc修饰抗肿瘤的实验研究较少[9],需要进一步明确OGT抑制剂抗肿瘤效应的确切机制,并在多种动物模型中进行验证。
本研究结合水动力转染技术与SB100“睡美人”系统,将人类肝癌细胞常见突变基因pT/CAGGS- NrasV、pT3-EF1aH Yap S127A或pT3-N90-β-catenin整合到小鼠肝细胞基因组中构建肝癌模型,比较神经母细胞瘤ras病毒同源物(neuroblastoma RAS viraloncogene homolog,NRAS)、Yes相关蛋白(Yesassociated protein,YAP)以及β-连环蛋白(β-catenin)致癌基因诱导肝脏成瘤的差异。在YAP诱导的“睡美人”肝癌模型中,进一步观察OGT抑制剂(R)-3-(2-甲氧基苯基)-1-(噻吩-2-基甲基)哌嗪-2,5-二酮[(R)-3-(2methoxyphenyl)-1-(thiophen-2-ylmethyl)piperazine-2,5dione,HLY838]的抗肿瘤效果。
1 材料与方法
1.1 实验动物
采用35只6~8 周龄、体质量18~20 g的雄性C57BL/6J小鼠进行动物实验。小鼠饲养于重庆医科大学实验动物中心,恒温(18~22 ℃)和恒湿(50%~80%),自由摄取标准饲料与无菌水。动物许可证号:SYXK(渝)2022-0016。本动物实验通过了重庆医科大学实验动物伦理委员会的审核(审批号:IACUC-CQMU-2023-09064)。所有动物实验均符合实验动物管理和使用的有关标准。
1.2 试剂
质粒大量抽提试剂盒购于北京康为世纪生物科技有限公司(货号:CW2104M)。质粒pCMV-CAT-T7-SB100(货号:#34879)、pT/CAGGS-NrasV(货号:#20205)由重庆医科大学感染实验室唐开福老师课题组赠送,pT3-N90-β-catenin(货号:#31785),pT3-EF1aH Yap S127A(货号:#86497)购于Addgene公司。抗增殖细胞核抗原抗体(Anti proliferating cell nuclear antigen antibody,PCNA)抗体购自美国Protein‐tech公司(货号:10205-2-AP);AFP抗体购自美国Protein‐tech公司(货号:14550-1-AP)。抗O-GlcNAc抗体购自Ab‐cam公司(货号:ab2739),β-actin抗体购自北京中山金桥生物技术有限公司(货号:TA-09),OGT抗体购自Abcam公司(货号:AB96718)。AKT抗体(货号:2938T)、p-AKT抗体(货号:4060S)均购于Cell Signaling Technology公司。EDU细胞增殖检测试剂盒(货号:C0071S)购于碧云天生物技术有限公司。
1.3 方法
1.3.1 质粒提取 将转化有目的质粒的菌种增菌后取2 mL接种于500 mL相应抗性的LB培养基中,37 ℃、200 r/min条件在恒温摇床内振荡培养12~16 h。按照无内毒素提取试剂盒(货号:CW2104M,北京康为世纪生物科技有限公司)标准操作步骤进行质粒提取。
1.3.2 质粒注射 分别将6 μg pT/CAGGS-NrasV与3 μg pCMV-CAT-T7-SB100混合、50 μg pT3-EF1aH YAP S127A与5 μg pCMV-CAT-T7-SB100混合、25 μg pT3-N90-β-catenin与1 μg pCMV-CAT-T7-SB100混合后通过小鼠尾静脉快速注射[10-11]。
1.3.3 药物处理 HLY838药物以及处理浓度由课题组前期确定[12]。“睡美人”系统构建肝癌模型后,将小鼠随机分为2组,分别于小鼠腹膜内注射对照二甲基亚砜(dimethyl sulfox‐ide,DMSO)或HLY838(10 mg/kg),每周2次,持续4周后处死小鼠。OGT抑制剂OSMI-1(货号:T16409)购于陶术生物,在HepG2细胞中作为阳性对照,使用20 μmol/L浓度处理12 h。
1.3.4 免疫组化(immunohistological staining,IHC) 4%多聚甲醛固定肝脏标本,石蜡包埋后,切成4 μm的切片。样品脱蜡、水化后,采用3%过氧化氢溶液浸泡阻断内源性过氧化物酶处理,切片煮沸进行抗原修复,5%山羊血清孵育后,分别采用1∶3 000浓度的PCNA、1∶100浓度的AFP抗体或1∶100浓度的O-GlcNAc抗体过夜、然后将切片与第二抗兔或抗小鼠IgG孵育,用磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗5次后加入DAB显色,苏木精复染,Pannoramic Scan 250 Flash扫描,并使用Pannoromic Viewer 1.15.2(3DHistech,Budapest,Hungary)获取图像。
1.3.5 苏木精-伊红染色(hematoxylin-eosin staining,HE) 采用4%多聚甲醛固定肝脏标本,委托里来医学实验中心进行包埋染色。
1.3.6 Western blot 肝组织提取蛋白质后,通过10% SDS/ PAGE分离蛋白质样品,并将其电转移到PVDF膜上。在5%脱脂牛奶中封闭1 h后,分别采用O-GlcNAc、OGT、AKT、pAKT或β-actin的抗体4 ℃下过夜孵育。随后与辣根过氧化物酶偶联的第二抗体一起孵育,加入ClarityTM Western ECL(Bio-Rad,CA,USA)底物,观察染色条带。
1.3.7 克隆形成实验 将2×103个细胞接种在6孔板中并培养10 d。菌落用0.04%结晶紫染料染色,并计数3次。
1.3.8 EDU细胞增殖实验 取对数生长期细胞,接种于12孔板中。HLY838处理12 h后,用EDU标记。标记完成后,对细胞进行固定并染色,最后获取图像进行分析,重复实验3次。
1.4 基因表达数据库分析
采用肿瘤基因组图谱数据库(The Cancer Genome Atlas Program,TCGA,https://genome.ucsc.edu/)预测OGT和AKT之间的相关性。
1.5 统计学方法
使用Image J、Excel软件、GraphPad Prism 8.0软件进行统计学分析。计量资料用均数±标准差(x±s)表示,2组间比较采用t检验,检验水准α=0.05。
2 结 果
2.1 小鼠大体和成瘤情况
实验小鼠注射质粒2~3个月后,大部分小鼠活动度变差,精神萎靡,并逐渐加重。各组成瘤情况见表1,其中pT/ CAGGS-NrasV组在12周成瘤,其成瘤率为80%、pT3-EF1aH YAP S127A组第8周成瘤,成瘤率为70%、pT3-N90-β-catenin组16周成瘤率为70%。
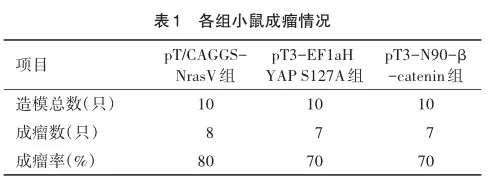
2.2 小鼠肝脏形态学变化
模型小鼠肝脏体积明显增大,肝脏表面出现大量颗粒状、结节样改变(图1A~C),pT/CAGGS-NrasV组肿瘤呈弥漫性生长;其余2组成结节状生长,pT3-EF1aH YAP S127A组有3~6个大小不同的肿瘤结节;pT3-N90-β-catenin组肿瘤结节为1~3个(图1D)。pT/CAGGS-NrasV组与pT3-EF1aH YAP S127A组比较差异有统计学意义(t=4.131,P=0.003);pT/CAGGS-NrasV组与pT3-N90-β-catenin组比较差异有统计学意义(t=8.083,P<0.001);pT3-EF1aH YAP S127A组与pT3-N90-β-catenin组比较差异有统计学意义(t=3.795,P= 0.005)。
肝组织HE染色显示肝索排列紊乱,结构紊乱,并出现肿瘤结节(图2A),其中pT/CAGGS-NrasV组伴随肝细胞脂肪变性。IHC结果显示各组肝癌AFP,PCNA均有阳性表达,提示肝癌细胞增殖较活跃(图2B)。
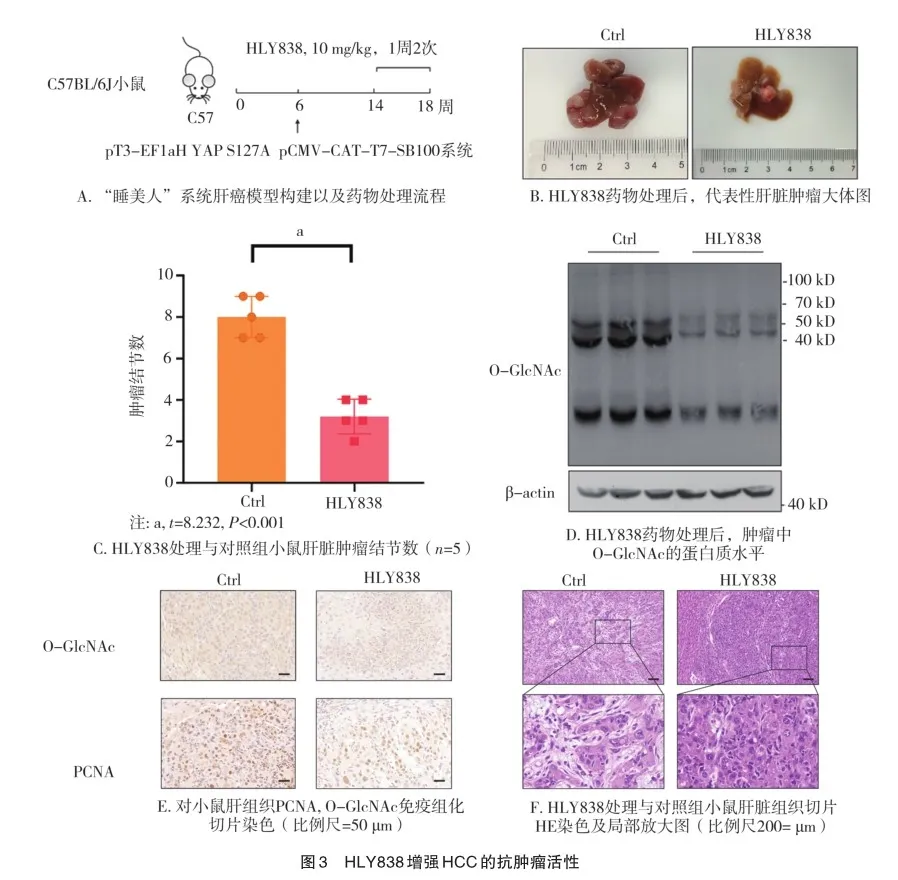
2.3 观察HLY838对“睡美人”构建肝癌模型的治疗效果
本研究选取pT3-EF1aH YAP S127A组构建肝癌模型(图3A),研究OGT抑制剂HLY838对肝癌的治疗效果。实验结果显示,HLY838处理组小鼠肝脏肿瘤结节变小(图3B~C),肝癌增殖指标PCNA表达明显下调(图3E),O-GlcNAc糖基化修饰整体水平降低(图3D),进而抑制肿瘤的进展(图3F)。
2.4 HLY838抗肿瘤活性机制的初步研究
采用80 μmol//L HLY838处理HepG2细胞可以有效抑制细胞内O-GlcNAc修饰水平,并且无明显毒性(图4A)[12]。TCGA数据库发现OGT与AKT的表达有较好的相关性(图4B),并且有文献报道OGT通过影响AKT活化,促进PI3KAKT-mTOR通路的激活[13-14]。本研究也观察到使用OGT抑制剂HLY838后,AKT磷酸化修饰水平下调,提示该信号通路被抑制(图4C)。克隆形成实验和EDU细胞增殖实验发现HLY838抑制HepG2细胞增殖(图4D~E)。
3 讨 论

目前肝肿瘤模型大致可分为4类:自发性肿瘤模型、诱发性肿瘤模型、移植型肿瘤模型、基因修饰型肿瘤模型[15-16]。自发性肝癌模型是指模型动物没有经过人工处置而自发性形成的肿瘤,其最大的优点就是排除了人为因素的干扰,较好还原了动物模型在自然条件下的发病情况[2],但是自发成瘤模型个体差异大、耗时长。常见的诱导型模型通过二乙基硝胺、四氯化碳等化学药物诱导建立肝癌模型,这类模型的诱发因素经人为控制,诱发肿瘤的成功率高于自然发病率[3],但存在建模时间长、动物死亡率较高等缺点。移植型肝癌模型主要有皮下成瘤和原位成瘤等,运用较广,但是该方法对于操作技术要求较高。而基因修饰型肿瘤模型通过基因工程导入特定的促癌基因或者敲除抑癌基因,进而构建肿瘤模型。该方法耗时短,可以研究特定基因对相关肿瘤发生发展的调控作用。
“睡美人”系统是一种转座元件,被用于转座遗传元件,从而导致转基因的体细胞整合。由于SB转座酶在许多不同器官中的多功能活性,它已被广泛用于基因递送和体内基因递送[17]。本研究通过“睡美人”转座子快速将肿瘤致癌基因整合到小鼠基因组中,实现在小鼠肝细胞中过表达目的基因,使其在短时间内发展为肝脏肿瘤[5]。RAS基因是恶性肿瘤中常见的驱动基因,其突变多发生于癌症早期,在多种恶性肿瘤中高频突变并异常活化,是驱动肿瘤发生发展的重要因素。RAS蛋白可以通过调控RAF-MEK-ERK、PI3K/Akt/mTOR等下游通路,进而影响细胞的生长分化以及肿瘤的发生和发展[18-19]。Wnt/β-catenin的异常激活导致多种肿瘤的发生发展[20]。Wnt/β-catenin信号通常在肝癌细胞中过度活跃,其介导的下游靶向基因的激活,如谷氨酰胺合成酶等在肝癌中发挥关键作用,诱导肿瘤发生、生长和侵袭、细胞周期变化等肿瘤病理生理的改变[21]。YAP及其旁系同源物、具有PDZ结合基序(PDZ binding motif,TAZ)的转录共激活因子在促进肝细胞癌的进展中发挥关键作用[22-24]。因此NRAS、β-catenin、YAP等致癌基因的异常激活与肝癌的发生和发展密切相关。
本实验通过尾静脉注射pCMV-CAT-T7-SB100质粒以及pT/CAGGS-NrasV,pT3-N90-β-catenin,pT3-EF1aH Yap S127A构建肝癌模型[10-11,25-26]。“睡美人”系统建模大多采用FVB/N小鼠,本实验采用常规的C57BL/6J小鼠,证实利用“睡美人”系统在C57BL/6J小鼠中建模的可行性。相比于FVB/N小鼠,C57BL/6J小鼠获取途径更为广泛,价格较低。各组成瘤时间进行统计发现,质粒注射8周后,pT3-EF1aH YAP S127A组肝脏表面出现颗粒状、结节样改变,其成瘤率约为70%;pT/CAGGS-NrasV组和pT3-N90-β-catenin组分别在12周、16周后出现肿瘤结节,其小鼠成瘤率分别为80%、70%。后续可以根据实验目的以及实验进程安排选择不同的质粒构建肝癌动物模型。pT3-EF1aH YAP S127A组成瘤时间短,成瘤率高,适用于抗肿瘤药物研究等。pT/CAGGS-NrasV组为肝细胞癌与肝内胆管细胞癌混合肿瘤,肿瘤结节大小适中,但成瘤时间比前2组稍长,可用于观察肿瘤进程和肿瘤演进机制的研究。pT3-N90-β-catenin组多数形成肝细胞癌,对肝细胞癌的研究提供了重要的实验工具。

目前已发现的OGT抑制剂包括底物类似物、双底物抑制剂和高通量筛选抑制剂比如OSMI-1、OSMI-4,在不同的肿瘤模型中显示了一定的抗肿瘤效应[27]。本课题组前期发现了一种基于二酮哌嗪的新的OGT抑制剂HLY838,前期实验发现HLY838可以抑制c-MYC的O-GlcNAc修饰,并在细胞模型和裸鼠体内成瘤模型中观察了HLY838与CDK9联用对肝癌的抑制作用[12],本研究在基于“睡美人”转座系统构建的肝癌动物模型中验证了HLY838具有明显抗肿瘤效应。
因此,本实验基于“睡美人”转座子系统,通过尾静脉注射pCMV-CAT-T7-SB100,pT/CAGGS-NrasV,pT3-N90-β-catenin,pT3-EF1aH Yap S127A质粒成功构建肝细胞癌动物模型。“睡美人”转座子系统构建肝癌模型耗时较短、成瘤率较为稳定、小鼠耐受性好,为肝癌的相关研究提供了重要的动物模型。本实验还初步观察到OGT抑制剂HLY838的抑癌作用,后续将着重阐明HLY838抗肿瘤的确切分子机制,并评估其作为潜在临床靶点的应用前景。
参 考 文 献
[1] Sung H,Ferlay J,Siegel RL,et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 can‐cers in 185 countries[J]. CA Cancer J Clin,2021,71(3):209-249.
[2] Noij DP,van Der Linden PWG. Spontaneous regression of hepato‐cellular carcinoma in a Caucasian male patient:a case report and review of the literature[J]. Mol Clin Oncol,2017,6(2):225-228.
[3] Romualdo GR,Grassi TF,Goto RL,et al. An integrative analysis of chemically-induced cirrhosis-associated hepatocarcinogenesis:Histo‐logical,biochemical and molecular features[J]. Toxicol Lett,2017,281:84-94.
[4] Reiberger T,Chen Y,Ramjiawan RR,et al. An orthotopic mouse model of hepatocellular carcinoma with underlying liver cirrhosis[J]. Nat Protoc,2015,10(8):1264-1274.
[5] Sandoval-Villegas N,Nurieva W,Amberger M,et al. Contempo‐rary transposon tools:a review and guide through mechanisms and appli‐cations of Sleeping beauty,piggyBac and Tol2 for genome engineering[J]. Int J Mol Sci,2021,22(10):5084.
[6] Saha A,Bello D,Fernández-Tejada A. Advances in chemical prob‐ing of protein O-GlcNAc glycosylation:structural role and molecular mechanisms[J]. Chem Soc Rev,2021,50(18):10451-10485.
[7] Hart GW. Nutrient regulation of signaling and transcription[J]. J Biol Chem,2019,294(7):2211-2231.
[8] Zhu Y,Hart GW. Targeting O-GlcNAcylation to develop novel therapeutics[J]. Mol Aspects Med,2021,79:100885.
[9] Zhu Q,Wang HX,Chai SY,et al. O-GlcNAcylation promotes tu‐mor immune evasion by inhibiting PD-L1 lysosomal degradation[J]. Proc Natl Acad Sci USA,2023,120(13):e2216796120.
[10] Chen X,Calvisi DF. Hydrodynamic transfection for generation of novel mouse models for liver cancer research[J]. Am J Pathol,2014,184(4):912-923.
[11] Tang M,Zhao Y,Zhao JH,et al. Liver cancer heterogeneity mod‐eled by in situ genome editing of hepatocytes[J]. Sci Adv,2022,8(25): eabn5683.
[12] Shan XQ,Jiang R,Gou DM,et al. Identification of a diketopiperazine-based O-GlcNAc transferase inhibitor sensitizing he‐patocellular carcinoma to CDK9 inhibition[J]. FEBS J,2023,290(18):4543-4561.
[13] Very N,Vercoutter-Edouart AS,Lefebvre T,et al. Crossdysregulation of O-GlcNAcylation and PI3K/AKT/mTOR axis in human chronic diseases[J]. Front Endocrinol (Lausanne),2018,9:602.
[14] Raab S,Gadault A,Very N,et al. Dual regulation of fatty acid synthase (FASN) expression by O-GlcNAc transferase (OGT) and mTOR pathway in proliferating liver cancer cells[J]. Cell Mol Life Sci,2021,78(13):5397-5413.
[15] Olson B,Li YD,Lin Y,et al. Mouse models for cancer immuno‐therapy research[J]. Cancer Discov,2018,8(11):1358-1365.
[16] May M. Cancer research with a human touch[J]. Nature,2018,556(7700):259-261.
[17] Boehme P,Doerner J,Solanki M,et al. The sleeping beauty trans‐poson vector system for treatment of rare genetic diseases:an unrealized hope?[J]. Curr Gene Ther,2015,15(3):255-265.
[18] Asquith CRM,Temme L. STK19:a new target for NRAS-driven cancer[J]. Nat Rev Drug Discov,2020,19(9):579.
[19] Zhang MQ,Pan JC,Huang P. Interaction between RAS gene and lipid metabolism in cancer[J]. J Zhejiang Univ Med Sci,2021,50(1):17-22.
[20] Ni CJ,Qin XS,Huang ZS. Role of Wnt/β-catenin signaling path‐way in occurrence and development of hepatocellular carcinoma[J]. World Chin J Dig,2021,29(4):190-196.
[21] Ozcan M,Altay O,Lam S,et al. Improvement in the current thera‐pies for hepatocellular carcinoma using a systems medicine approach[J]. Adv Biosyst,2020,4(6):e2000030.
[22] Zhu H,Yan FJ,Yuan T,et al. USP10 promotes proliferation of he‐patocellular carcinoma by deubiquitinating and stabilizing YAP/TAZ[J]. Cancer Res,2020,80(11):2204-2216.
[23] Juan WC,Hong WJ. Targeting the hippo signaling pathway for tis‐sue regeneration and cancer therapy[J]. Genes,2016,7(9):55.
[24] Moya IM,Halder G. Hippo-YAP/TAZ signalling in organ regen‐eration and regenerative medicine[J]. Nat Rev Mol Cell Biol,2019,20(4):211-226.
[25] Ho C,Wang CM,Mattu S,et al. AKT (v-akt murine thymoma vi‐ral oncogene homolog 1) and N-Ras (neuroblastoma ras viral oncogene homolog) coactivation in the mouse liver promotes rapid carcinogenesis by way of mTOR(mammalian target of rapamycin complex 1),FOXM1(forkhead box M1)/SKP2,and c-Myc pathways[J]. Hepatology,2012,55(3):833-845.
[26] Sun RQ,Zhang ZY,Bao RX,et al. Loss of SIRT5 promotes bile acid-induced immunosuppressive microenvironment and hepatocarcino‐genesis[J]. J Hepatol,2022,77(2):453-466.
[27] Zhang N,Jiang HL,Zhang KX,et al. OGT as potential novel tar‐get:structure,function and inhibitors[J]. Chem Biol Interact,2022,357:109886.
(责任编辑:曾 玲)
本文引用格式:
梁惠钧,黄露义,汪 凯,等. 基于“睡美人”转座系统观察OGT抑制剂HLY838对肝癌的治疗作用[J]. 重庆医科大学学报,2025,50(1):30-36.

