不同浓度EM菌对凡纳滨对虾生长及肠道菌群的影响


摘" 要:为探究不同浓度EM菌(Effective Microorganisms)对凡纳滨对虾(Litopenaeus vannamei)生长性能的影响,试验选用体长3.0 cm的凡纳滨对虾虾苗,向水中添加EM菌,养殖周期为60 d,试验分为试验组1、试验组2、试验组3(水体中菌液浓度分别为1×104、1.5×104、2×104 CFU/mL)和对照组(对照组不添加EM菌)。结果显示,1×104 CFU/mL组凡纳滨对虾的生长性能最佳,1.5×104 CFU/mL组对凡纳滨对虾生长指标和存活率无显著影响(P>0.05),2×104 CFU/mL组提高了特定生长率。与对照组相比,试验组肠道细菌数量有显著增加(P<0.05),试验组2中,OUT数量显著增加(P<0.05),试验组3中,在水中添加2×104 CFU/mL的EM菌可提高对虾肠道菌群物种丰度。相较于对照组,试验组1能提高凡纳滨对虾的食物转化率、摄食率和成活率。该研究有助于了解水体中EM菌浓度对凡纳滨对虾的生长和肠道细菌群落的作用,为凡纳滨对虾的疾病管理和养殖提供一定的理论依据。
关键词:凡纳滨对虾(Litopenaeus vannamei);EM菌(Effective Microorganisms);生长性能;肠道菌群;养殖
中图分类号:S966.12 文献标志码:A
凡纳滨对虾(Litopenaeus vannamei)又称南美白对虾,也叫白脚虾,正常体色为青蓝色或青灰色,全身无斑纹[1]。其盛产于南美洲大西洋沿岸,特点是生存能力极强,生长发育速度很快,产肉率较高,对饲粮中的蛋白质含量的要求较低,中国以及世界各地都在大规模养殖,是当今世界三大养殖虾种之一。但是近几年由于养殖的密度过高使对虾在养殖过程中容易发病死亡,让对虾的产量下降,使养殖户承受较多损失。由于长期使用抗生素等化学药物,不仅使病原菌产生了耐药性,引起内源性感染及二重感染,破坏了水产动物消化道内正常菌群生态环境,使其产生免疫抑制作用,抗生素在水产动物体内的积累对人类健康也是一种潜在威胁[2]。随着养殖技术的逐渐发展,益生菌被作为营养添加剂加入了养殖过程中,使用益生菌能在不产生抗生素副作用的前提下,起到促进水生动物生长发育的作用。近几年,有益菌在水产动物的养殖过程中已经吸引了大家的关注。EM菌(Effective Microorganisms)有效微生物菌剂是由光合细菌、放线菌、酵母菌、乳酸菌等5科10属80多种微生物复合培养而成[3]。自20世纪80年代初问世以来,EM菌技术已在100多个国家和地区得到推广和应用[3]。在水产养殖方面,李跃华等在青虾的养殖中使用EM菌时发现,提高了初级生产力,与对照池相比试验池产量约高出6%,试验池含磷总量以及溶解氧显著增加[4]。目前主要研究了EM菌可以提高水生动物的存活率、调节水质、抑制有害病菌的生长,并且降低亚硝酸盐的含量、提高磷元素的利用率等[5]。但是目前对于不同浓度的EM菌对凡纳滨对虾生长性能及其肠道菌群的影响研究较少,为此,该试验开展不同浓度下的EM菌对凡纳滨对虾影响的研究。
1 材料与方法
1.1 试验材料
凡纳滨对虾由大连德洋水产养殖有限公司提供,体长(3.0±0.2 )cm,体质量(0.47±0.05)g的凡纳滨对虾虾苗720尾,虾的附肢完整健康、活力好;EM菌剂由江西天意生物技术有限公司提供;水泥池6口(体积4 m×4 m×2 m),1 m×1 m网箱12个。
1.2 试验设计和方法
1.2.1 试验设计
将720尾凡纳滨对虾苗人工养殖60 d,设置4口养殖水泥池,试验分三个试验组和一个对照组,每口水泥池10 m3水体,每个水泥池设3个平行,每个水泥池放置三个网箱,网箱面积为1 m×1 m,每个网箱投放虾苗60尾,共720尾虾苗,向水体中添加EM菌养殖60 d。试验组分别投放EM菌,使水体中菌液浓度分别为1×104 CFU/mL、1.5×104 CFU/mL、2×104 CFU/mL,对照组不投放EM菌。
1.2.2 试验对虾样品采集
凡纳滨对虾养殖60 d后停食24 h,每个平行组随机捞取6尾对虾,然后用灭完菌的医用解剖剪在冰上解剖虾体,解剖的凡纳滨对虾肠道放入1.5 mL的离心管中,并放入液氮中暂存,取样完成后保存于-80℃冰箱,每次取虾肠道后在酒精灯高温灭菌后,再取下一个对虾的肠道。
1.2.3 肠道菌群基因组测序分析
进行细菌DNA提取、16S rDNA特异引物PCR扩增、扩增引物纯化、DNA测序、序列比对等步骤,首先对原始数据进行拼接、过滤,得到有效数据(Clean Data),然后基于有效数据进行OTUs(OPerational Taxonomic Units)聚类和物种分类分析[5]。根据OTUs聚类结果,一方面对每个OTU的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况[5]。同时对OTUs进行丰度、AlPha多样性计算、Venn图和花瓣图等分析,以得到样本内物种丰富度和均匀度信息、不同样本或分组间的共有和特有OTUs信息等[6]。另一方面,可以对OTUs进行多序列比对并构建系统发生树,通过PCoA、PCA、NMDS等降维分析和样本聚类树展示,可以探究不同样本或组别间群落结构的差异[6]。
1.3 日常管理
试验虾每天早晚饱食投喂1次(8∶00,18∶00),每日投喂量为虾苗体质量的7%,每天吸污1次,每天适量补充收集残饵和粪便流失的水量,5 d~7 d按网箱体积(100 cm×100 cm×100 cm,水体800 L)1/3~1/2的量换一次水,菌投放时间间隔为3 d。试验期间溶解氧≥6 mg/L,盐度2.5‰,pH值8.0~8.5,水温24 ℃~27 ℃,总碱度0.16 mmol/L,总硬度0.3 mmol/L。
1.4 计算公式
食物转化率(FCE,%)、摄食率(FI,%/day)、特定生长率(SGR,%/day)
食物转化率FCE=100(W2 - W1)/ F
摄食率FI=100×C / [T ×(W2 - W1)/ 2]
特定生长率SGR=100×(InW2 - InW1)/ T
存活率=Nt/ N0 × 100 %
式中,W2、W1分别表示凡纳滨对虾最终体质量和起始体质量(g),F表示饲料摄入量,T表示生长天数,C表示凡纳滨对虾所摄食饲料的干物质量(g),Nt和N0分别为终末尾数和初始尾数。
1.5 试验数据分析
试验数据处理用SPSS 27进行单因素方差分析,各个处理组之间存在显著差异(Plt;0.05),采用Duncan多重比较。试验数据采用平均值±标准差表示,不同字母(a,b,ab)用于表示组间的显著性差异,相同字母的组之间无显著差异,不同字母的组之间存在显著差异(Plt;0.05)。
2 结果
2.1 不同浓度的EM菌剂对凡纳滨对虾体质量的变化
如表1所示,与对照组相比,试验组1和试验组3凡纳滨对虾的体质量增长显著(P<0.05),试验组2较对照组凡纳滨对虾体质量有增长但是不显著(P>0.05)。
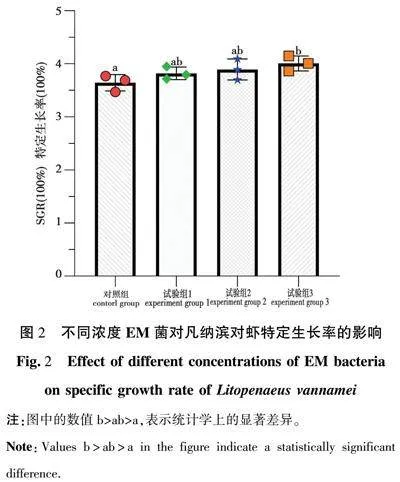
2.2 凡纳滨对虾食物转化率
如图1所示,对照组(a)与试验组1(b)有显著差异,即试验组1的FCE明显高于对照组,说明该处理显著提高了食物转化率(Plt;0.05)。试验组1(b)与试验组2(ab)、试验组3(ab)之间没有显著差异(P>0.05),试验组2(ab)和试验组3(ab)与对照组(a)之间没有显著性差异,但与试验组1(b)相比略低,说明这两个处理组可能提升了FCE,但效果没有达到统计学显著性(P>0.05)。
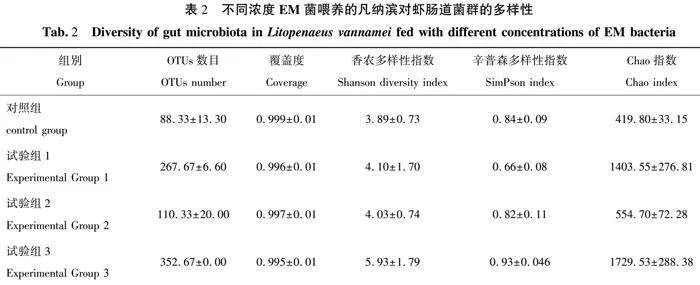
2.3 凡纳滨对虾特定生长率
如图2所示,对照组(a)与试验组3(b)之间存在显著差异(P<0.05),试验组3的处理方式显著提高了特定生长率(SGR)。试验组试验组2(ab)均与对照组(a)和试验组3(b)无显著差异(P>0.05),说明这两个组的SGR介于对照组和试验组3之间,但未达到统计学显著性(P>0.05)。试验组1(ab)和试验组2(ab)与试验组3(b)之间也无显著差异(P>0.05)。
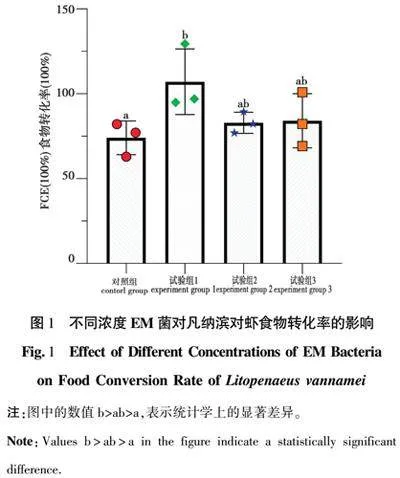
2.4 凡纳滨对虾摄食率
如图3所示,与对照组相比,试验组1凡纳滨对虾的摄食率有显著差异(P<0.05),试验组2和试验组3的凡纳滨对虾摄食率没有显著性差异(P>0.05);试验组1与试验组2和试验组3相比,凡纳滨对虾摄食率没有显著差异(P>0.05)。
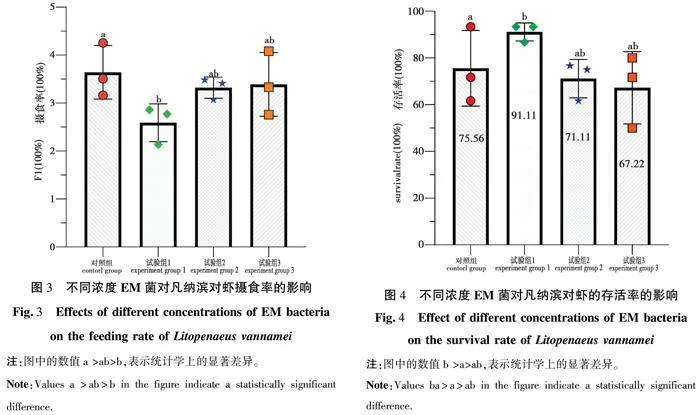
2.5 凡纳滨对虾成活率
如图4所示,对照组的成活率为75.56%,试验组1的成活率为91%,试验组2的成活率为71.11%,试验组3成活率为67.22%。
2.6 凡纳滨对虾肠道菌群结果分析
如表2所示,饲料中添加不同浓度的EM菌对凡纳滨对虾肠道有效OTUs数目有显著影响(P<0.05),肠道OTUs数目最高值出现在试验组3,用Alpha多样性分析对虾肠道微生物群落的多样性,各组肠道菌群检测覆盖率指数均大于0.99。与对照组相比,试验组3的香浓多样性、辛普森多样性和Chao指数差异性显著(P<0.05)。
如图5所示,在门水平上,对虾肠道菌群主要包含放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、未被定义的菌门(unidentified Bacteria)为主,各组菌群类别基本一致,但是相对丰度存在一定差异。所有试验组中的变形菌门相对丰度较对照组有下降趋势,试验组2中厚壁菌门的相对丰度显著高于对照组(P<0.05)。与对照组相比,添加EM菌的各试验组的变形菌门较对照组其相对丰度均下降,而厚壁菌门有所升高。
由图6所示,在属水平上,肠道菌群主要由弧菌属(Vibrio)、念珠菌属 (Candidatus Bacilloplasma)、气单胞菌属(Aeromonas)、希瓦氏菌属(Shewanella)、乳酸杆菌属(Lactobacillus)、不动杆菌属(Acinetobacter)组成。其中,所有试验组中念珠菌属、弧菌属的相对丰度均高于对照组(P<0.05),而所有试验组中的希瓦氏菌属和乳酸杆菌属相对丰度显著低于对照组(P>0.05)。试验组3中气单胞菌属相对丰度高于对照组(P<0.05)。
3 讨论
3.1 EM菌对凡纳滨对虾生长的影响
研究表明,EM菌不仅可以提高水生动物的存活率,而且是一种无污染、能够抑制有害病菌的生长,而且还能降低硝酸盐的含量,提高磷元素的利用率等[7]。伍丽等在饲料中直接添加EM菌,试验表明有效改善了鲫鱼和大口鲶的血液指标,并且增强了机体的新陈代谢,促进了养殖鱼类的生长,该试验结果与之相符合[8]。
该研究结果显示试验组与对照组相比,添加了EM菌的试验组中的凡纳滨对虾的特定生长率逐渐随着添加的EM菌浓度的增高而增高,说明EM菌对水产养殖动物的特定生长率起到直接促进作用。武鹏在对幼参进行试验时发现,不同浓度之间,试验范围内浓度越大对幼参生长的促进作用越显著(P<0.05)[9]。这可能与投喂浓度高,有益菌可以更快进入和定植幼参肠道,提高幼参消化吸收率有关[9]。该试验与武鹏等的实验结果是相似的,即添加EM菌对凡纳滨对虾的特定生长率起到良好的促进作用,且在一定限度内,随着EM菌的浓度升高,其特定生长率也在升高。胡京等通过研究4个EM菌剂处理组显著高于对照组(P<0.05),对海参的生长性能均有显著提高,其中工2-L组效果最显著(P<0.05),质量增加率达到84.0%。试验表明,在一定限度内,随着EM菌的浓度升高,其特定生长率也在升高[10]。该试验结果与胡京、董琦、张春岩等研究结果相似。这可能是因为EM菌本身就有大量的营养物质,当它们在动物的肠道内定植、繁衍和代谢之后,就可以产生动物生长需要的氨基酸、促生长因子和多种酶,以此来增强机体的代谢能力,让机体能充分利用养分,使养殖对象快速生长。
3.2 EM菌对凡纳滨对虾肠道菌群的影响
虾肠道内富含许多微生物,其中包括一些能够代谢蛋白质的细菌和酵母菌,将蛋白质分解成小分子的氨基酸,提供给对虾进行吸收利用,正常肠道微生物菌群在机体内构成一道天然屏障,对动物营养、生长健康、免疫等方方面面起着重要的作用[11]。对虾的消化、吸收、代谢、肠道发育和免疫系统防御能力与肠道菌群有着微妙的关系,肠道菌群对于虾类的生长有着重要意义,也对对虾生存有重要的生理意义[12]。研究表明健康虾肠道菌群代谢氨基酸可能通过合成蛋白质、酶和激素等功能来维持健康状态并提供能量[13]。也有研究报道,益生菌可以对有害菌产生拮抗作用,来竞争营养物质与生存繁殖空间,从而达到抑菌目的,也改善水产动物的肠道微生物组成[14]。该试验中,与对照组相比,试验组中凡纳滨对虾食物转化率、特定生长率、成活率都有提高,说明了所选浓度的EM菌剂能提高凡纳滨对虾对饲料的利用率,促进凡纳滨对虾的生长和成活。
4 结论
该试验的结果表明,与其他三组相比,试验组3,在水中添加2×104 CFU/mL的EM菌可以提高对虾肠道菌群物种丰度,这应该与EM菌的浓度及营养成分有关,与对照组相比,试验组2横轴上的跨度垂直方向与平滑程度相似,没有提高对虾肠道菌群丰度,这可能与EM菌的浓度有关系,也可能受到其他因素的影响。综上所述,添加1×104 CFU/mL的EM菌对凡纳滨对虾的生长性能最佳,而1.5×104 CFU/mL的EM菌组则对凡纳滨对虾生长指标和存活率无显著影响(P>0.05),2×104 CFU/mL的EM菌组只是提高了特定生长率。因为EM菌作为水质调节剂投入养殖水体中,通过多种具有益生功能的不同属的多个细菌相互协同作用,改善养殖环境,抑制环境中的病原菌来促进水产动物的生长。该研究有助于了解EM菌对南美白虾肠道细菌群落的影响,为凡纳滨对虾的疾病管理和健康养殖提供理论依据。但是益生菌是如何作用于宿主肠道菌群并优化其菌群结构的,有待于进一步的研究。
参考文献:
[1]何淑君.南美白对虾温棚养殖技术简介[J].渔业致富指南,2023(3):49-50.
[2]WANG Yamin,WANG Yingeng.Advance in the Mechanisms and Application of Microecologics in Aquaculture[J].Progress in Veterinary Medicine2008,29(6):72-75.
[3]夏蒙,李朋富.微生态制剂作用机理及其在水产养殖中的应用[J].黑龙江水产,2013(2):39-41.
[4]李跃华,葛家春,彭刚,等.二种微生物制剂对青虾池水质和生长的影响[J].水产养殖,2009,30(10):65-67+70.
[5]CHUMPOL S P, KANTACHOTE D P, NITODAT,et al.The roles of probiotic purple n-onsulfor bacteria to control water quality and prevent acute hepatopancreati-cnecrosis disease (AHPND) for enhancement growth with higher survival in white shrimp (Litopenaeus vannamei) during cultivation[J].Aquaculture,2017,473(2):327-336.
[6]郝爽,张振国,尤宏争,等.复合益生菌对凡纳滨对虾肠道菌群结构的影响[J].水产科学,2022,41(4):597-604.
[7]周红艳,陈丽珊,黄艳清. EM菌剂与EDTA配施对铜、铅复合污染下黑麦草种子萌发和生长及重金属吸收的影响[J].江西农业学报,2021,33(11):145-150.
[8]伍莉,陈鹏飞.微生态制剂对大口鲇和鲫鱼生长及血液指标的影响[J].西南师范大学学报(自然科学版),2007(1):82-86.
[9]武鹏,赵大千,蔡欢欢,等. 3种微生态制剂对水质及刺参幼参生长的影响[J].大连海洋大学学报,2013,28(1):21-26.
[10]胡京,董琦,张春岩,等.两种EM菌剂对养殖水体水质及幼刺参生长性能的影响[J].大连工业大学学报,2016,35(2):79-83.
[11]李舢舢,赵晨曦,吴波,等.肝肠胞虫对凡纳滨对虾肠道和肝胰腺菌群的影响[J].水生生物学报,2024,48(2):315-323.
[12]郑军荣,罗婷,李志强,等.4株凡纳滨对虾肠道益生菌分离、鉴定及应用研究[J].水产科学,2019,38(3):320-326.
[13]HUANG Zhishu, AWEYA J J, ZHU Chunhua, et al. Modulation of crustacean innate immune response by amino acids and their metabolites:inferences from other species[J]. Frontiers in Immunology,2020(11):574721.
[14]孙永旭,董宏标,段亚飞,等.鱼类肠道应激及其损伤防护研究进展[J].海洋湖沼通报,2019(3):174-183.
The effect of different concentrations of EM bacteria on the growthand intestinal flora of Litopenaeus vannamei
LING Zhan1, WANG Zhengang1,2, LIU Gang1, WANG Maolin1, ZHANG Wei3
(1.Dalian Ocean University, Key Laboratory of Applied Biology and Augmentation of Northern Fish in Liaoning Province, Dalian 116023, Liaoning China; 2.Donggang Aquatic Technology Promotion Station, Dandong" 118399, Liaoning China; 3. Donggang City Huangtukan Farm Co., LTD., Dandong 118300, Liaoning China)
Abstract:In order to explore the effects of different concentrations of Effective Microorganisms on the growth performance of Litopenaeus vannamei, larvae of 3.0 cm long Litopenaeus vannamei were selected and added into the water. The culture period was 60 days. The experiment was divided into experimental groups 1, 2 and 3 (the concentration of bacterial liquid in water was 1×104, 1.5×104 and 2×104 CFU/mL, respectively) and control group (no EM bacteria was added in the control group). The results showed that 1×104 CFU/mL group had the best growth performance, 1.5×104 CFU/mL group had no significant effects on the growth index and survival rate of Litopenaeus vannamei (Pgt;0.05), and 2×104 CFU/mL group increased the specific growth rate. Compared with the control group, the number of intestinal bacteria in test group was significantly increased (Plt;0.05), the number of OUT in test group 2 was significantly increased (Plt;0.05), and the species abundance of intestinal flora in test group 3 was increased by adding 2×104 CFU/mL EM bacteria in water. Compared with the control group, experimental group 1 could improve the food conversion rate, feeding rate and survival rate of Litopenaeus vannamei. This study helps to understand the effects of EM bacteria on the growth and intestinal bacterial community of Litopenaeus vannamei, and provides a theoretical basis for disease management and culture of Litopenaeus vannamei.
Keywords:Litopenaeus vannamei; Effective Microorganisms (EM); growth performance; Intestinal flora; culture
基金项目:2021年辽宁省海洋经济发展项目资助;辽宁省教育厅面上项目(JYTMS20230500)。
作者简介:凌战(1999- ),男,硕士在读。主要从事水产养殖学研究。E-mail:13327756486@163.com。
通讯作者:王茂林(1980- ),男,博士,副教授。主要从事水产养殖学、鱼类生理生态学研究。E-mail:wangmaolin@dlou.edu.cn。

